Luce vivente: la chimica della bioluminescenza Teach article
Tradotto da Eleonora Minelli. Accendi le tue lezioni di chimica con la bioluminescenza.

Immagine gentilmente
concessa da Chris Favero; fonte
dell’immagine: Flickr
Le manifestazioni di bioluminescenza sono una delle meraviglie della natura. L’assoluta bellezza delle lucciole danzanti, o le brillanti onde prodotte dal plankton oceanico, hanno affascinato l’uomo per millenni. Mentre noi ancora oggi ammiriamo queste manifestazioni, siamo anche in grado di capirne la chimica alla base – e adattarla per usi in laboratorio.
Molti organismi, dagli insetti ai pesci, dai molluschi ai batteri e al plankton, possono produrre luce – e ciò è noto da centinaia di anni. Già l’autore Plinio il Vecchio descrisse un mollusco edibile, il Pholas dactylus, che, preoccupantemente, emetteva luce quando mangiato. Lo stesso Plinio notò anche un fungo lignicolo, Omphalotus olearius, in grado di produrre un brillante bagliore notturno.
La più spettacolare manifestazione di bioluminescenza rimane forse quella proveniente dal plankton dinoflagellate, che illumina le onde di un colore blu brillante talvolta visibile sulla superficie dell’oceano. Negli abissi oceanici si trovano invece forme più esotiche di bioluminescenza; dove la luce del sole non arriva molte specie hanno sviluppato una propria illuminazione. Notoriamente, la rana pescatrice utilizza una lumino pendente per attirare le prede verso le sue fauci.

Immagine gentilmente
concessa da Terry Priest; fonte
dell’immagine: Flickr
La bioluminescenza – la luce prodotta dagli organismi viventi – è molto diffusa in natura, ma quali vantaggi porta alle specie che ne fanno uso? Ce ne sono molti, tra cui:
- Aposematismo (tossicità apparente) – per sembrare velenose ai possibile predatori. Esempio: le lucciole Photinus ignitus e Lucidata atra.
- Difesa – spaventare i predatori emettendo intermittenti lampi luminosi. Esempio: i Myctophidae anche detti pesci lanterna.
- Corteggiamento – per comunicare prima e dopo l’accoppiamento. Esempio: le lucciole.
- Adescamento – usare la luce come esca per attirare le prede. Esempio: la rana pescatrice.
- Mimetizzazione – Per aiutare gli animali a mimetizzarsi con l’ambiente circostante. Un animale in mare può infatti apparire scuro rispetto alla lucentezza della superficie dell’acqua, dunque produrre la propria luce può aiutare i pesci abissali a nascondersi da possibili predatori. Esempio: calamari come Abralia verany.
Colori Luminescenti
In natura, la bioluminescenza produce diversi colori: principalmente il blu, il verde e il giallo. Il colore che ogni specie emette dipende dall’ambiente in cui essa si è evoluta. La luce blu è più spesso osservata nell’oceano profondo, la luce verde nelle specie che vivono lungo le coste, e quella gialla (ma anche verde) nelle specie terrestri e di acqua dolce.
Ma quale è la chimica alla base del fenomeno di bioluminescenza? E come i differenti colori – blu, verde, giallo – sono ottenuti?
Chimicamente, la maggior parte della bioluminescenza è dovuta a reazioni di ossidazione: l’ossigeno reagisce con delle sostanze dette luciferine, producendo energia sotto forma di luce. Le reazioni sono catalizzate da enzimi detti luciferasi. In questo processo, le luciferine vengono ossidate. Come mostrato in tabella 1, le luciferine sono usate da differenti specie e la forma ossiluciferina può essere molto diversa dal punto di vista chimico.
|
Specie bioluminescente |
Luciferina |
Ossiluciferina |
|---|---|---|
|
Dinoflagellate |
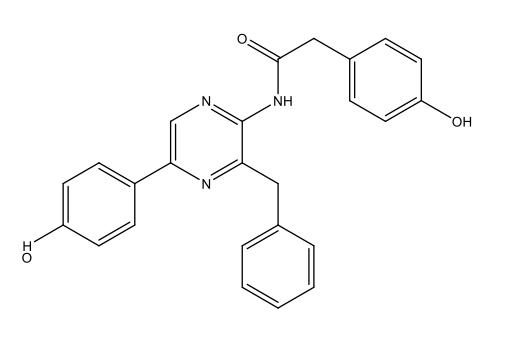
Luciferina Dinoflagellate [3 Dinoflagellate luciferin.docx] C33H3806N4Na2 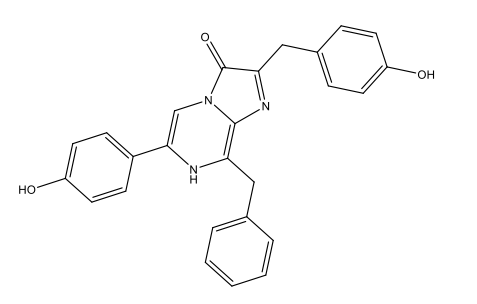 |
 |
|
Calamaro, alcuni gamberi, alcuni pesci |
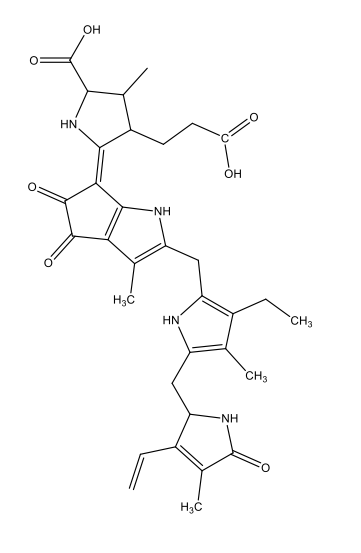
Coelenterazina [1 coelenterazine luciferin.docx] C26H2103N3 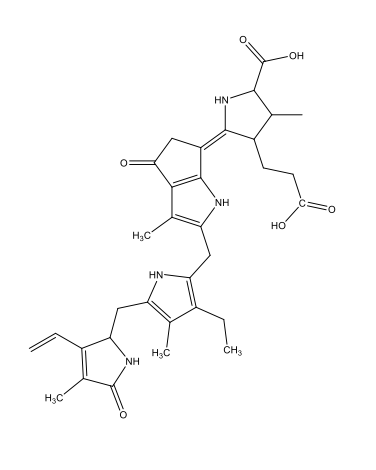 |
 |
|
Lucciole |
Luciferina delle lucciole [5 firefly luciferin.docx] C11H8N2O3S2 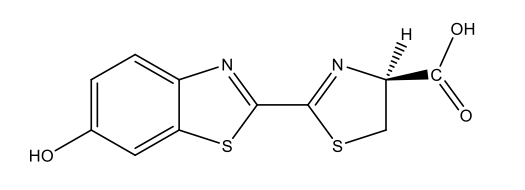 |
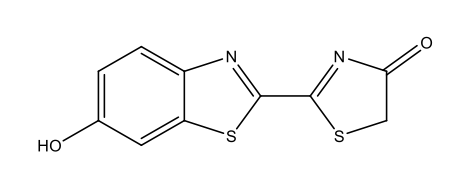 |
Queste reazioni sono molto efficienti, con circa il 98 % dell’energia convertita in luce. Basti pensare che le tradizionali lampadine a filamento disperdono la maggior parte dell’energia sotto forma di calore ed hanno una efficienza di circa il 2%.
Come accade in diverse specie, alcune luciferine possono produrre luce di più colori (vedi tabella 2). Molecole aggiuntive in grado di emettere luce, i fluorofori, possono inoltre modificare il colore della luminescenza. La medusa Aequorea victoria contiene uno di questi fluorofori, conosciuto come green fluorescent protein (GFP). La GFP assorbe la luce blu prodotta dalla reazione iniziale e la ri-emette ad una lunghezza d’onda maggiore come luce verde, quindi la bioluminescenza di tale medusa risulta verde.
|
Luciferina |
Luminescenza massima (nm) |
Colore approssimativow1 |
|
|---|---|---|---|
| Luciferina delle lucciole | 560 (at pH=7.1) | Verde |
 |
| 615 (at pH=5.4) | Arancio |
 |
|
| Luciferina batterica | 490 | Turchese |
 |
| Luciferina dinoflagellate | 474 | Blu |
 |
| Coelenterazina | 450-480 come anione | Da blu a turchese |
 |
| 400 nella forma COOH | Viola |
 |
|
INegli ultimi anni, questo particolare sistema di bioluminescenza è largamente impiegato nella ricerca scientifica: il gene che codifica per la GFP è infatti usato come ‘tag’ genetico per tracciare specifiche proteine e rivelare quando un particolare gene sia espresso. Poiché la GFP emette luce verde se stimolata con luce blu o raggi UV, è molto facile da individuare (vedi Furtado, 2009). La scoperta di questa tecnica fu considerata così importante da vincere il Premio Nobel per la Chimica nel 2008w2.
Fortunatamente per noi, è piuttosto facile replicare in laboratorio il tipo di reazione chimica alla base della bioluminescenza, come dimostra l’attività proposta di seguito.
Attività per gli studenti: la bioluminescenza in laboratorio
In questa attività, gli studenti potranno veder avvenire la reazione della luminescenza. l’ingrediente di base è il luminol, un chemioluminescente sintetico che produce luce blu in seguito ad una specifica reazione chimica. Anche se le reazioni della luciferina e del luminol sono differenti – infatti la reazione di ossidazione del luminol è catalizzata dal ferricianuro di potassio piuttosto che da un enzima (per maggiori dettagli, vedi Welsh, 2011) – il risultato è lo stesso: la luminescenza.
Il passaggio finale dell’esperienza dovrebbe essere condotto in una stanza buia così da poter apprezzare la maggior parte della luce emessa.
Materiali
- 1 g di luminol (5-ammino-2,3-diidro-1,4-ftalazindione)
- 50 ml soluzione di idrossido di sodio (NaOH) 10% m/m
- 50 ml di soluzione di ferricianuro di potassio (K3[Fe(CN)6]) 3% m/m
- Circa 0.5 g di ferricianuro di potassio (K3[Fe(CN)6])
- 3 ml di perossido di idrogeno (H2O2) soluzione 30% m/m
- Acqua distillata
- Beaker
- Imbuto
- Cilindri graduati
- Flask
Procedure
Note per la sicurezza
Occhiali da protezione, camice e guanti dovrebbero essere indossati. Maneggiare con cura la soluzione al 30% di perossido di idrogeno, poiché essa può reagire violentemente in presenza di un catalizzatore. Chiudere la bottiglia non appena siano stati prelevati i 3 ml di soluzione.
Vedere anche le note generali per la sicurezza di Science in School.
- In un Becker, dissolvere 1 g di luminol in 450 ml di acqua distillata.
- Aggiungere 50 ml della soluzione al 10% di idrossido di sodio e mescolare.
- Prelevare 50 ml della soluzione ottenuta e aggiungerli a 350 ml di acqua distillata in un altro becker. Questa è adesso la Soluzione A.
- In un terzo becker, mescolare 50 ml della soluzione al 3% di ferricianuro di potassio con 350 ml di acqua distillata e 3 ml della soluzione al 30% di perossido di idrogeno. Questa è la Soluzione B.
- Porre una stessa quantità delle Soluzioni A e B in due cilindri separati.
- Mettere un po’ di ferrocianuro di potassio in una flask, e porre l’imbuto su di essa.
- Spostare la flask in una stanza buia.
- Porre le Soluzioni A e B nella flask contemporaneamente , e osservare cosa accade.
Apparirà una meravigliosa luminescenza blu!
- Smaltimento: Scaldare la soluzione in una cappa aspirante da laboratorio fino a ridurne il volume di 1/8 rispetto a quello iniziale, quindi versare la soluzione rimanente in un apposito contenitore di metallo pesante.
Cosa sta succedendo?
L’ossidazione del luminol avviene in diversi step.
- Preparando la Soluzione A (step 2) il luminol reagisce con la base (OH–):
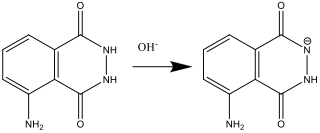
- Preparando la Soluzione B (step 4), Il perossido di idrogeno si decompone nella forma di anione superossido O2–. Questa reazione è catalizzata dallo ione ferricianuro (III).
- Quando le Soluzioni A e B sono mescolate insieme (step 8), il luminol viene ossidato dall’anione ferricianuro (III), formando un’anione radicale:
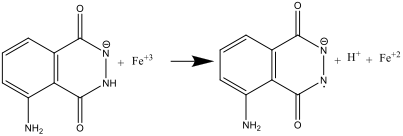
Lo ione ferrocianuro ha due ruoli: catalizzare la formazione del superossido O2–, e ossidare il luminol nell’anione radicale. Il ferro ha bisogno di essere nel complesso [Fe(CN)6] 3 per prevenire la precipitazione di Fe(OH)3 nell’ambiente fortemente alcalino.
- l’anione radicale del luminol e l’anione superossido, O2–, reagiscono:
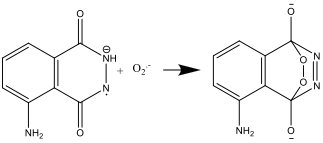
- Il composto risultante è instabile e si decompone producendo nitrogeno e una forma eccitata dello ione aminoftalato:
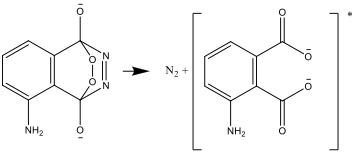
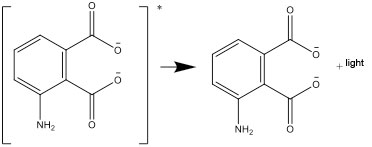
- Lo stato eccitato decade in uno stato stabile, emettendo la differenza di energia sotto forma di luce:
Domande per la discussione
- Nella reazione del luminol, da dove viene l’energia per emettere luce?
- Qual è il ruolo del ferricianuro di potassio? Nella luminescenza naturale, quale sostanza ha il suo stesso ruolo?
- Quale sostanza è responsabile per l’ossidazione del luminol? è la stessa in natura?
Approfondimenti
Ci sono molte informazioni disponibili sulla bioluminescenza (vedi la sezione Fonti per degli esempi). Lo studente può proseguire l’attività effettuando delle ricerche. Per esempio:
- Gi usi della bioluminescenza in natura. Trovare altre ragioni per cui la bioluminescenza è un utile adattamento. Per ogni caso identificare alcune specie.
- La chimica della bioluminescenza. Trovare alcune specifiche reazioni di chemioluminescenza che avvengono in natura. Quanto sono simili alla reazione del luminol?
- I colori della bioluminescenza. Trovare altri modi in cui essi sono prodotti.
- L’evoluzione della bioluminescenza. Si è evoluta più volte o una sola volta?
- L’uso del luminol sulla scena del crimine. Trovare come il luminol viene utilizzato nella scienza forense e la chimica alla base di questo uso (vedi Welsh, 2011).
Studiare chimica con Plinio il Vecchio
Questa attività fa parte di un più ampio progetto interdisciplinare, sviluppato insieme a studenti di 14-15 anni di età, per esplorare le antiche tecniche scientifiche. Plinio il Vecchio (23-79 a.C.) fu un autore latino e un naturalista la cui enciclopedia, Naturalis Historia, raccoglieva la maggior parte delle conoscenze scientifiche dell’epoca. Noi abbiamo iniziato ogni argomento analizzando un passaggio da Naturalis Historia e poi discusso su come ricreare l’esperimento descritto nel testo o un esperimento simile.
In questo modo, gli studenti hanno iniziato nello stesso stato pre-scientifico di Plinio, e attraverso esperienze di laboratorio e discussioni, raggiunto una conoscenza scientifica moderna dell’argomento. Questo processo motiva anche gli studenti meno entusiasti.
Altre attività del progetto includono sintetizzare indigo (Farusi, 2012), ricreare profumi antichi (Farusi, 2011), prepare tessere di vetro con acido borico e preparare inchiostro ai sali di ferro (Farusi, 2007). L’intero progetto è stato presentato al festival internazionale Science on Stagew3 a Copenhagen, Danimarca, nel 2011.
References
- Farusi G (2007) L’inchiostro dei monaci: un percorso fra chimica e storia. Science in School 6: 36-40.
- Farusi G (2011) Profuma come Giulio Cesare: riprodurre profumi antichi in laboratorio. Science in School 21: 40-46.
- Farusi G (2012) Indigo: recreating Pharaoh’s dye. Science in School 24: 40-46.
- Furtado S (2009) GFP: la vita dipinta di verde. Science in School 12: 19-23.
- Welsh E (2011) Cos’è la chemiluminescenza? Science in School 19: 62-68.
Web References
- w1 – un semplice strumento per convertire una lunghezza d’onda in nanometri in colore RGB o esadecimale.
- w2 – link accessibile sul Premio Nobel per la Chimica del 2008 vinto da Osamu Shimora, Martin Chalfie e Roger Y Tsien.
- w3 – Science on Stage è un network di eventi locali, nazionali ed internazionali per insegnanti, lanciato nel 1999 da EIROforum, editore di Science in School. Ad ogni evento nazionale, viene selezionata una delegazione di insegnati per rappresentare il proprio paese al festival internazionale dell’insegnamento Science on Stage. Durante il festival, circa 350 insegnanti della scuola primaria e secondaria provenienti da 25 paesi condividono le loro più innovative idee di insegnamento tramite workshop e performance.
Il prossimo festival internazionale si terrà dal 29 giugno al 2 luglio 2017, a Debrecen, Ungheria. I partecipanti verranno selezionati durante le competizioni agli eventi nazionali nei 25 paesi. Per avere maggiori informazione riguardo le modalità di iscrizione, contattare il proprio organizzatore nazionale.
Resources
- Due articoli accessibili sulla (bio)luminescenza:
- Douglas P, Garley M (2010) Chimica e luce. Science in School 14: 63-68.
- Judson O (2015) Luminous life. National Geographic.
- Una elegante e utile animazione sulla bioluminescenza.
- Un affascinante video con musica che celebra la bellezza della bioluminescenza dell’oceano.
- Un breve video che dimostra come fare il luminol.
- Un video più lungo che mostra come fare il luminol.
Institutions
Science on StageReview
La bioluminescenza ha affascinato le persone per migliaia di anni e continua ad essere un popolare argomento di ricerca, in particolare in progetti di esplorazione oceanica. Le reazioni chimiche che portano alla produzione della luce da parte di organismi viventi sono un grande esempio di biochimica. L’attività pratica descritta in questo articolo è utile per interessare gli studenti e promuovere una discussione scientifica.
Marie Walsh, Limerick Institute of Technology, Irlanda





