L’inchiostro dei monaci: un percorso fra chimica e storia Teach article
Tradotto da Gianluca Farusi Fra i molti ruoli della scienza c’è quello di essere di supporto alle discipline umanistiche. Proprio a questo scopo, Gianluca Farusi ed i suoi studenti hanno deciso di studiare e preparare l’inchiostro ferro-gallico, un materiale alquanto importante, dal punto…
Lo sfondo storico

Molte miniature medioevali di San Giovanni di Pathmos testimoniano quale fosse, all’epoca, l’importanza dell’inchiostro, dal momento che raffigurano il diavolo mentre tenta di rubarlo al Santo. Nel Medioevo venivano usati, di solito, due tipi di inchiostri neri: il nerofumo (una sospensione ottenuta con carbone, acqua e gomma arabica) e l’inchiostro ferro-gallico (ottenuto dalle galle di quercia). Il nerofumo è stato impiegato sin dal 2500 a.C., mentre l’inchiostro ferro-gallico a partire dal terzo secolo e fu utilizzato da personaggi del calibro di Leonardo da Vinci, Johann Sebastian Bach, Rembrandt van Rijn e Vincent van Gogh. Scoperte recenti hanno evidenziato la presenza di tracce di inchiostro ferro-gallico sia nei rotoli del Mar Morto sia nel Vangelo perduto di Giudaw1.
Gli antichi, non sfruttavano la reazione che porta alla formazione del pigmento, per preparare l’inchiostro, ma ne erano comunque a conoscenza. Nella Naturalis Historia, Plinio il Vecchio (23 d.C. – 79 d.C.) scrive come distinguere il verderame [Cu(CH3COO)2.2Cu(OH)2] dalla copparosa (FeSO4.7H2O), con la quale veniva spesso adulterato. Scrive:
“ …La frode può essere scoperta con una foglia di papiro che sia stata posta in un infuso di galle di quercia: a contatto con del verderame adulterato, diventa immediatamente nera …”.
Benchè potesse vedere la trasformazione in gioco, non era in grado di motivarla. Oggi ben si sa che questo antico saggio analitico si basa sulla reazione tra il catione ferroso (ferro (II)) e l’acido gallotannico, reazione che sta alla base della preparazione dell’inchiostro ferro-gallico (vedere sotto).
Il contesto didattico
Fu quando uno dei miei studenti mi chiese quale tipo di inchiostro, utilizzassero, per scrivere, i monaci medioevali, che mi venne l’idea di progettare qualcosa a questo proposito (vedere il riquadro). Oltre ad evidenziare le implicazioni culturali della scienza, il progetto sottolinea lo stretto legame che intercorre tra studi scientifici ed umanistici.
Decidemmo di utlizzare la ricetta riportata dal veneziano Pietro Canepario nel suo De atramentis cuiuscumque generis (Tutti i tipi di inchiostri; 1619). In rima, ed in dialetto, ne riporta la composizione in peso: “Una, due, tre e trenta a far la bona tenta”. Oggi si sa che un tale rapporto fra le masse di gomma arabica, solfato ferroso, galle ed acqua, non è davvero il migliore, perché porta ad un materiale troppo acido, che, con il passare del tempo, fa venire i buchi nella carta. Lo scopo però, non era quello di preparare il migliore degli inchiostri possibili, ma piuttosto quello di incoraggiare gli studenti a studiare storia usando come pretesto la chimica e di capire il ruolo culturale ed educativo che questa scienza riveste.
Il passo successivo è stato quello di fare della ricerca sulle galle, per cui gli studenti si son dati da fare per raccoglierne fra quelle più comuni: di quercia (sia quelle sulle ghiande sia quelle globulari sui rami) e di cipresso, così da poter fare un confronto fra tre tipi differenti di inchiostro,
Il nostro intento era quello di individuare, fra i tre, l’inchiostro migliore, ma secondo quali criteri? Decidemmo di non allontanarci troppo dall’epoca di Canepario e così stabilimmo che i nostri riferimenti fossero il De subtilitate (Le relazioni nascoste) e il De rerum varietate (La varietà) di Gerolamo Cardano (1501-1576). Secondo Cardano, un buon inchiostro fluisce bene, ha spessore ed è nero e brillante. Abbiamo testato gli inchiostri scrivendo sia con delle pipette Pasteur sia con dei pennini e l’inchiostro che, meglio degli altri, ha soddisfatto i precedenti criteri è stato quello ottenuto dalle galle di ghianda. Il mio preferito però, era quello fatto con le galle di cipresso, perché, sebbene meno nero, profumava di resina che era una meraviglia.
Naturalmente abbiamo concluso discutendo tutti gli aspetti chimici in gioco: le reazioni che avvengono in ogni fase della produzione dell’inchiostro, le reazioni fra l’inchiostro e la carta e la loro importanza in relazione ai documenti storici ed alla loro conservazione.
Agli studenti il progetto è molto piaciuto, soprattutto gli aspetti storici ed interdisciplinari. Uno studente ha fatto notare come la chimica “sembri essere la chiave di volta per risolvere quesiti sia moderni sia antichi”
Riquadro: gli ingredienti dell’inchiostro ferro-gallico

Immagine gentilmente
concessa da Gianluca Farusi

quercia
Immagine gentilmente concessa
da Gianluca Farusi

Immagine gentilmente concessa
da Gianluca Farusi
La prima testimonianza certa dell’inchiostro ferro-gallico si trova nel libro di Marziano Minneo Felice Capella De Nuptiis Philologiae et Mercurii et de septem Artibus liberalibus libri novem (Le nozze di Filologia e Mercurio e le sette Arti liberali in nove libri; 420 d.C.) dove viene citata una miscela di galle e gomma arabica. Anche le altre ricette che si sono conservate concordano tutte sugli ingredienti base: galle, solfato ferroso (copparosa), acqua e gomma arabica.
Le galle
Le galle sono delle escrescenze abnormi ed indotte che si trovano sulle foglie, le gemme, i fiori o le radici delle piante. L’agente che ne determina la formazione, spesso un cipinide, deposita un uovo nel tessuto vegetale giovane e la galla cresce tutt’intorno alla larva, che si nutre e sviluppa all’interno di tale escrescenza protettiva. Si pensa che lo sviluppo della galla sia controllato dalle secrezioni della larva: saliva e sostanze escrete.
La composizione chimica delle galle varia in dipendenza sia dell’agente che ne ha indotto la formazione sia del tipo di pianta. La galla di Aleppo è particolarmente ricca di acido tannico (65%) e di acido gallico (2%); la galla di Bassora (conosciuta anche come la galla di Sodoma) contiene il 26% di acido tannico e l’1,6% di acido gallico; mentre la galla di ghianda di quercia contiene il 45-50% di acido tannico. Tutte e tre contengono un’elevata concentrazione di acido gallotannico. In questo progetto abbiamo utilizzato sia galle di quercia, di ghianda e globulari, sia galle di cipresso. (Figure 1,2,3).
Questi tre tipi di galla si possono trovare, facilmente, in tutta Europa, ma si può utilizzare, allo scopo, qualunque cosa contenga tannini: del tè, per esempio. In alternativa si può usare dell’acido tannico.
Il solfato ferroso o copparosa
Nei tempi antichi, la copparosa (FeSO4.7H2O) veniva estratta facendo evaporare l’acqua dai terreni ferrosi. Più tardi, alla fine del sedicesimo secolo, veniva prodotta aggiungendo l’acido solforico ai chiodi di ferro. Noi abbiamo utilizzato il solfato ferroso come tale, una sostanza comune nei laboratori di chimica.
L’acqua
Dal momento che l’acqua di rubinetto può contenere sostanze (quali ad esempio il cloro) che possono alterare la qualità dell’inchiostro, abbiamo utilizzato acqua distillata. Storicamente veniva utilizzata, con ogni probabilità, acqua piovana.
La gomma arabica
La gomma arabica, una gomma naturale estratta dagli alberi di acacia ed utilizzata, in alcuni cibi, come stabilizzante, conserva la qualità dell’inchiostro in tre modi differenti:
Mantiene in sospensione il complesso con il ferro (il pigmento)
Ispessisce l’inchiostro facendo sì che non fluisca troppo velocemente dalla penna
Riduce la velocità con la quale l’inchiostro viene assorbito dalla carta, conferendo un tratto migliore e più duraturo.
Materiali e procedimento
- Galle, 3 parti in peso
- Acqua, 30 parti in peso
- Solfato ferroso, 2 parti in peso
- Gomma Arabica, 1 parte in peso

Immagine gentilmente concessa da Gianluca Farusi

da acqua e galle sminuzzate
Immagine gentilmente concessa da Gianluca Farusi

Immagine gentilmente concessa
da Gianluca Farus

Immagine gentilmente concessa da Gianluca Farusi
- Sminuzzare le galle e macinarle in un macinino da caffè (Figura 4).
- Mettere le galle macinate in un becker ed aggiungere l’acqua. Lasciar fermentare il miscuglio per 3 giorni, a temperatura ambiente, in un angolo soleggiato.
- Filtrare la miscela (Figura 5) ed aggiungere il solfato ferroso alla soluzione. Mescolare bene e lasciar riposare per 3 giorni.
- Aggiungere la gomma arabica, mescolare la miscela, ed ecco l’inchiostro (Figura 6). É giunto il momento di cominciare a scrivere! (Figura 7)!
Gli aspetti chimici in gioco
Anche se, da un punto di vista pratico, le reazioni in gioco sono facili da realizzare, la chimica ad esse sottesa è piuttosto complicata. Questo progetto funziona al meglio, se gli studenti più piccoli, (14-15 anni), si occupano della parte laboratoriale, mentre ai più grandi, (17-18 anni), si lascia il compito di spiegarne gli aspetti chimici e biologici.
Dopo che le galle sono state sminuzzate, le reazioni in gioco possono essere suddivise in due momenti distinti: la fermentazione, con la trasformazione dell’acido gallotannico ad acido gallico, e la successiva formazione del pigmento dell’inchiostro.
La galle contengono grandi quantità di acido gallotannico (Figura 8) ma una quantità relativamente esigua di acido gallico che è la sostanza necessaria a formare l’inchiostro. Durante il processo fermentativo, le galle rilasciano l’enzima tannasi dall’Aspergillus niger e dal Penicillum glaucum, funghi che si trovano nelle galle. Nel giro di 3 giorni, la tannasi catalizza l’idrolisi dell’acido gallotannico ad acido gallico e glucosio. (Figura 9).
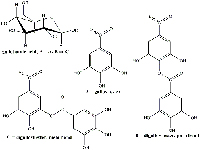
in una molecola di glucosio i cui gruppi
ossidrilici sono esterificati da una
miscela di acidi gallico, digallico
e poligallico. Cliccare sull’immagine
per ingrandirla.
Immagine gentilmente concessa da
Gianluca Farusi
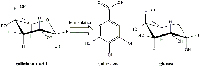
ad acido gallico e glucosio. Cliccare sull’immagine
per ingrandirla.
Immagine gentilmente concessa da Gianluca Farusi
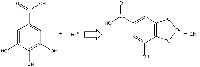
reagiscono per formare gallato ferroso.
Cliccare sull’immagine per ingrandirla.
Immagine gentilmente concessa da Gianluca
Farusi
Il pigmento dell’inchiostro si forma in due tappe consecutive: una reazione acido-base secondo Lewis seguita da una ossidoriduzione.
b) L’acido gallico e il solfato ferroso formano il gallato ferroso (un composto incolore solubile in acqua; Figura 10), H3O+ and SO42-.
d) Pressochè immediatamente, il gallato ferroso reagisce con l’ossigeno per dare acqua e pirogallatoferrico, un complesso ottaedrico nero insolubile in acqua dove i ligandi di ciascun catione ferrico sono due molecole di acido gallico (Figura 11).
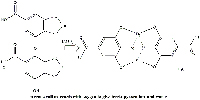
con l’ossigeno per dare pirogallato
ferrico ed acqua. Cliccare sull’immagine
per ingrandirla.
Immagine gentilmente concessa da
Gianluca Farusi
Il pigmento dell’inchiostro è il pirogallato ferrico. A causa della presenza degli ioni H3O+ la soluzione risulta acida.
Danni a lungo termine
L’inchiostro ferro-gallico può anche essere stato usato per 1800 anni, ma non regge bene gli effetti del tempo. Con il passare dei secoli, l’inchiostro sbiadisce, cambia colore e danneggia la carta. Tutto questo è dovuto ad un eccesso di ioni ferrosi: il rapporto 2 a 3 fra solfato ferroso e galle, non è stechiometricamente corretto e ciò comporta un eccesso di solfato ferroso rispetto a quello che sarebbe necessario per reagire con l’acido gallico.
Alcuni di questi cationi ferrosi in eccesso, si ossidano per dare ossido ferrico, che, essendo meno scuro del pirogallato ferrico, fa sbiadire il colore nero originale dell’inchiostro. Altri ioni ferrosi catalizzano una reazione a catena assai dannosa:
Fe2+ + O2 + H+ → Fe3+ + HOO•
Fe3+ + HOO• + H+ → Fe3+ + H2O2
Fe2+ + H2O2 → Fe3+ + HO• + OH– (reazione di Fenton)
RH + HO• → R• + H2O
R• + O2 → ROO•
ROO• + R1H → ROOH + R1•
R1• + …..
dove Fe2+ è un catione ferroso in eccesso, O2 è l’ossigeno atmosferico e R è un radicale di tipo cellulosico.
Inoltre, quando un radicale HO• attacca la cellulosa (RH) della carta, rompe molti legami e compaiono dei buchi. A loro volta, i radicali della cellulosa (R•) reagiscono fra loro, formando un numero maggiore di legami trasversali e la carta risulta così a maglie più strette, meno idrofila e conseguentemente più secca e friabile.
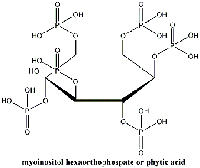
esaortofosfato). Cliccare sull’immagine
per ingrandirla.
Immagine gentilmente concessa da
Gianluca Farusi
La conservazione
Si è pensato che una soluzione a questo problema potesse essere la chelazione: chelando i cationi ferrosi con ligandi appropriati si riduce in modo notevole la loro ossidazione a cationi ferrici, prevenendo così danni ulteriori. Trovare dei chelanti adatti, però, è stata una vera sfida: l’EDTA, per esempio, non diminuisce la velocità con cui lo ione ferroso si ossida.
Studi recenti condotti presso l’Istituto Olandese per il Patrimonio Culturalew2, offrono però, una speranza, in tal senso. Il trattamento della carta con acido fitico (mioinositolo esaortofosfato; Figura 12) un antiossidante naturale che si trova nei semi, porta alla formazione di un complesso fra Fe2+ ed acido fitico (Botti et al., 2005). Ciò comporta l’inibizione della reazione di Fenton, un passaggio fondamentale della reazione a catena prima descritta, e previene ulteriori danni alla carta.
Conclusioni
“Verrà un giorno in cui le ricerche svolte da generazioni di studiosi per molto tempo e con molta dedizione, porteranno alla luce ciò che ora è nascosto; la vita di una sola persona non può essere sufficientemente lunga per terminare una ricerca così ampia … così questi fenomeni diventeranno chiari solo dopo che si saranno succedute generazioni di studiosi…Verrà un giorno in cui i nostri discendenti, si meraviglieranno, di quanto fosse grande la nostra ignoranza, riguardo a cose che a loro sembreranno così ovvie. Molte cose saranno scoperte nei secoli futuri, quando di noi sarà perduto anche il ricordo. Il mondo sarebbe davvero una cosa di scarso valore se ad ogni generazione non si presentasse il compito di affrontare qualche problema da risolvere.…La natura non svela i suoi segreti, in una sola volta”.
Seneca, Quaestiones Naturales, Libro VII
Questo toccante brano di Seneca (4 a.C.- 65 d.C.) è valido ancora oggi. Mi piace immaginare la contentezza di Plinio nel vedere come questa generazione sia capace di dare una spiegazione a cose che lui non era in grado di capire.
References
- Botti L, Mantovani O, Ruggiero D (2005) Calciumphytat zur Behandlung von Tintenfraß: Wirkungen auf das Papier (Calcium phytate, a natural antioxidant to counter paper corrosion caused by iron-gall ink). Restaurator 26: 35-45
Web References
- w1 – National Geographic sito web
- w2 – Netherlands Institute for Cultural Heritage sito web
Resources
- The Ink Corrosion website
Review
Questo articolo descrive un progetto originale di tipo interdisciplinare fra chimica e storia (con possibili riferimenti all’arte, alla scienza forense ed alla biologia). L’idea di riprodurre un inchiostro in modo fedele, dal punto di vista storico, è davvero interessante e si basa su una chimica relativamente semplice.
Il progetto potrebbe costituire il punto di partenza di uno studio che si pone come obiettivo, ad esempio, un confronto fra inchiostri moderni e tradizionali. Il riferimento alla prevenzione della degradazione dell’inchiostro può inoltre far proseguire il progetto in molteplici direzioni. In sintesi si tratta di un articolo davvero interessante con degli utili spunti per una chimica avanzata.
Mark Robertson, Regno Unito





