¿Qué es la Quimioluminiscencia? Understand article
Traducido por Jorge J. Pérez-Maceira. La medusa luminiscente, las luciérnagas, las divertidas barras luminosas; Emma Welsh nos presenta el bello y misterioso mundo de la quimioluminiscencia

Imagen cortesía de Erik
Solheim; origen de la imagen:
Wikimedia Commons
Las luciérnagas, las medusas y las barras – unas vuelan, otras viven en las profundidades del océano y las otras ofrecen entretenimiento en los clubs nocturnos. ¿Cuál es el vínculo? La respuesta son algunas reacciones químicas intrigantes que producen luz.
La Quimioluminiscencia es la producción de luz a partir de una reacción química. Dos compuestos químicos reaccionan para formar un intermediario en estado excitado (alta energía), que se desexcita liberando parte de su energía como fotones de luz (ver glosario para todos los términos en negrita) para alcanzar su estado fundamental (ver Figura 1, abajo).
A + B -> AB* -> Productos + Luz
Intermediario en
estado excitado
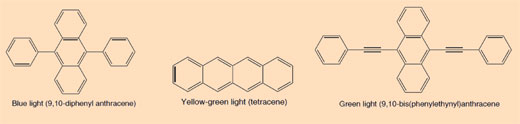
Un átomo de hidrógeno en su estado fundamental. Un electrón se encuentra en órbita n=1. Cada capa tiene su propio nivel de energía.
Cuando el átomo de hidrógeno absorbe un cuanto (cantidad definida) de energía, es promovido a un estado energético superior (órbita n = 2) y ahora está en un estado excitado (alta energía). Esto se indica dibujando un asterisco (*) al lado de la molécula.
El electrón cae a la posición original en el estado fundamental (órbita n = 1). En el proceso, un paquete de energía (un fotón) es liberado en forma de radiación electromagnética. La longitud de onda depende de la cantidad de energía. Si la longitud de onda está dentro del rango de luz visible, la transición de electrones se percibe como la luz de un color particular. La longitud de onda determina el color (ver Figura 2, abajo)
Imagen cortesía de Chemistry Review
Imagen cortesía de NASA
Las reacciones quimioluminiscentes no suelen liberar calor, porque en su lugar la energía se libera en forma de luz. El luminol produce luz cuando reacciona con un agente oxidante, la química de esta reacción se muestra en el Cuadro 1.
Cuadro 1: Luminol, una sustancia que brilla en la oscuridad
La liberación de un fotón de luz de una molécula de luminol es un proceso con varias etapas bastante complejo. En una solución básica (alcalina), el luminol está en equilibrio con su anión, que lleva una carga -2. El anión puede estar en dos formas (o tautómeros), con las dos cargas negativas deslocalizadas en cualquiera de los oxígenos (forma enol) o en los nitrógenos (forma ketol; véase la Figura 3, abajo).
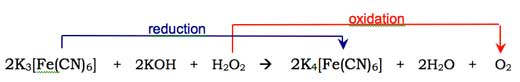
El oxígeno molecular (O2)se combina con la forma enol del anión del luminol, oxidándolo en un peróxido cíclico. El oxígeno necesario se produce en una reacción redox (es decir cuando ocurre una reacción de reducción y oxidación) participando el peróxido de hidrógeno (H2O2), hidróxido potásico y (por ejemplo) hexacianoferrato potásico (III) (K3[Fe(CN)6], también conocido como ferrocianuro potásico). El hexacianoferrato (III) ión ([Fe(CN)6]3->) es reducido a ión hexacianoferrato (II) ([Fe(CN)6]4-, dando ferrocianuro potásico, K4[Fe(CN)6]), mientras que dos átomos de oxígeno del peróxido de hidrógeno se oxidan del estado de oxidación -1 al 0:
El peróxido cíclico se descompone para dar 3-aminoftalato (ácido 3-amino-1,2-benenodicarboxílico) en estado excitado, junto con una molécula de nitrógeno (N2) – ver Figura 3, abajo. Esta reacción de descomposición se ve favorecida porque la molécula de peróxido cíclico es altamente inestable, y la reacción consiste en romper algunos enlaces débiles. También se ve favorecida por el aumento de la entropía (desorden), debido a la liberación de una molécula de gas. Cuando el 3-aminoftalato excitado cae hasta el estado fundamental, un fotón de luz azul es liberado.
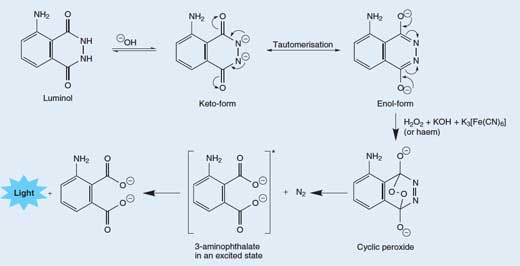
Los tautómeros son moléculas con la misma fórmula química, pero diferentes posiciones de los átomos o de los enlaces. Los dos tautómeros pueden interconvertirse; las flechas curvadas muestran el movimiento de electrones que provoca el cambio entre las dos formas. Haga clic sobre la imagen para ampliarla
Imagen cortesía de Chemistry Review
La quimioluminiscencia en ciencia forense
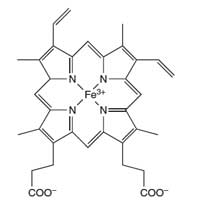
hemoglobina
El átomo de hierro (Fe) en el
centro del anillo porfirina
cataliza la reacción del
lumino
Imagen cortesía de Chemistry
Review
Los científicos forenses utilizan la reacción del luminol para detectar sangre en la escena del crimen. Una mezcla de luminol en una solución diluida de peróxido de hidrógeno se aplica en la zona donde los forenses sospechan que hay sangre. El hierro presente en el grupo hemo de la hemoglobina (ver Figura 4) en la sangre actúa como catalizador de la reacción descrita en el Cuadro 1. La habitación debe estar oscura y si la sangre está presenta, un resplandor azul, con una duración de 30 segundos, se observara. Los investigadores forenses pueden grabar el resplandor mediante el uso de película fotográfica, que puede ser utilizada como prueba en los tribunales de presencia de sangre en la escena. (Para una actividad de enseñanza de la ciencia forense, ver Wallace-Müller, 2011.
Debido a que el hierro actúa como catalizador, sólo se requiere en cantidades mínimos, por lo tanto, sólo una pequeña cantidad de sangre se requiere para producir un resultado positivo. Esto significa que la sangre se puede detectar incluso cuando no es visible a simple vista.

escena de un crimen
Imagen cortesía de How Stuff
Work
Uno de los inconvenientes de la utilización del luminol es que la reacción puede ser catalizada por otras sustancias químicas que pueden estar presentes en la escena del crimen, por ejemplo, el cobre que contienen las aleaciones, algunos productos de limpieza como la lejía, e incluso el rábano picante. Los criminales inteligentes pueden limpiar la sangre con lejía, que destruye la evidencia de sangre, pero la lejía de la alfombra puede alertar a las personas más pronto del crimen. La orina también contiene pequeñas cantidades de sangre, que pueden ser suficientes para catalizar la reacción del luminol. Una vez que el luminol ha sido aplicado a la zona, puede impedir que otras pruebas se realicen allí. Sin embargo, a pesar de estos inconvenientes, el luminol todavía es utilizado por los científicos forenses como una herramienta para resolver el crimen.
En el club nocturno
barra luminosa? Haga clic
sobre la imagen para
ampliarl
Imagen cortesía de Chemistry
Review
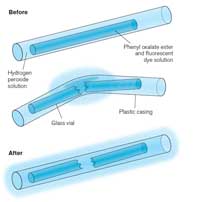
Cuando doblas las barras luminosas y comienzan a brillar, la luz producida es un ejemplo de quimioluminiscencia (ver Figura 5). Las barras luminosas comprenden un tubo de plástico que contiene una mezcla de oxalato de difenilo y un colorante (que da a la barra su color). En el interior del tubo de plástico hay un pequeño tubo de vidrio que contiene peróxido de hidrógeno. Cuando el tubo exterior de plástico es doblado, el tubo de cristal interior se rompe, liberando el peróxido de hidrógeno e iniciando una reacción química que produce luz (ver Cuadro 2). El color de la luz que la barra luminosa produce está determinado por el colorante usado (ver Cuadro 3).
Las reacciones de quimioluminiscencia, como las de estas barras luminosas, dependen de la temperatura. La reacción se acelera a medida que aumenta la temperatura – doble tu barra en el agua caliente produciendo un brillo fantástico, pero que no durará tanto como a temperatura ambiente. Por el contrario, la velocidad de reacción disminuye a bajas temperaturas; es por esto que mantener las barras luminosas en el congelador durante varias horas puede permitir que la barra brille de nuevo cuando se retira y se calienta, mucho después de que hubiera dejado de brillar. La reacción no se detiene por completo en el congelador, pero lo hace tan lento que el brillo es apenas perceptible.
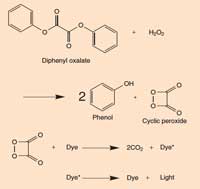
Cuadro 2: Química de las barras luminosas
para ampliarla
Imagen cortesía de Chemistry
Review
Cuando el oxalato de difenilo reacciona con el peróxido de hidrógeno (H2O2), es oxidado para dar fenol y peróxido cíclico, el peróxido reacciona con una molécula de colorante para dar dos moléculas de dióxido de carbono (CO2) y en el proceso, un electrón en la molécula de colorante se promueve a un estado excitado. Cuando el tinte excitado (alta energía) vuelve a su estado fundamental, un fotón de luz de libera. La reacción depende del pH. Cuando la solución es ligeramente alcalina, la reacción produce una luz más brillante.
Nota de seguridad
El fenol es tóxico, por lo que si la barra luminosa tiene escapes, tenga cuidado de no coger el líquido en sus manos, si lo hace, lávelos con agua y jabón inmediatamente. Ver también la nota de seguridad escolar general en Science in School.
Cuadro 3: ¿Qué hace diferentes los colores de las barras luminiscentes?
Los colorantes utilizados en las barras luminiscentes son compuestos aromáticos conjugados (arenos). El grado de conjugación se refleja en el color de la luz emitida cuando un electrón cae desde el estado excitado al estado fundamental.
Barras luminosas vivas

resplandeciendo
Imagen cortesía de Terry Priest;
origen de la imagen: Flickr
¿Alguna vez ha caminado a lo largo de una playa de noche y ha visto destellos de luz alrededor de sus pies? ¿O ha estado en el campo por la noche y ha visto las luciérnagas revoloteando? Estos son ejemplo de bioluminiscencia y alrededor del 90% de la vida de aguas profundas también presentan este extraño fenómeno. Estos organismos han evolucionado para producir luz, porque tiene muchas funciones útiles. Resplandecer puede ser utilizado como un señuelo para atrapar a sus presas, como camuflaje o para atraer a potenciales parejas. Algunas bacterias incluso usan la bioluminiscencia para comunicarse.
El término ‘gusano de luz’ describe a las larvas de varias especies de insectos, incluyendo las luciérnagas, algunos de ellos se iluminan para ahuyentar a sus depredadores, mientras que otras especies usan su brillo para atraer a sus presas. Hay especies de calamares y crustáceos que pueden liberar nubes de líquido bioluminiscente para confundir a los depredadores mientras escapan. Las criaturas que viven en las profundidades del océano se han evolucionado para producir luz azul o verde, ya que transmite bien a través del agua de mar. Esto se debe a que la luz azul tiene una longitud de onda más corta que la luz roja, lo que significa que se absorbe con menos facilidad por las partículas en el agua.
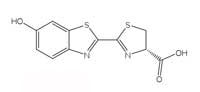
luciferina de la luciérnaga.
Haga clic sobre la imagen
para ampliarla
Imagen cortesía de Chemistry
Review (structure)
Las reacciones bioluminiscentes usan ATP (adenosín trifosfato) como fuente de energía. La estructura de las moléculas que producen luz varía de especie a especia, pero todos ellos genéricamente se denominan luciferinas. La estructura de la luciferina de la luciérnaga se muestra en la Figura 6, a la izquierda. Cuando las luciérnagas brillan, la luciferina se oxida para producir un complejo excitado, que vuelve a caer al estado fundamental, liberando un fotón de luz, al igual que la reacción quimioluminiscente del luminol descrita en el Cuadro 1. Sin embargo, las luciérnagas no utilizan peróxido de hidrógeno ni hexacianoferrato potásico (III) para la oxidación de la luciferina, sino que usan el oxígeno molecular y un enzima llamado luciferasa (esto también es un nombre genérico – las luciferasas varían de una especie a otra).

por primera vez en la medusa
Aequorea victoria
Imagen cortesía de Typoform /
the Royal Swedish Academy of
Sciences (RSAS)
Luciferasa
Luciferina + O2 → Oxiluciferina + Luz
Ha habido una serie de experimentos que investigan aecuorina, una proteína encontrada en ciertas medusas, que produce luz azul en presencia de calcio (ver Shaw, 2002, y Furtado, 2009) y por lo tanto puede ser utilizada en biología molecular para medir los niveles de calcio de las células. Algunos científicos han propuesto otras ideas para la utilización de la bioluminiscencia en el futuro, por ejemplo, el árbol de navidad con luz propia. ¿Puedes pensar en cualquier interesante uso potencial de este fenómeno natural?
Glosario
Anión: un átomo (o grupo de átomos) que lleva una carga negativa.
para ampliarla
Imagen cortesía de Chemistry
Review
ATP: adenosín trifosfato presente en todas las formas de vida conocidas. Es la moneda de energía primaria en las células. El ATP se forma a partir del ADP (adenosín difosfato) y fosfato durante reacción donadoras de energía (por ejemplo, la oxidación de la glucosa), y se rompe (a ADP y fosfato) para liberar esta energía con el fin de impulsar reacciones desfavorables.
Bioluminiscencia: La producción de luz por organismos vivos. La bioluminiscencia puede ser consecuencia de la absorción de luz (fluorescencia o fosforescencia, por ejemplo, en muchos peces de aguas profundas) o de una reacción química (quimioluminiscencia, por ejemplo, en luciérnagas).Catalizador: Sustancia que hace que una reacción ocurra más rápido, pero que no experimenta un cambio químico permanente durante la reacción (es decir, no se utiliza en la reacción). Los catalizadores trabajan al proporcionar una ruta alternativa para que la reacción necesite menos energía.
Catalizador: Sustancia que hace que una reacción ocurra más rápido, pero que no experimenta un cambio químico permanente durante la reacción (es decir, no se utiliza en la reacción). Los catalizadores trabajan al proporcionar una ruta alternativa para que la reacción necesite menos energía.
Quimioluminiscencia: Es un tipo de luminiscencia en la cual los electrones son excitados por una reacción química, por ejemplo, la reacción del luminol que se describe en el Cuadro 1.
Conjugados: Los sistemas conjugados surgen principalmente en la química donde hay enlaces dobles cerca de otros. Los átomos en un sistema conjugado se mantienen unidos por enlaces covalentes y se alternan enlaces simples y múltiples (principalmente enlaces dobles, pero los triples enlaces también son capaces de estar en una conjugación). Los alquenos son planos, los sistemas conjugados deben ser siempre planos para permitir la deslocalización de los electrones en todo el sistema. Las moléculas del colorante en el Cuadro 3 son ejemplos de compuestos conjugados.
Enlaces covalentes: Enlaces entre dos átomos donde se comparten un par de electrones entre ellos.

están deslocalizados en un
sistema conjugado
Imagen cortesía de Chemistry
Review
Deslocalización: Cuando las moléculas tienen enlaces conjugados, los electrones son libres de moverse a lo largo de todo el sistema conjugados. Estos se conocen como electrones deslocalizados. Los electrones en un anillo benceno están deslocalizados, y es por eso que todos los enlaces carbono-carbono tienen la misma longitud.
Fluorescencia: Un tipo de luminiscencia en la cual los electrones son excitados por la luz, por ejemplo, en las marcas de seguridad de los billetes de banco.
Luminiscencia: La producción de luz, por lo general a bajas temperaturas, por ejemplo, por reacciones químicas o de energía eléctrica. La incandescencia, al contrario, es la luz generada por altas temperaturas.
Fosforescencia: Como la fluorescencia, pero el brillo dura más tiempo (de acuerdo con algunas definiciones, más de 10 nanosegundos), por ejemplo, las pegatinas que brillan en la oscuridad.
Agradecimientos
La versión original de este artículo fue publicada en Chemistry Review y es reproducida con el permiso del editor, Philip Allan. Para suscribirse a Chemistry Review, una revista dirigida a los estudiantes de química de la escuela de 16-19 años, visite: www.philipallan.co.uk/chemistryreview
References
- Furtado S (2009) Painting life green: GFP. Science in School 12: 19-23.
- Shaw A (2002) Genetic chess by the light of a jellyfish. Chemistry Review 12(1): 2-5
- Wallace-Müller K (2011) The DNA detective game. Science in School 19: 30-35.
Resources
- Para algunos experimentos con luminol, véase el sitio web de Declan Fleming para los estudiantes mayores, sobre todo la quimioluminiscencia del luminol: www.chm.bris.ac.uk/webprojects2002/fleming/experimental.htm
- Para obtener información sobre otros tipos de luz en la química consulte:
- Douglas P, Garley M (2010) Chemistry and light. Science in School 14: 63-68.
Review
Este artículo ofrece una manera de motivar a los estudiantes a comprender las reacciones químicas. Incluso si no están interesados en saber por qué una barra luminiscencia brilla en la oscuridad, seguramente estarán ansiosos de averiguar cómo las luciérnagas o medusas producen luz, o para descubrir cómo se detecta sangre en la escena del crimen. El artículo puede servir ya sea como una introducción a las reacciones químicas o como ejemplos atractivos de las reacciones redox o también para ilustrar los niveles de energía de las capas de un átomo.
El artículo se puede adaptar para diferentes rangos de edad y de distintas materias y temas. Para los estudiantes de 14-15 años, podría ser utilizado para enseñar química (estructura atómica y el movimiento de los electrones entre capas, introducción a las reacciones químicas) o biología (bioluminiscencia). Para este grupo de edad, el profesor necesidad de simplificar la información contenida en el artículo y omitir los detalles de las reacciones. Para los estudiantes de entre 16-18 años, el artículo podría ser utilizada para enseñar química (reacciones redox, catalizadores, la influencia de la temperatura sobre la velocidad de reacción, el efecto del pH en la reacción, y los enlaces covalentes), física (el espectro electromagnético y los fotones) o genética (ingeniería genética). Preguntas adecuadas de compresión incluidas:
- ¿Qué es la quimioluminiscencia?
- ¿Para qué usan los científicos forenses la quimioluminiscencia?
- Explicar algunas funciones biológicas de la bioluminiscencia.
- ¿Por qué debemos mantener la barra luminiscente en el congelador cuando no la estamos usando?
- ¿Cómo puedes hacer un árbol de Navidad con luz propia?
Ana Gil, España