Gastronomia molecolare durante una lezione di chimica Teach article
Tradotto da Francesca Nuzzo. Le sfere di alginato sono tanto utili nelle lezioni di chimica quanto nella gastronomia molecolare.
La gastronomia molecolare è una nuova tendenza dell’alta cucina, con cuochi che offrono ai loro clienti nuove e particolari esperienze culinarie, usando azoto liquido, gel e schiume. Una delle tecniche più note è l’uso di sfere di alginato contenenti svariati succhi di frutta o spezie. Nonostante non frequentiate ristoranti stellati, potreste esservi imbattuti in tali sfere, nel bubble tea.
Il bubble tea, inventato a Taiwan negli anni ‘80 e diffusosi dall’Asia Orientale ai Paesi Occidentali, è una bevanda a base di tè contenente anche gelatine di frutta, sfere di tapioca o alginato, riempite di succo di frutta o sciroppo.
Osservare il comportamento delle sfere di alginato può essere affascinante e può essere usato per lo studio applicato delle scienze.
In questo articolo, mostriamo come le sfere di alginato possono essere sfruttate per insegnare in modo accattivante vari concetti scientifici. Abbiamo dimostrato come creare delle sfere di alginato e descritto tre esperimenti tipo, ognuno dei quali può essere svolto in un’ora: una reazione acido-base, la chemiluminescenza con reazioni di ossidoriduzione e la convenzione termica con effetto termo cromatico.
Creare le sfere di alginato
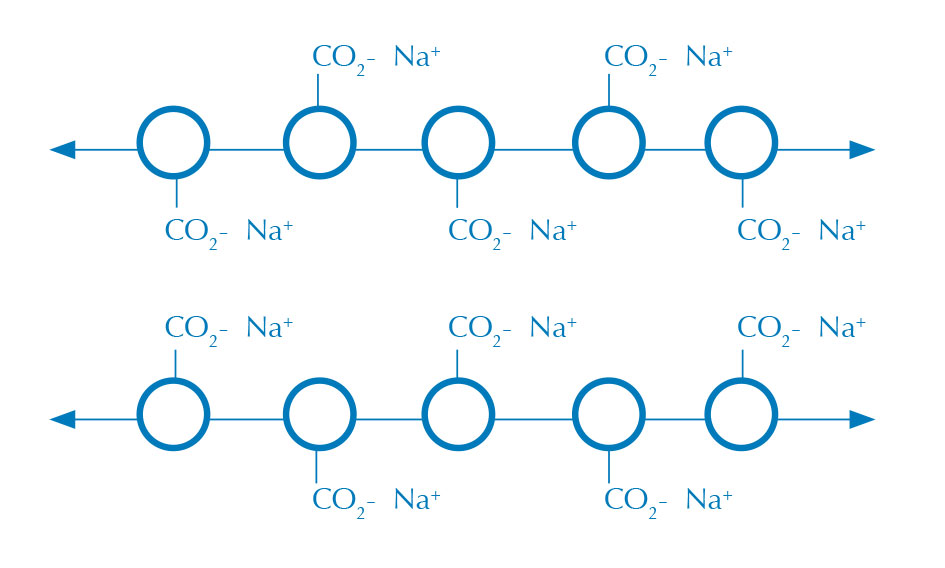
in soluzione di cloruro di
sodio (nessuna
polimerizzazione)
Immagine per gentile
concessione di Nicola Graf
Le sfere di alginato si creano quando una soluzione acquosa di alginato (figura 1) entra in contatto con una soluzione contenente ioni calcio, formando una pellicola di alginato di calcio (figura 2). L’alginato è un lungo polisaccaride che, in presenza di ioni bivalenti, come il calcio, polimerizza, creando un gel insolubile in acqua.
Occorrente
- 2 g di alginato di sodio (Na(C6H806))
- 100 ml di acqua distillata
- 10 ml di una soluzione 0,5% di cloruro di calcio (CaCl2) o 1% di lattato di calcio (Ca(C3H5O3)2
- Due contenitori da 250 ml
- Pipetta o cucchiaio
- Un bastoncino di vetro o un altro agitatore
- Setaccio o cucchiaio
Procedimento
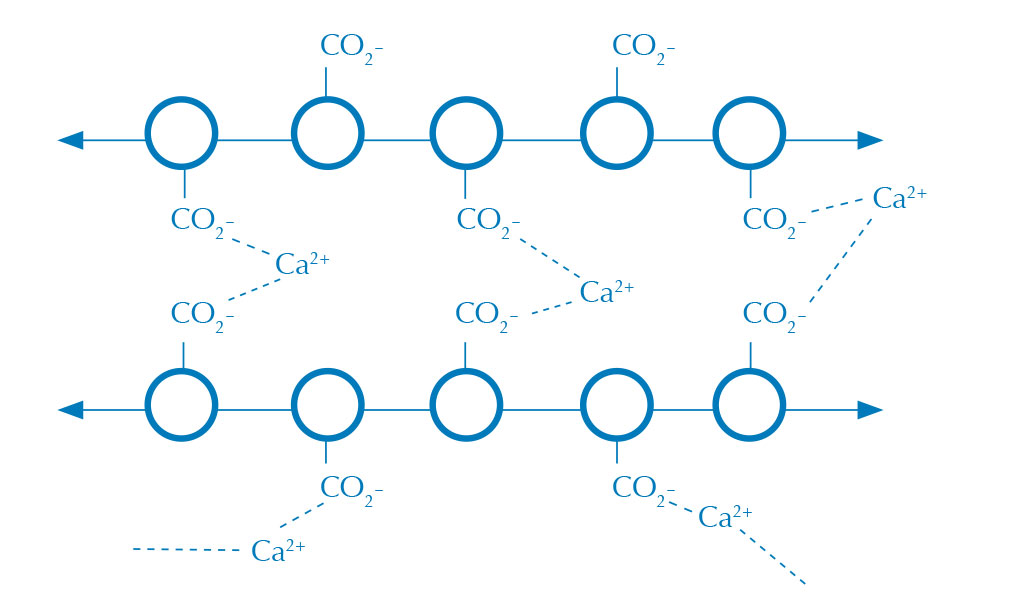
in CaCl2 (polimerizzazione)
Immagine gentilmente
concessa da Nicola Graf
- Mescolare alginato ed acqua in uno dei due contenitori.
- Aspettare almeno 15 minuti fino a quando tutto l’alginato è disciolto.
- Versare la soluzione di ioni calcio nell’altro contenitore.
- Aggiungere con una pipetta o un cucchiaio, goccia a goccia, la soluzione di alginato alla soluzione di ioni calcio. Agitare la soluzione di calcio onde evitare che le sfere di alginato si aggreghino insieme.
- Le sfere sono stabili e possono essere rimosse dalla soluzione di ioni calcio con un cucchiaio o setaccio.
Quando i liquidi entrano in contatto, si forma alginato di calcio gelatinoso, in cui la soluzione di alginato é racchiusa all’interno di sfere. Se altri composti sono aggiunti alla soluzione di alginato, come spezie, coloranti o indicatori, vengono anch’essi incapsulati.
Sfere Acido-base
Occorrente
- 2 g di alginato di sodio
- 500 ml di acqua distillata
- 10 ml di soluzione 0,5% cloruro di sodio o 0,1% lattato di calcio.
- Tre contenitori da 250ml
- Pipetta o cucchiaio
- Bacchetta di vetro o altro agitatore
- Setaccio (opzionale)
- Indicatore di pH
- Acidi e basi assortiti
Procedimento
- Seguire le procedure precedenti per formare le sfere di alginato ma, addizionare, alla soluzione, un indicatore acido-base, appena prima dell’aggiunta di alginato alla soluzione di calcio.
- Rimuovere le sfere ed immergerle in un contenitore contenente la rimanente acqua distillata.
- Notare il colore delle sfere.
- Aggiungere, sistematicamente, nell’acqua, diversi acidi e basi e notare il cambiamento di colore delle sfere.
Sebbene l’indicatore sia all’interno delle sfere, la membrana di alginato può scambiare l’idrossido o lo ione idronio (protoni idratati) tra il contenuto delle sfere e il liquido circostante. Cambiando il valore del pH della soluzione circostante, mediante aggiunta di un acido o di una base, cambierà anche il pH del liquido all’interno delle sfere, e di conseguenza muterà il colore dell’indicatore.
Così come gli indicatori possono essere usati in aula, gli estratti di cavolo rosso o ravanello, sensibili al pH, potrebbero essere usati in casa.
Sfere luminescenti
Le sfere di alginato possono essere usate per spiegare il fenomeno della luminescenza, semplicemente aggiungendo un composto luminescente alla soluzione di alginato prima che si formino le sfere. Un modo facile per ottenere ciò, è usare la riboflavina (vitamina B2) che fluoresce negli UV. Nonostante si possa usare la riboflavina pura, si può anche estrarla dal cibo, come dalla crema istantanea in polvere, che la contiene.
Occorente
Estrarre la riboflavina (opzionale):
- Una confezione di crema pasticcera istantanea in polvere contenente riboflavina (anche detta E101)
- 200 ml di acqua distillata
- Contenitore
- Agitatore
- Imbuto con filtro
Creare delle sfere luminiscenti:
- Due cucchiaini di riboflavina in polvere (C17H20NaO6)
- 2 g di sodio alginato
- 100 ml acqua
- 10 ml di soluzione 0,5% cloruro di calcio o 1% di lattato di calcio
- Due contenitori da 250 ml
- Pipetta o cucchiaio
- Bastoncino in vetro o altro agitatore
- Setaccio (opzionale)
- Fonti luce UV
- 15-20 ml di soluzione satura di ditionito di sodio (Na2S2O4)
- 15-20 ml di perossido di idrogeno
Procedimento
- Per estrarre la riboflavina dal preparato per crema pasticcera, versare circa 8 g di polvere in 200 ml di acqua. Agitate bene per circa 10minuti e filtrare.
- Seguire la procedura per creare le sfere di alginato, ma aggiungere la riboflavina alla soluzione di alginato, appena prima della sferificazione
- Le sfere formate, illuminate con luce UV, dovrebbero fluorescere ed emettere una luce giallo-verde.
- Spegnendo gli UV, le sfere non fluoresceranno
- Riaccendere la luce.
- Aggiungere il ditionito di sodio nel contenitore in cui sono presenti le sfere di alginato. Dovreste notare che non c’è alcuna luminescenza, in quanto il ditionito di sodio, attraversando la membrana delle sfere d’alginato, ha ridotto la riboflavina al loro interno.
- Aggiungere il perossido di idrogeno alla riboflavina ossidata, ristabilendo nuovamente la luminescenza.
Sfere termiche
Aggiungere, alla soluzione di alginato, un inchiostro termocromatico può aiutare a spiegare il fenomeno della convenzione. In Giappone, uno speciale inchiostro termico, un lattone del cristal violetto (da non confondere con gli inchiostri termici delle stampanti termiche), è usato in fisica per descrivere fenomeni legati al calore.
Occorrente
- 2 g di sodio alginato
- 100 ml di acqua distillata
- 10 ml di una soluzione 0.5% cloruro di calcio o 1% lattato di calcio
- 2 contenitori da 250ml
- Pipetta o cucchiaio
- Bastoncino in vetro o altro agitatore
- Setaccio (opzionale)
- 3-5 ml di inchiostro termo cromatico
- Contenitore resistente al calore e riempito d’acqua
- Fonte di calore
Procedimento
- Creare le sfere come descritto in precedenza, ma aggiungere l’inchiostro alla soluzione di alginato, prima della sferificazione.
- Inserire le sfere in un contenitore resistente al calore e riempito d’acqua.
- Scaldare il contenitore fino a quando le sfere iniziano a salire.
Le sfere di alginato si muoveranno mostrando la convenzione: saliranno, in quanto meno dense, quando scaldate, e affonderanno, perché nuovamente più dense, quando raffreddate. Contemporaneamente, le sfere di alginato cambieranno colore, dimostrando come la convenzione è associata a cambi di temperatura.
Ringraziamenti
Parte di questo lavoro è stata sovvenzionata dal progetto Teaching Enquiry with Mysteries Incorporated (TEMI) (Peleg et al., 2015), supportato dall’Unione Europea all’ interno del 7th Framework Programme for Research Funding “Science in Society”, Grant Agreement No. 321403.
References
- Peleg R et al. (2015) Il mistero della sabbia magica. Science in School 32: 37-40.
Resources
- Per saperne di più sulla gastronomia molecolare, consultare:
- Davies E (2014) Dal metionale al pollo fritto. Science in School 30: 44–48.
- Per saperne di più sulla sferificazione nella gastronomia molecolare, vedere: www.molecularrecipes.com/spherification-class/basic-spherification
- Un video che mostra come ottenere una “goccia” d’acqua commestibile da alginato è disponibile su: www.youtube.com/watch?v=YLjzsfgk198
- I video di tutti gli esperimenti qui descritti possono essere trovati sul canale di Youtube TEMI. Guardare: www.youtube.com/channel/UC62-j3UpwF-Z5yh84umnxIQ
- Per un podcast sul sodio alginato, consultare il sito web Chemistry World.
- Una descrizione in tedesco dell’utilità delle sfere per un apprendimento pratico, secondo la filosofia TEMI, può essere scaricata dal sito web del gruppo TEMI, presso l’Università di Bremen, in Germania. Consultare: www.chemiedidaktik.uni-bremen.de/temi/index.html. Una traduzione in inglese sarà presto pubblicata nel Book of Science Mysteries, sul sito web TEMI: www.teachingmysteries.eu
- La sferificazione può essere usata in molti altri esperimenti. Per un’ attività in cui le sfere di alga sono usate per scoprire la fotosintesi, ad esempio, vedi: www.saps.org.uk o usare il link diretto: http://tinyurl.com/qxwcafa
- La maggior parte dei reagenti chimici e delle attrezzature richieste per tali esperimenti sono facilmente reperibili presso i comuni fornitori di istituti scientifici. Se non trovate un fornitore per l’inchiostro termocromatico giapponese, dovreste riuscire ad acquistare un impasto termo cromatico per uso acquoso da aziende specializzate come SpecialFX & Coatings in the UK. Vedere: www.sfxc.co.uk
Review
La nostra curiosità è sempre stimolata da cambiamenti di colore, posizione, forma e luce. Usare questi cambiamenti durante le nostre lezioni, può aiutare i nostri studenti ad apprezzare di più la scienza. Il primo e secondo esperimento sarebbero adatti a studenti di 15-16 anni, mentre la terza attività, riguardo i fenomeni di convenzione e luminescenza, sarebbe adatta anche a studenti più giovani, 11-14 anni.
Dopo le attività, l’insegnante potrebbe chiedere perché le sfere sono usate, aprendo una discussione sulle proprietà chimico-fisiche coinvolte.
Enrico Capaccio, Istituto Superiore S. Bellarmino, Montepulciano (Siena), Italia





