El Titanic y la bacteria que se alimenta de hierro Understand article
Una especie de bacteria que se ha descubierto en los restos en descomposición del Titanic brinda nuevos conocimientos sobre cómo proteger la integridad de las células vivas.
Los restos del Titanic se encuentran en el fondo oceánico, a casi 4 km por debajo de la superficie de las oscuras aguas saladas del Atlántico Norte. Los buzos que realizan expediciones a la zona han observado «carámbanos de óxido» (formaciones que parecen carámbanos, ricos en óxido) que cubren partes del dañado y corroído casco. En 2010, los científicos que investigan los carámbanos de óxido provenientes de la zona del Titanic descubrieron una nueva especie de bacteria en estas formacionesw1. La llamaron Halomonas titanicae.

Wikimedia Commons (dominio público)
Los científicos también han descubierto que la bacteria Halomonas titanicae está involucrada en el proceso de oxidación y acelera la descomposición de los restos del Titanic. La descomposición ocurre a un ritmo bastante rápido: las estimaciones sugieren que los restos podrían desaparecer por completo para el año 2030. Por lo tanto, estas bacterias constituyen una amenaza significativa para las plataformas petrolíferas y otras estructuras de hierro ubicadas en las profundidades marinas. Sin embargo, estos organismos ahora se han convertido en el objeto de la investigación científica por otro motivo: para averiguar cómo logran prosperar en condiciones con concentraciones altas y variables de salinidad.
La célula viva y las sales
El prefijo halo- significa «sal» en griego. Las bacterias del género Halomonas viven en un entorno salado, como el agua marina o los pantanos de sal, donde las concentraciones de sal varían ampliamente. Todos los miembros de ese género son «tolerantes al halo»: han desarrollado maneras de tolerar concentraciones variables de sal fuera de la célula y sobreviven en salinidades que varían entre el 0,5 % (w/w) de cloruro de sodio y el 25 %. Esto puede parecer insignificante, pero no lo es.

Imagen cortesía de Lori Johnston, Expedición al RMS Titanic 2003, NOAA-OE
Las células están protegidas del mundo exterior por membranas muy delgadas que controlan el transporte dentro y fuera de la célula, lo que origina y mantiene diferencias significativas en su composición entre el interior y el exterior de la célula. Por ejemplo, las células mantienen un potencial eléctrico de alrededor de 100 milivoltios en toda la membrana, que usualmente tiene solo 10 nanómetros de espesor. Para todos los tipos de célula, el cloruro de sodio (NaCl) es la sal predominante fuera de la célula (por ejemplo, en el suero sanguíneo), mientras que el cloruro de potasio (KCl) predomina en el interior. Aún así, aunque los tipos de sales son diferentes, la concentración total de sal a cada lado de la membrana debería coincidir con exactitud. Se debe a la ósmosis: si dos soluciones con concentraciones diferentes están separadas por una membrana que es permeable al agua pero no a los solutos, el agua fluirá del lado más diluido al más concentrado.
Las membranas de la célula no pueden tolerar las diferencias de presión osmótica. Las células de los glóbulos rojos explotan cuando se las coloca en agua pura, lo que demuestra el efecto de la presión osmótica y la fragilidad de las membranas celulares. Está claro que para mantener las membranas intactas, las bacterias Halomonas deben poder regular la concentración de solutos en el citoplasma en respuesta a la variabilidad de la concentración de sal en el exterior, sin alterar la bioquímica dentro de la célula (véase Zaccai 2009). ¿Cómo lo hacen?
Las bacterias Halomonas producen grandes cantidades de una sustancia llamada ectoína (véase la figura 1). Para contrarrestar la concentración de sal en el exterior, ajustan la concentración de este compuesto soluble dentro de sus células. Esto mantiene a los fluidos de la célula en equilibrio osmótico con el exterior, lo que protege la célula para que no se desgaste e incluso explote en condiciones extremas. La ectoína parece actuar de manera diferente de la mayoría de las sales y los solutos, lo que puede interferir con la función del agua en los procesos metabólicos. La ectoína es un «soluto compatible» y preserva la bioquímica normal dentro de la célula. También aumenta la estabilidad de las proteínas y las membranas. Entonces, ¿cómo este soluto inusual logra estos resultados?
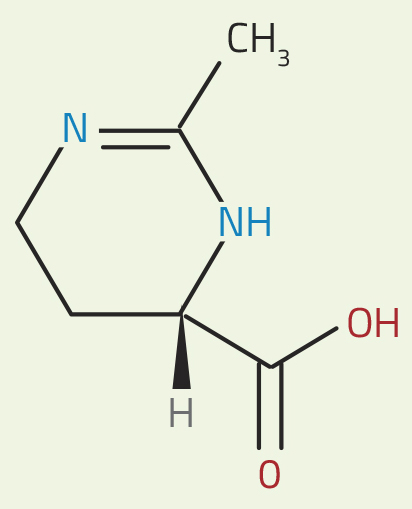
química de la ectoína. En
agua, el grupo rojo adquiere
una carga negativa (al perder
un ion H+) y el grupo azul
adquiere una carga positiva
(al ganar un ion H+). Luego,
los grupos cargados forman
enlaces de hidrógeno con
moléculas de agua
adyacentes.
Nicola Graf
La ectoína y la red de enlaces de hidrógeno
Recientemente se han descubierto pistas sobre cómo funciona exactamente la ectoína a nivel molecular mediante la avanzada técnica experimental de dispersión de neutrones (véase el cuadro de texto). Los experimentos, que llevó a cabo un grupo de colaboración internacionalw2 del Instituto Laue-Langevin (ILL)w3, demostraron cómo la ectoína influye en la capa de agua alrededor de las moléculas de proteínas y en las superficies de la membrana (Zaccai et al., 2016). Normalmente, las moléculas de agua interactúan entre sí a través de una red de enlaces de hidrógeno. Los átomos de una molécula de agua interactúan con las moléculas vecinas; cada átomo de oxígeno actúa como receptor de dos enlaces de hidrógeno y cada átomo de hidrógeno como donante de un enlace. Esto da como resultado una red altamente dinámica de enlaces intramoleculares, en la que las moléculas cambian de contraparte mil millones (109) de veces por segundo.
La atracción entre las moléculas de agua también es la base del «efecto hidrofóbico» que separa al aceite del agua. El efecto hidrofóbico es importante en muchos procesos biológicos, como el plegamiento tridimensional de moléculas de proteínas y la formación de membranas. Por lo tanto, la dinámica de los enlaces de hidrógeno es un factor esencial en la organización de las células vivas.
Otras sustancias en el agua, como las sales, pueden interferir con esta organización. Pero, como los experimentos de neutrones han revelado, la ectoína parece mejorar la dinámica de los enlaces de hidrógeno, al menos en parte, en lugar de obstaculizarla. Esta molécula contiene un grupo cargado positivamente (en azul en la figura 1) y un grupo cargado negativamente (en rojo). Estos grupos cargados interactúan con las moléculas de agua, lo que hace que la red de enlaces de hidrógeno sea un poco menos dinámica, pero también crea más lejos una red más dinámica de moléculas de agua.
Fuera del contexto bacteriano, la ectoína ha demostrado ser un ingrediente útil en cosméticos y tratamientos clínicos, ya que puede reducir la inflamación en células de mamíferos. Probablemente se deba a que al estabilizar las proteínas y las membranas, la ectoína protege las células humanas del daño, lo que reduce la inflamación y proporciona remedios para afecciones como las alergias, los eccemas y los síntomas de la tos y el resfriado.
De regreso al Titanic
Aunque los experimentos de neutrones han ayudado a los científicos a entender cómo prosperan las bacterias Halomonas en el entorno potencialmente hostil de los alrededores del Titanic hundido, el papel exacto de la Halomonas titanicae en la formación del óxido no está claro. Pero hay buenas noticias: estas bacterias que se alimentan de hierro podrían jugar un papel en el manejo futuro de los desechos, al acelerar la descomposición de los desechos metálicos (además de los restos históricos) en el fondo oceánico.
La dispersión de neutrones
La dispersión de neutrones es un método poderoso para estudiar la estructura de los materiales, incluida el agua y sus interacciones con otros compuestos.
El núcleo de un átomo de hidrógeno es un solo protón. Los neutrones y los protones son partículas muy similares (excepto por su carga eléctrica), y los neutrones originan la dispersión fuerte de los protones, como si fueran bolas de billar que chocan. El patrón de dispersión de neutrones proporciona información sobre la ubicación de los átomos de oxígeno e hidrógeno en las moléculas de agua cercanas y en la red dinámica de enlaces de hidrógeno que las une.
También hay otro truco útil en la dispersión de neutrones. Los núcleos de los átomos de deuterio (un isótopo del hidrógeno con un protón y un neutrón en su núcleo) dispersan los neutrones de una manera muy diferente a los núcleos de hidrógeno normales. Reemplazar el hidrógeno de un compuesto específico (por ejemplo la ectoína) por deuterio permite ver la contribución propia de este compuesto a la señal de dispersión, aislado de la de las moléculas de agua circundantes. Esto, a su vez, ayuda a revelar los detalles de la interacción.
La dispersión de neutrones con deuterio ha proporcionado resultados provechosos sobre la biología estructural. Estos incluyen información sobre las interacciones complejas entre unas moléculas de proteínas con otras y entre las proteínas y los ácidos nucleicos (ADN, ARN).

©ILL/L. Thion
References
- Zaccai G (2009) The intracellular environment: not so muddy waters. Science in School 13: 19-23.
- Zaccai G et al. (2016) Neutrons describe ectoine effects on water H-bonding and hydration around a soluble protein and a cell membrane. Scientific Reports 6: 31434. doi:10.1038/srep31434
Web References
- w1 – Los científicos de universidades en Sevilla (España) y Toronto y Halifax (Canadá) descubrieron las bacterias Halomonas titanicae. Puede leer un informe científico del descubrimiento en el sitio web de la UNESCO.
- w2 – Las organizaciones colaboradoras incluyen el Instituto Laue-Langevin, el Instituto de Biología Estructural en Grenoble (Francia), el Instituto de Bioquímica Max Planck y la empresa de biotecnología Bitop en Múnich (Alemania). Para más información, puede consultar Zaccai et al. (2016) fen la sección Referencias.
- w3 – The Institut Laue-Langevin (ILL) es un centro de investigación internacional a la vanguardia de la ciencia y la tecnología de neutrones con sede en Grenoble (Francia).
Resources
- Puede obtener más información sobre los microbios que viven en los buques naufragados y sobre el papel de la ectoína en un artículo accesible del BBC website.
Institutions
Review
El naufragio del Titanic es muy conocido, por lo que este artículo se puede utilizar para entusiasmar a los estudiantes sobre la ciencia. También puede actuar como incentivo para adentrarse en el mundo de las bacterias y su utilidad para los seres humanos, a pesar de las asociaciones negativas que comúnmente conllevan.
El artículo puede ser útil para enseñar biología y explorar cómo los organismos procarióticos pueden sobrevivir en ambientes extremos y cómo se transfieren las sustancias a través de la membrana celular. También podría usarse en la enseñanza de química sobre enlaces de hidrógeno y las interacciones entre el agua y otras moléculas. Finalmente, usar Halomonas titanicae para reciclar es importante para la ecología y el estudio del equilibrio energético dentro de los ecosistemas.
Alina Giantsiou-Kyriakou, docente de biología, Escuela de educación secundaria Livadia, Chipre.





