Neutrones y anticongelante: investigando los peces del Ártico Understand article
Traducido por José L. Cebollada. Matthew Blakeley del ILL y sus colegas del ESRF entre otros, han descubierto el anticongelante de la sangre de los peces del Ártico y que permite que sigan con vida a temperaturas por debajo de 0ºC Eleanor Hayes y él lo explican.

(Myoxocephalus scorpius)
también posee proteínas
anticongelantes.
Imagen de dominio público;
procedencia de la imagen:
Wikimedia Commons
Cuando pensamos en el Ártico muchos pensamos en icebergs, osos polares y focas. Gélidas temperaturas, vientos heladores y desoladoras llanuras congeladas; un desafío para cualquier animal que viva allí.

del Ártico han forzado a los
animales a evolucionar y
desarrollar algunas
adaptaciones notables
Imagen cortesía de ucumari;
Origen de la imagen: Flickr
Muchos de los métodos que usan los animales del Ártico para adaptarse a ese ambiente nos resultan familiares: la gruesa piel del oso polar, la capa de grasa de las focas, los hábitos migratorios de muchos pájaros. Pero estos son animales homeotermos -mantienen constante la temperatura de su cuerpo, muy por encima de la de su helador entorno.
Para los peces la situación es muy diferente: son ectotermos, lo que significa que su cuerpo está a la temperatura del ambiente. Y el ambiente es realmente frío: con mucha frecuencia la temperatura alcanza valores tan bajos como -1ºC; el agua no se congela por su elevado contenido en sal.
La sangre de los peces es bastante menos salada y se debería congelar a -0.5ºC. Para evitarlo los peces del Ártíco han evolucionado y sintetizan unas proteínas especiales anticongelantes (AFP, antifreeze proteins).

Willaert; procedencia de la
imagen: Flickr
Las AFP tienen una tarea complicada. Para evitar que el pez se muera congelado tienen que unirse a los núcleos de cristalización del hielo que se forman en el cuerpo de los peces para evitar que crezcan cristales de hielo. Pero, ¿cómo diferencia la AFP el agua líquida del cristal de hielo?
Las AFP se han estudiado utilizando diversas técnicas, entre ellas la difracción de rayos X, que han revelado la existencia de una superficie especializada en rodear al hielo.
La difracción de rayos X se basa en la dispersión (difracción) producida por la nube electrónica de cada átomo. Las moléculas suelen tener diferentes patrones de difracción. Sin embargo los átomos de hidrógeno (y deuterio) que tienen sólo un electrón, dispersan los rayos X muy poco (ver figura 1a, debajo) y la señal de difracción de rayos X para el agua (H2O) es prácticamente la misma que la de los átomos de oxígeno. Así, cuando los científicos intentaban examinar cómo interaccionaba la superficie que rodeaba al hielo con el propio hielo no podían identificar todas las moléculas de agua de la superficie.
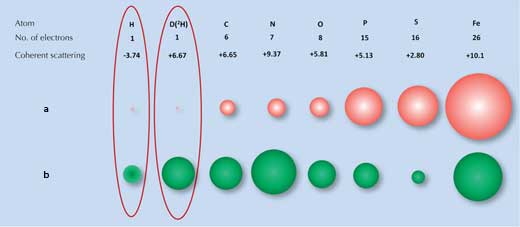
a) Los electrones dispersan a los rayos X y el alcance de la dispersión (tamaño de los círculos rojos) es proporcional al número de electrones.
b) Los núcleos dispersan la los neutrones y el alcance de la dispersión (tamaño de los círculos verdes) dependen de determinadas fuerzas nucleares diferentes en cada núcleo.
Imagen cortesía de Matthew Blakeley

las proteínas anticongelantes
del abadejo, Zoarces
americanus
Imagen cortesía de Derek
Keats; procedencia de la
imagen: Flickr
Aquí es donde otra técnica puede ayudar, la difracción de neutrones. Ahora es el núcleo atómico y no los electrones quien dispersa a los neutrones y la intensidad de la dispersión depende de determinadas fuerzas nucleares. Estas fuerzas, en cambio son diferentes no sólo para cada elemento sino también para los isótopos de un mismo elemento, que difieren en el número de neutrones del núcleo (Figura 1b, arriba). Por suerte, los átomos de hidrógeno pueden detectarse fácilmente mediante difracción de neutrones y el deuterio (isótopo más pesado del hidrógeno que tiene un neutrón más) puede detectarse con mayor fiabilidad. Por este motivo la señal del agua es bastante diferente de la del átomo de oxígeno.
Nosotros, (Matthew Blakeley y sus colaboradores) decidimos investigar un tipo de AFP encontrada en la sangre de peces del Ártico: la APF de tipo III. Para evitar los problemas que tuvieron otros científicos, utilizamos una combinación de difracción de neutrones y de rayos X para examinar la estructura de la proteína y su interacción con las moléculas de agua. Para nuestros experimentos utilizamos las instalaciones del Instituto Laue-Langevin (ILL)w1 y la fuente europea de radiación del sincrotrón (European Synchrotron Radiation Facility, ESRFw2; para saber más, ver cuadro, debajo). La investigación con neutrones utilizando muestras de cristal muy pequeñas ha sido posible gracias a los avances en la preparación de muestras y en la instrumentación que se han desarrollado en los últimos años en el ILL.
Como en cualquier otra investigación sobre estructuras de proteínas, inyectamos el gen que sintetiza la AFP de tipo III en la bacteria Escherichia coli, para que la proteína se sobreexpresara y pudiéramos obtener una cantidad suficiente. Se alimentó a la bacteria con agua pesada (en la que los átomos de hidrógeno normal se habían sustituido por deuterio), para estar seguros de que la proteína resultante estuviera perdeuterada: las posiciones de los átomos de hidrógeno estarían sustituidas por deuterio). Así, una vez cristalizada la proteína, pudimos determinar su estructura comprobando que la estructura de la proteína perdeuterada tenía la misma estructura que la normal. (Ver Cornuéjols, 2009, y Blattmann & Sticher, 2009 para saber más sobre la cristalización de proteínas y para intentar hacer una cristalización por ti mismo).
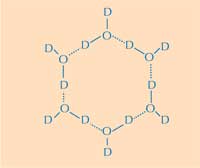
por 6 moléculas de agua. D =
deuterio; O = oxígeno. Haga
clic sobre la imagen para
ampliarla
Imagen cortesía de Nicola Graf
Parte de la respuesta de cómo la AFP de tipo III distingue el hielo del agua líquida reside en las diferencias en la estructura entre la AFP y las proteínas habituales, que tiene aminoácidos hidrófobos en el núcleo (diferente de las moléculas de agua que las rodean) y aminoácidos hidrófilos en la superficie. Como ya demostraron otros investigadores, las AFP son extrañas al tener aminoácidos hidrófobos en su superficie que evitan la unión de la proteína con agua líquida mediante puentes de hidrógeno. Estos aminoácidos hidrófobos forman parte de la superficie, que rodea a los núcleos de cristalización del hielo pero no el agua líquida ¿cómo funciona?
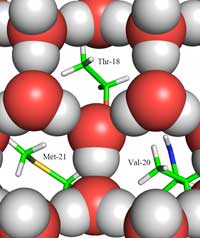
hielo (esferas rojas y grises)
y la zona de la proteína que
rodea al hielo en la que se
aprecian los grupos metilo de
la parte hidrófoba de la
proteína. Thr-18, Val-20 y
Met-21, enfrentados a los
huecos presentes en la
estructura del hielo. Haga clic
sobre la imagen para
ampliarla.
Copyright © 2011 John Wiley &
Sons, Ltd; procedencia de la
imagen: Howard et al. (2011)
Aquí reside la segunda parte de la respuesta: cómo la estructura del hielo difiere de la del agua líquida. Usando difracción de neutrones podemos localizar las posiciones de las moléculas de agua en la superficie de la proteína que la rodean. Identificamos un clúster tetraédrico de moléculas de agua unido a la superficie de la proteína que rodea al hielo. Este clúster tetraédrico se encuentra en el agua líquida (y en nuestro experimento) pero también es típica del hielo; esto nos ofreció un punto de partida para elaborar un modelo del resto del cristal de hielo y deducir cómo se uniría a la AFP. El modelo resultante está formado por anillos de agua de seis moléculas que es conocido como ‘configuración bote’: seis moléculas de agua en un ordenamiento hexagonal lo que deja un agujero en el centro (ver Figura 2, arriba) Este hueco permite que la proteína APF tipo III distinga la molécula de agua de los núcleos de cristalización del hielo: las zonas hidrófobas de la proteína que rodea al hielo encajan en los huecos del hielo a través de fuerzas de Van der Waals (Figura 3). Por el contrario, el agua líquida no tiene un hueco en el que los grupos metil de la parte hidrófoba puedan encajar. Esto evita que haya una gran superficie de contacto entre el agua líquida y el hielo, necesaria para una interacción más intensa.

un pez que no tuviera
proteínas anticongelantes?
Imagen cortesía de
dwleindecker / iStockphoto
Aunque algunos investigadores han sugerido que los restos hidrofóbos juegan un papel importante en el mecanismo de reconocimiento de los núcleos de cristalización del hielo por parte de la proteína AFP-III, éste es el primer dato experimental que lo confirma.
Saber más sobre por qué los peces del Ártico sobreviven en su entorno es interesante por sí mismo, pero también tiene potenciales aplicaciones industriales. Ya se incorporan estas proteínas AFP-III en algunos helados para evitar que se formen cristales de hielo grandes y así mejorar su consistencia. En el futuro, los genes que codifican las AFP se podrían incorporar a algunos vegetales para permitir que puedan desarrollarse a temperaturas bajo cero.
Más sobre el ILL y el ESRF

El Instituto Laue-Langevin (ILL)w1 es un centro internacional de investigación en la vanguardia de la ciencia y la tecnología de neutrones. Opera una de las fuentes de neutrones más intensa del mundo, que proporciona líneas de neutrones a 40 instrumentos de alta tecnología que están en continua actualización.
Como centro de apoyo a la investigación, el ILL ofrece sus instalaciones y equipo científico a investigadores visitantes. Cada año unos 1200 investigadores de más de 30 países visitan el ILL en Grenoble, Francia. Se llevan a cabo más de 800 experimentos cada año sobre ciencia básica en una gran variedad de campos: física de la materia condensada, química, biología, física nuclear y ciencia de materiales.
La fuente europea de radiación de sincrotrón (European Synchrotron Radiation Facility, ESRF)w2 es un gran centro internacional de investigación que comparte ubicación con el ILL en Grenoble, Francia. Produce rayos X de alta luminosidad, y son utilizados cada año por miles de científicos de todo el mundo.
La complementariedad de la radiación de rayos X del sincrotrón y los neutrones nos puede ayudar a entender el complejo funcionamiento de algunos sistemas como la proteína AFP descrita en este artículo. Para aprovechar al máximo la sinergia entre sincrotrón y neutrón, el ESRF y el ILL han sido claves en la creación de la Partnership for Structural Biology (PSB) y el Partnership for Soft-Condensed Matter; también se prevén otros acuerdos de colaboración en un futuro próximo.
El ILL y el ESRF son miembros de EIROforumw3, que publica Science in School.
References
- Blattmann B, Sticher P (2009) Growing crystals from protein. Science in School 11: 30-36.
- Cornuéjols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76.
- Howard EI, Blakeley MP et al. (2011) Neutron structure of type-III antifreeze protein allows the reconstruction of AFP–ice interface. Journal of Molecular Recognition 24: 724-732. doi: 10.1002/jmr.1130
Web References
- w1 – Para saber más sobre el ILL, ver: www.ill.eu
- w2 – Para saber más sobre el ESRF y el PSB, ver www.esrf.eu y www.psb-grenoble.eu
- w3 – Para saber más sobre EIROforum, ver:: www.eiroforum.org
Institutions
Review
Si alguna vez te has preguntado cómo puede sobrevivir un pez en un océano helado, encontrarás la solución en este interesantísimo artículo que conducirá al lector a través de la investigación científica hasta la estructura de las proteínas y sus interacciones.
El artículo puede ser usado como lectura en el tema de las biomoléculas o como punto de partida para la discusión sobre el papel de las proteínas en los organismos vivos. Algunas preguntas para evaluar la comprensión del artículo:
- Describe cómo se adaptan los peces a las frías aguas del Ártico.
- ¿Cómo actúan las AFP en la sangre de los peces?
- ¿Qué limitaciones tiene la difracción de rayos X en el análisis de las AFP?
- ¿En qué se diferencian la difracción de neutrones de la de rayos X?
- Describe los pasos que se siguieron hasta resolver la estructura de las AFP.
- ¿En qué se diferencian las AFP de otras proteínas?
- ¿Cómo diferencias las AFP entre las moléculas de agua y el hielo?
Angela Charles, Malta





