Was ist Chemolumineszenz? Understand article
Übersetzt von Yvonne Beck. Glühende Quallen, flimmernde Leuchtkäfer, lustige Leuchtstäbchen. Emma Welsh gibt eine Einführung in die schöne und mysteriöse Welt der Chemolumineszenz.

Mit freundlicher Genehmigung
von Erik Solheim; Bildquelle:
Wikimedia Commons
Leuchtkäfer, Quallen und Leuchtstäbchen – die einen fliegen , die anderen leben in den Tiefen des Ozeans und letztere unterhalten die Besucher in Nachtclubs. Was haben sie gemeinsam? Die Antwort liegt in einer faszinierenden chemischen Reaktion, die Licht produziert.
Unter Chemolumineszenz versteht man die Produktion von Licht während einer chemischen Reaktion. Zwei Chemikalien reagieren und bilden ein angeregtes, energiereiches Zwischenprodukt, das zerfällt und seine Energie dabei in Form von Photonen freisetzt (fettgedruckte Ausdrücke sind im Glossar erklärt), um in seinen Ausgangszustand zurückzukehren (Siehe Abbildung 1, unten).
A + B -> AB* -> Produkte + Licht
Angeregt
Übergang
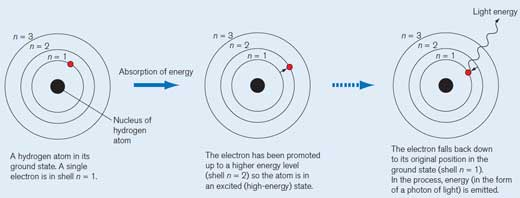
Ein Wasserstoffatom in seinem Grundzustand. Ein einzelnes Elektron befindet sich in der Schale n = 1. Jede Schal hat ihr eigenes Energieniveau.
Wenn das Wasserstoffatom ein Quantum (eine definierte Menge) Energie absorbiert, wird es auf einen höheren Energiezustand angehoben (Schale n = 2) und befindet sich nun im angeregten (energiereichen) Zustand. Um dies darzustellen, schreiben wir ein Sternchen (*) neben das Molekül.
Das Elektron fällt in seine Ausgangsposition im Grundzustand zurück (Schale n = 1). In diesem Vorgang wird eine Energieladung (ein Photon) in Form elektromagnetischer Strahlung freigesetzt. Die Wellenlänge hängt von der Energiemenge ab. Wenn die Wellenlänge sich im Bereich des sichtbaren Lichts befindet, wird der Elektronenübergang als Licht einer bestimmten Farbe wahrgenommen. Die Wellenlänge bestimmt die Farbe (siehe Abbildung 2, unten)
Mit freundlicher Genehmigung von Chemistry Review
Mit freundlicher Genehmigung von NASA
In Chemolumineszenz-Reaktionen wird normalerweise wenig Wärme frei, weil Energie stattdessen als Licht freigesetzt wird. Luminol produziert Licht, wenn es mit einem Oxidationsmittel reagiert; die Chemie dieser Reaktion ist im Kasten 1 beschrieben.
Kasten 1: Luminol, eine Chemikalie, die im Dunkeln leuchtet
Die Freisetzung eines Photons Licht durch ein Luminol-Molekül ist ein zeimlich komplexer, mehrschrittiger Vorgang. In einer basischen (alkalischen) Lösung liegt Luminol im Gleichgewicht mit seinem Anion vor, welches zweifach negativ geladen ist (-2). Das Anion kann in zwei verschiedenen Formen (Tautomeren) vorliegen, wobei die zwei negativen Ladungen entweder auf dem Sauerstoff (Enol-Form) oder dem Stickstoff (Keto-Form) delokalisiert sind. (Siehe Abbildung 3, unten).
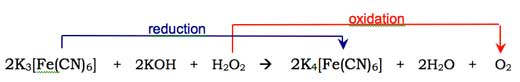
Molekularer Sauerstoff (O2) reagiert mit der Enolform des Luminol-Anions und oxidiert es zu einem zyklischen/ringförmigen Peroxid. Der nötige Sauerstoff wird in einer Redox-Reaktion hergestellt (das heißt, einer Reaktion, in der sowohl eine Reduktion, als auch eine Oxidation auftreten). An dieser Reaktion sind Wasserstoffperoxid (H2O2), Natriumhydroxid und beispielsweise und Kaliumhexacyanoferrat(III), K3[Fe(CN)6], auch als Kaliumferricyanid bekannt, beteiligt. Das Heaxcyanoferrat(III)-Ion ([Fe(CN)6]3-) wird reduziert zu einem Hexacyanoferrat(II)-Ion (K4[Fe(CN)6]), dabei entsteht Natriumferrocyanid, während die zwei Sauerstoffatome durch Wasserstoffperoxid oxidiert werden und ihre Oxidationszahl von -1 zu 0 ändern:
Wie in Abbildung 3 unten beschrieben ist, zerfällt das zyklische Peroxid dann zu 3-Aminophthalat (3-Amino-1,2-Benzoldicarboxylsäure) in einen angeregten Zustand, zusammen mit einem Molekül Stickstoff (N2). Diese Abbaureaktion wird dadurch begünstigt, dass das zyklische Peroxidmolekül sehr instabil ist. Zudem werden während der Reaktion einige schwache Bindungen gelöst. Auch die Zunahme an Entropie (Unordnung), die durch die Freisetzung eines Gasmoleküls entsteht, begünstigt den Prozess. Wenn das angeregte 3-Aminophthalat zurück in den Grundzustand fällt, wird ein Photon des blauen Lichts freigesetzt.
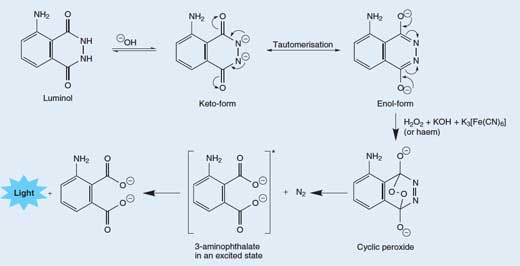
Tautomere sind Moleküle mit derselben Strukturformel, aber unterschiedlicher Anordnung von Atomen oder Bindungen. Die zwei Tautomere können ineinander überführt werden; die geschlängelten Pfeile zeigen die Bewegung der Elektronen an, die zur Umwandlung zwischen den beiden Formen führt. Zum Vergrößern auf das Bild klicken
Mit freundlicher Genehmigung von Chemistry Review
Chemolumineszenz in der Kriminalistik
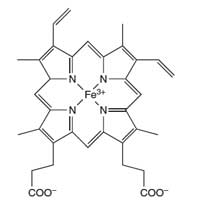
Häm-Gruppe im Hämoglobin.
Das Eisenatom (Fe) im
Zentrum des Porphyrinrings
katalysiert die Reaktion von
Luminol
Mit freundlicher Genehmigung
von Chemistry Review
Forensiker nutzen Luminol, um Blut am Tatort aufzuspüren. Eine Mischung aus Luminol und einer wässrigen Wasserstoffperoxidlösung wird auf den Bereich gesprüht, auf dem die Kriminalisten Blut vermuten. Das Eisen, das sich in der Häm-Einheit von Hämoglobin im Blut befindet (siehe Abbildung 4) reagiert als Katalysator der Reaktion, die in Kasten 1 beschrieben ist. Es muss dunkel im Raum sein und wenn Blut vorhanden ist, kann etwa 30 Sekunden lang ein blaues Glimmen beobachtet werden. Die Kriminalermittler können dieses Glimmen mit einem Fotofilm aufnehmen, der vor Gericht als Beweisstück für die Anwesenheit von Blut am Tatort verwendet werden kann. (Über eine Lehraktivität zur Forensik siehe Wallace-Müller, 2011.)
Da Eisen als Katalysator wirkt, wird es nur in winzigen Mengen benötigt. Daher ist nur eine geringe Menge Blut nötig, um ein positives Ergebnis zu erreichen. Das bedeutet, dass Blut auch dann nachgewiesen werden kann, wenn es mit bloßem Auge nicht sichtbar ist.

eingesetzt wird
Mit freundlicher Genehmigung
von How Stuff Works
Ein Hindernis beim Einsatz von Luminol ist, dass die Reaktion durch andere Chemikalien katalysiert werden kann, die am Tatort vorhanden sein können, beispielsweise kupferhaltige Legierungen, einige Reinigungsmittel wie Bleiche und sogar Meerrettich. Clevere Kriminelle können das Blut mit Bleiche entfernen, welche einen Nachweis von Blut unmöglich macht. Doch ein gebleichter Teppich kann die Leute schon vorher auf das Verbrechen hinweisen. Auch Urin enthält Blut in geringen Mengen, die ausreichend sein können, um die Reaktion von Luminol zu katalysieren. Sobald Luminol auf der Fläche angewendet wurde, kann es die Anwendung anderer Tests verhindern. Trotz dieser Nachteile wird Luminol in der Forensik immer noch eingesetzt, um Verbrechen zu lösen.
Im Nachtclub
Glühstäbchens. Zum
Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Chemistry Review
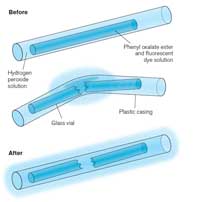
Das Leuchtstäbchen, dass zu leuchten anfängt, wenn du es knickst, ist ein Beispiel für Chemolumineszenz (siehe Abbildung 5). Leuchstäbchen bestehen aus einem Plastikrohr, das eine Mischung aus Diphenyloxalat und einem Farbstoff, (der dem Stäbchen seine Farbe gibt,) enthält. Im Inneren des Plastikröhrchens befindet sich ein kleineres Glasrohr mit Wasserstoffperoxid. Wenn das äußere Plastikrohr geknickt wird, zerbricht das innerer Glasröhrchen. Wasserstoffperoxid wird freigestzt und löst eine chemische Reaktion aus, bei der Licht produziert wird (siehe Kasten 2).Welche Farbe das Licht eines Leuchtstäbchens hat, hängt von dem Farbstoff ab, der verwendet wird (siehe Kasten 3).
Chemilumineszenz-Reaktionen, wie die der Glühstäbchen, sind temperaturabhängig. Die Reaktionsgeschwindigkeit erhöht sich mit der Temperatur – wenn man das Glühstäbchen in heißem Wasser aktiviert, wird es fantastisch leuchten, aber nicht so lang wie bei Raumtemperatur. Umgekehrt verlangsamt sich die Reaktionsgeschwindigkeit bei niedriger Temperatur – daher ist es möglich, das Stäbchen lange nachdem es normalerweise aufgehört hätte zu leuchten wieder hell zum Leuchten zu bringen, wenn man es für mehrere Stunden in den Kühlschrank legt und anschließend wieder rausnimmt. Die Reaktion hört im Kühlschrank nicht volsltändig auf, aber sie verlangsamt sich, so dass das Leuchten kaum erkennbar ist.
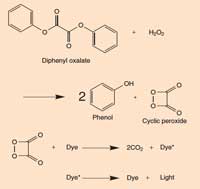
Kasten 2: Die Chemie der Glühstäbchen
klicken
Mit freundlicher Genehmigung
von Chemistry Review
Wenn Diphenyl-Oxalacetat mit Wasserstoffperoxid (H2O2) reagiert, wird es oxidiert zu Phenol und zyklischem Peroxid. Das Peroxid reagiert mit einem Farbstoffmolekül zu zwei Molekülen Kohlenstoffdioxid (CO2). In diesem Prozess wird ein Elektron im Farbstoffmolekül in einen angeregten Zustand gehoben. Wenn das angeregte (energiereiche) Farbstoffmolekül zurück in den Ausgangszustand kehrt, wird ein Photon frei. Diese Reaktion ist pH-abhängig. Wenn die Lösung leicht alkalisch ist, entsteht während der Reaktion ein helleres Licht.
Sicherheitshinweis
Phenol ist toxisch. Wenn das Glühstäbchen kaputt geht, muss man aufpassen, dass die Flüssigkeit nicht auf die Hände gelangt. Wenn dies passiert, die Hände sofort mit Seife waschen. Siehe hierzu auch die allgemeinen Sicherheitshinweise von Science in School.
Kasten 3: Wodurch leuchten Stäbe in verschiedenen Farben?
Die Fahrbstoffe, die in Glühstäbchen verwendet werden, sind konjugierte aromatische Verbindungen (Arene): Der Grad der Konjugation äußert sich durch verschiendene Farben des Lichts, das emittiert wird, wenn ein Elektron vom angeregten Zustand zurück in den Grundzustand fällt.
Lebende Leuchtstäbchen

Mit freundlicher Genehmigung
von Terry Priest; Bildquelle:
Flickr
Hast du bei einem nächtlichen Spaziergang am Strand schon mal Funke um deine Füße herum gesehen? Oder hast du nachts auf dem Land Leuchtkäfer entdeckt? Dies sind Beispiele für Biolumineszenz. Auch bei etwa 90% der Tiefseelebenwesen tritt dieses sonderbare Phänomen auf. Diese Organismen haben im Laufe ihrer Evolution die Fähigkeit erlangt, Licht zu produzieren, da dies mehrere nützliche Funktionen erfüllt. Das Glühen kann als Köder dienen, um Beute anzulocken, es kann als Tarnung dienen oder potentielle Sexualpartner anziehen. Manche Bakterien nutzen Biolumineszenz sogar zur Kommunikation.
Der Ausdruck “Glühwürmchen” bezeichnet die Larven verschiedener Insektenarten, inklusive der Leuchtkäfer. Einige von ihnen leuchten, um Räuber zu verjagen, während andere ihr Glühen zum Anlocken von Beute verwenden. Es gibt Arten von Tintenfischen und Krebstieren, die Wolken mit bioloumineszenter Flüssigkeit ausstoßen können, um Räuber zu verwirren, während sie das Weite suchen. Kreaturen, die in den Tiefen des Ozeans leben haben im Laufe der Evolution vor allem die Fähigkeit zur Freisetzung blauen oder grünen Lichts entwickelt, da es im Meerwasser gut durchgelassen wird. Dies liegt daran, dass blaues Licht eine kürzere Wellenlänge hat als rotes, was bedeutet, das es weniger gut von Wasserpartikeln absorbiert wird.
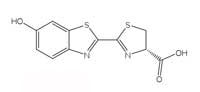
Leuchtkäfer-Luciferins. Zum
Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Chemistry Review
(structure)
Bioluminszenzreaktionen laufen unter Verbrauch von ATP (Adenosintriphosphat) als Energiequelle ab. Die Struktur der lichtproduzierenden Moleküle variiert von Art zu Art, aber sie alle werden unter dem Überbegriff Luziferin zusammengefasst. Die Struktur des Leuchtkäfer-Luziferins ist in Abbildung 6 links dargestellt. Wenn Leuchtkäfer glühen, wird das Luciferin oxidiert und bildet einen angeregten Komplex, der bei der Rückkehr in den Grundzustand ein Photon freisetzt, genau so, wie es für die Chemilumineszenz-Reaktion von Luminol, die im Kasten 1 beschrieben ist, der Fall ist. Allerdings nutzen Leuchtkäfern nicht Wasserstoffperoxid und Kaliumhexacyanoferrat(III), um Luziferin zu oxidieren, sondern molekularen Sauerstoff, sowie das Enzym Luciferase (auch dies ist ein Überbegriff – Luziferasen sind artspezifisch)

der Qualle Aeqourea victoria
entdeckt
Mit freundlicher Genehmigung
von Typoform / the Royal
Swedish Academy of Sciences
(RSAS)
Luciferase
Luciferin + O2 → Oxyluciferin + Licht
Verschiedene Experimente sind durchgeführt worden, um Aequorin, ein Protein, das in manchen Quallen vorkommt, zu untersuchen. Es produziert in Anwesenheit von Calcium blaues Licht (siehe Shaw, 2002 und Furtado, 2009) und kann daher in der Molekularbiologie dafür verwendet werden, den Calciumgehalt in Zellen zu messen. Manche Wissenschaftler haben andere Ideen entwickelt, um Bioluminszenz in der Zukunft nutzbar zu machen, zum Beispiel selbstleuchtende Weihnachtsbäume. Kannst du dir weitere interessante Einsatzgebiete für dieses Naturphänomen vorstellen?
Glossar
Anion: ein Atom (oder Gruppe von Atomen) mit negativer Ladung.
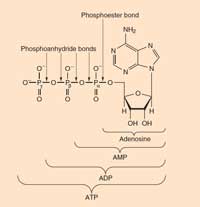
klicken
Mit freundlicher Genehmigung
von Chemistry Review
ATP: Adenonsintriphosphat tritt in allen bekannten Lebensformen auf. Es ist die Hauptenergiewährung in Zellen. ATP entsteht aus ADP (Adenosindiphosphat) und Phosphat in energieliefernden Reaktionen (wie der Oxidation von Glukose). Es wird gespalten (zu ADP und Phosphat). Die freigesetzte Energie freizusetzen, treibt energetisch ungünstige Reaktionen an.
Biolumineszenz: Die Bildung von Licht durch lebende Organismen. Biolumineszenz kann durch Absorption von Licht entstehen (Fluoreszenz oder Phosphoreszenz, z. B. bei vielen Tiefseefischen, oder durch eine chemische Reaktion (Chemolumineszenz, z. B. bei Leuchtkäfern).
Katalysator: Eine Substanz, die eine Reaktion beschleunigt, ohne während der Reaktion irreversibel chemisch verändert zu werden (z. B. wird ein Katalysator in der Reaktion nicht “verbraucht”). Kalatysatoren wirken, indem sie einen alternativen Reaktionsweg für die Reaktion ermöglichen, der weniger Energie benötigt.
Chemolumineszenz: Eine Art der Lumineszenz, bei der Elektronen in einer chemischen Reaktion angeregt werden, z. B. die Luminol-Reaktion, die in Kasten 1 beschrieben ist.
Konjugiert: Konjugierte Systeme kommen in der Chemie vor allem dann vor, wenn Doppelbindungen nacheinander vorkommen. Die Atome eines konjugierten Systems werden durch kovalente Bildungen zusammengehalten und haben abwechselnd Einzel- und Mehrfachbildungen (vor allem Doppelbindungen, aber Dreifachbindungen können auch konjugiert vorkommen). Alkene sind eben; konjugierte Systeme müssen immer ebenflächig vorkommen, um die Delokalisierung der Elektronen im System zu ermöglichen. Die Farbstoffmoleküle in Kasten 3 sind Beispiele für konjugierte Verbindungen.
Kovalente Bindungen: Bindungen zwischen zwei Atomen, die sich ein Elektronenpaar teilen.
Delokalisierung: Wenn Moleküle konjugierte Bildungen haben, können die Elektronen sich frei im gesamten konjugierten System bewegen. Diese Elektronen werden als delokalisiert bezeichnet. Die Elektronen im Benzol-Ring sind delokalisiert, und daher haben alle Kohlenstoff-Kohlenstoff-Bindungen dieselbe Länge.

delokalisiert in einem
konjugierten
Elektronensystem
Mit freundlicher Genehmigung
von Chemistry Review
Fluoreszenz: Eine Art der Lumineszenz, bei der Elektronen durch Licht angeregt werden, z. B. auf Sicherheitsmerkmalen von Geldscheinen.
Lumineszenz: Lichtproduktion, normalerweise bei niedrigen Temperaturen, z. B. durch chemische Reaktionen oder elektrische Energie. Im Gegensatz dazu bezeichnet Inkandesezenz (Glut) Licht, das durch hohe Temperaturen erzeugt wird.
Phosphoreszenz: Wie Fluoreszenz, aber das Glühen dauert länger an (nach einigen Definitionen länger als 10 Nanosekunden), z. B. bei Klebebildchen, die im Licht leuchten.
Danksagung
Die Originalversion diese Artikels wurde in Chemistry Review veröffentlicht und wird mit freundlicher Genehmigung des Verlegers Philip Allan abgedruckt. Für ein Abonnement von Chemistry Review, einer Zeitschrift die sich an Schüler der Schulchemie im Alter von 16-19 Jahren wendet, siehe: www.philipallan.co.uk/chemistryreview
References
- Furtado S (2009) Lebewesen grün einfärben: GFP. Science in School 12: 19-23.
- Shaw A (2002) Genetic chess by the light of a jellyfish. Chemistry Review 12(1): 2-5
- Wallace-Müller K (2011) Das DNA-Detektivspiel. Science in School 19: 30-35.
Resources
- Einige Schulexperimente mit Luminol für ältere Schüler und alles über die Chemolumineszenz von Luminol sind auf Deelan Flemings Webseite beschrieben: www.chm.bris.ac.uk/webprojects2002/fleming/experimental.htm
- Mehr über andere Arten der Chemie des Lichts kann man hier lernen:
-
Douglas P, Garley M (2010) Chemie und Licht. Science in School 14: 63-68.
-
Review
Dieser Artikel bietet eine Möglichkeit, Schüler zum Verständnis chemischer Reaktionen zu bewegen. Selbst wenn sie sich nicht sonderlich dafür interessieren, warum ein Glühstäbchen im Dunkeln leuchtet, werden sie sicher mit Eifer herausfinden wollen, wie Leuchtkäfer oder Quallen Licht produzieren, oder wie Blut an Tatorten entdeckt wird. Dieser Artikel kann entweder als Einstieg in das Thema chemische Reaktionen genutzt werden oder interessante Beispiele für Redoxreaktionen liefern. Ebenfalls kann er die Energieniveaus in den Atomschalen veranschaulichen.
Der Artikel kann für Schüler verschiedenen Alters und in verschiedenen Fächern und Themenbereichen eingesetzt werden. Für 14 bis 15-jährige Schüler könnte er im Chemieunterricht verwendet werden (Atomstruktur und Elektronenbewegung zwischen Schalen, Einführung chemischer Reaktionen) oder im Biologieunterricht (Biolumineszenz). Für diese Altersgruppe müsste die Lehrperson die Information im Artikel vereinfachen und die Details der Reaktionen auslassen. Für 16 bis 18 jährige Schüler kann sich der Artikel dazu eignen, Chemie zu unterrichten (Redoxreaktionen, Katalysatoren, der Einfluss von Temperatur auf die Reaktionsgeschwindigkeit, der Einfluss des pH auf Reaktionen, sowie kovalente Bindungen). Auch Physik (elektromagnetisches Spektrum und Photonen) oder Genetik (Gentechnik) sind mögliche Fächer. Geeignete Verständnisfragen sind unter anderem:
- Was ist Chemolumineszenz?
- Wozu nutzen Kriminalisten Chemolumineszenz?
- Erkläre einige biologische Funktionen von Biolumineszenz.
- Warum solltest du dein Glühstäbchen im Kühlschrank aufbewahren, wenn du es nicht benutzt?
- Wie kannst du dir einen selbstbeleuchteten Weihnachtsbaum basteln?
Ana Gil, Spanien