Neutronen und Frostschutz: Forschung an arktischen Fischen Understand article
Übersetzt von Verena Müller. Matthew Blakeley vom ILL und seine Kollegen vom ESRF und von woanders haben entdeckt, wie ein Frostschutzmittel im Blut von arktischen Fischen diese bei Temperaturen unter Null am Leben erhält. Er und Eleanor Hayes erklären.

(Myoxocephalus scorpius) hat
auch Frostschutzproteine.
Public Domain Bild; Bildquelle:
Wikimedia Commons
Wenn wir an die Arktis denken, fallen uns Eisberge, Polarbären und Seehunde ein. Eiskalte Temperaturen, eisige Winde und einsame Schneewüsten – eine Herausforderung für jedes Tier, das dort lebt.

der Arktis haben Tiere zur
Entwicklung
bemerkenswerter
Anpassungen gezwungen
Mit freundlicher Genehmigung
von ucumari; Bildquelle: Flickr
Wir kennen viele Arten, auf welche sich arktische Tiere an ihre Umwelt angepasst haben: das dichte Fell der Polarbären, die dicke Speckschicht der Seehunde und das Zugverhalten vieler Vögel. Diese Tiere sind jedoch alle Warmblüter, d.h. sie halten ihre Körpertemperatur konstant und um einiges höher als die Temperatur ihrer eisigen Umgebung.
Für Fische ist die Situation eine andere – sie sind meistens Kaltblüter, was bedeutet, dass ihre Körper dieselbe Temperatur wie ihre Umgebung haben. Und ihre Umgebung ist in der Tat sehr kalt: der Arktische Ozean wird oft bis zu -1 °C kalt, nur der hohe Salzgehalt des Wassers verhindert, dass es friert.
Fischblut, was um einiges weniger salzig ist, würde erwartungsgemäß bei -0.5 °C gefrieren. Um dies zu verhindern haben arktische Fische spezialisierte Frostschutz-Proteine (AFPs, antifreeze proteins) entwickelt.

von Rita Willaert; Bildquelle:
Flickr
AFPs haben komplexe Aufgaben. Um zu verhindern, dass die Fische gefrieren und sterben, müssen sie an die Kristallisationskeime, die sich im Körper des Fisches bilden, binden und verhindern, dass diese zu Eiskristallen werden. Wie aber unterscheiden sie Eis von flüssigem Wasser?
AFPs wurden mit vielen verschiedenen Techniken ausführlich untersucht, unter anderem mit Röntgenbeugung. Dabei wurde das Vorhandensein einer spezialisierten Eis-bindender Oberfläche entdeckt.
Röntgenbeugung hängt davon ab, wie stark Röntgenstrahlen durch die Elektronenwolke eines jeden Atoms gestreut werden. Viele Moleküle haben bestimmte Beugungsmuster. Wasserstoff- (und Deuterium-) Atome, welche jeweils nur ein Elektron haben, streuen Röntgenstrahlen nur sehr wenig (Abbildung 1a, unten), so dass das Röntgenstreuungssignal von Wasser (H2O) fast gleich wie das von Sauerstoffatomen (O) ist. Dadurch konnten die Wissenschaftler, als sie die Wechselwirkung der Eis-bindenden Oberfläche mit dem Eis untersuchen wollten, die Wassermoleküle auf der Oberfläche nicht identifizieren.
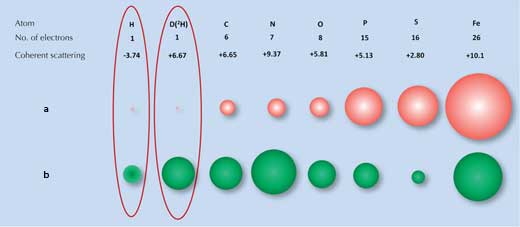
a) Röntgenstrahlen werden von Elektronen gestreut, wobei die Stärke der Streuung (Größe der roten Bälle) proportional zu Anzahl an Elektronen ist. b) Neutronen werden von Kernen gestreut, wobei die Stärke der Streuung (Größe der grünen Bälle) von den spezifischen nuklearen Kräften abhängt.
Mit freundlicher Genehmigung von Matthew Blakeley

die Frostschutz-Proteine des
„Ocean Pout“, Zoarces
americanus, untersucht
Mit freundlicher Genehmigung
von Derek Keats; Bildquelle:
Flickr
Hier ist eine zweite Technik, die Neutronenstreuung, von Nutzen. Neutronen werden von den Atomkernen und nicht von den Elektronen gestreut, und die Stärke der Streuung hängt von den spezifischen nuklearen Kräften ab. Diese Kräfte wiederum hängen nicht nur von den Elementen, sondern auch von den Isotopen der Elemente ab, welche sich in der Zahl der Neutronen im Kern unterscheiden (Abbildung 1b, oben). Zu unserem Glück können Wasserstoffatome durch Neutronenstreuung leicht detektiert werden und das Wasserstoffisotop Deuterium (schwerer Wasserstoff, der ein zusätzliches Neutron hat) kann sogar noch verlässlicher erkannt werden. Daher unterscheidet sich das Signal für Wasser deutlich von dem für Sauerstoff.
Wir (Matthew Blakely und seine Wissenschaftlerkollegen) haben beschlossen eine Art der AFPs zu untersuchen, welche im Blut von arktischen Fischen vorkommt: Typ-III AFPs. Um die Probleme zu umgehen, denen andere Wissenschaftler begegnet sind, haben wir eine Kombination aus Röntgen- und Neutronenstreuung angewandt, um die Struktur des Proteins und seine Wechselwirkungen mit Wassermolekülen zu untersuchen. Für unsere Experimente haben wir die Anlagen des Instituts Laue-Langevin (ILL)w1und der Europäischen Synchrotron Radiation Facility (ESRFw2; siehe Kasten unten) genutzt. Die Neutronenforschung mit so kleinen Kristallen war nur durch die Fortschritte, die in den letzten Jahren in der Probenvorbereitung und der Ausstattung am ILL gemacht wurden möglich.
Wir haben, wie es bei Untersuchungen von Proteinstrukturen üblich ist, das synthetische Gen des Typ-III AFPs in Escherichia coli eingebaut, wo es überexprimiert wurde, so dass wir eine ausreichende Menge des Proteins gewinnen konnten. Die Bakterien wurden mit schwerem Wasser versorgt (welches Deuterium anstelle des normalen Wasserstoffatoms enthält), um sicher zu gehen, dass das hergestellte Protein deuteriert wurde, das heißt alle Wasserstoffatome wurden durch Deuterium ersetzt. Wir haben dann das Protein kristallisiert, damit wir seine Struktur bestimmen konnten. Dabei haben wir untersucht, ob die deuterierte Form dieselbe Struktur wie die normale Form hat. (Siehe auch Cornuéjols, 2009, und Blattmann & Sticher, 2009, um mehr über Proteinkristallographie zu erfahren oder es sogar selbst zu probieren.)
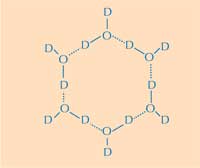
gliedrige Wasserring. D =
Deuterium; O = Sauerstoff.
Zum Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Nicola Graf
Die Frage, wie Typ-III AFPs Eis von flüssigem Wasser unterscheiden kann zum Teil mit dem strukturellen Unterschied der AFPs zu typischen Proteinen erklärt werden. Diese haben normalerweise hydrophobe Aminosäuren im Zentrum (verborgen vor den Wassermolekülen ihrer Umgebung) und hydrophile Aminosäuren auf ihrer Oberfläche. Wie frühere Forscher schon gezeigt haben, sind AFPs in dieser Beziehung ungewöhnlich, da sie viele hydrophobe Aminosäuren auf ihrer Oberfläche haben. Dies verhindert, dass das Protein Wasserstoffbrücken mit flüssigem Wasser bildet. Diese hydrophoben Aminosäuren sind Teil der Eis-bindenden Oberfläche, die Kristallisationskeime aber nicht flüssiges Wasser bindet. Wie funktioniert das?
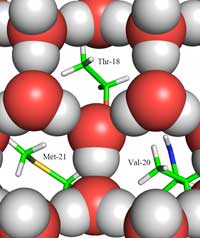
Zwischenfläche zwischen Eis
(dargestellt als rote und
graue Kugeln) und der
Eis-bindenden Region.
Dargestellt sind die
Methylgruppen der
hydrohoben Aminosäurereste
Thr-18, Val-20 und Met-21,
die zu den Löchern in der
Eisstruktur zeigen. Zum
Vergrößern auf das Bild
klicken
Copyright © 2011 John Wiley &
Sons, Ltd; Bildquelle:
Howard et al. (2011)
Darin liegt der zweite Teil der Antwort: wie sich die Struktur von Eis von derer von flüssigem Wasser unterscheidet. Mit Hilfe der Neutronenstreuung konnten wir die Positionen der Wassermoleküle auf der Eis-bindenden Oberfläche bestimmen. Wir haben entdeckt, dass ein tetraedrisches Cluster von Wassermolekülen an die Eis-bindende Oberfläche des Proteins bindet. Dieses tetraedische Cluster findet man in flüssigem Wasser (wie in unserem Experiment), aber es kommt auch in Eis vor. Ausgehend davon modellierten wir den Rest des Eiskristalls und schlussfolgerten, wie er an das AFP bindet. Das resultierende Modell besteht aus sechsgliedrigen Wasserringen, die eine sogenannte Boot-Konformation annehmen: sechs Wassermoleküle ordnen sich zu einem Sechseck an, wobei in der Mitte ein Loch entsteht (siehe Abbildung 2, oben). Mit Hilfe dieses Lochs können die Typ-III AFPs zwischen der Struktur von Kristallisationskeimen und Wasser unterscheiden: Die hydrophoben Regionen der Eis-bindenden Stelle passen in die Löcher und binden durch Van-der-Waals-Kräften an das Eis (Abbildung 3, unten). Wasser hat im Gegensatz dazu kein Loch in welches hydrophobe Bereiche wie etwa Methylgruppen passen. Das verhindert, dass sich eine große Kontaktoberfläche zwischen flüssigem Wasser und der Eis-bindenden Oberfläche bildet, welche für eine starke Interaktion notwendig wäre.

Fische in der Arktis keine
Frostschutzproteine hätten?
Mit freundlicher Genehmigung
von dwleindecker / iStockphoto
Obwohl schon andere Forscher vermutet haben, dass hydrophobe Aminosäurereste eine wichtige Rolle dabei spielen, wie Typ-III AFPs Kristallisationskeime erkennen, ist dies der erste experimentelle Beweis dafür.
Es ist zwar schon an sich interessant mehr darüber zu erfahren, wie arktische Fische in ihrer Umwelt überleben können, jedoch hat dieser Forschungszweig auch potenzielle industrielle Anwendungen. Bereits heute werden Typ-III AFPs zu manchen Eiscremes hinzugegeben, um die Bildung von großen Eiskristallen zu reduzieren und die Konsistenz zu verbessern. In Zukunft könnten AFPs in Nutzpflanzen eingebaut werden, damit sie auch in Regionen, wo die Temperatur unter Null sinkt, wachsen können.
Mehr über ILL und ESRF

Das Institut Laue-Langevin (ILL)w1 ist ein internationales Forschungszentrum, das weltweit führend in der Neutronenwissenschaft und -technologie ist. Dort wird eine der stärksten Neutronenquellen der Welt betrieben, die Neutronenstrahlen in 40 Hochdurchsatzinstrumente einspeist, welche ständig verbessert werden.
Als Service-Einrichtung stellt das ILL seine Anlagen und Expertise Gastwissenschaftlern zur Verfügung. Jedes Jahr kommen etwa 1200 Wissenschaftler aus mehr als 30 Ländern in das ILL nach Grenoble, Frankreich. Mehr als 800 Experimente werden jedes Jahr dort durchgeführt. Der Schwerpunkt der Experimente liegt hauptsächlich in der Grundlagenforschung verschiedener Fachrichtungen: Physik der kondensierten Materie, Chemie, Biologie, Kernphysik und Materialwissenschaften.
Die Europäische Synchrotron Radiation Facility (ESRF)w2 ist ein internationales Forschungszentrum, was sich mit dem ILL in Grenoble, Frankreich einen Standort teilt. Dort werden hochbrillante Röntgenstrahlen produziert, die von tausenden von Wissenschaftlern aus der ganzen Welt jedes Jahr genutzt werden.
Die Kombination von Synchrotron-Röntgenstrahlen und Neutronenstrahlen kann zum Verständnis der Funktion komplexer Systeme beitragen wie derer von AFPs hier im Artikel. Um alle Vorteile einer Synergie von Synchrotron- und Neutronenwissenschaft zu auszuschöpfen, haben das ESRF und das ILL einen Schlüsselbeitrag zur Gründung der Partnerschaft für Strukturbiologie (PSB) und der Partnerschaft für Weich-kondensierte Materie geleistet. Weitere Partnerschaften sind für die nahe Zukunft geplant.
Das ILL und das ESRF sind Mitglieder des EIROforumsw3, dem Herausgeber von Science in School.
References
- Blattmann B, Sticher P (2009) Proteinkristalle züchten. Science in School 11.
- Cornuéjols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76.
- Howard EI, Blakeley MP et al. (2011) Neutron structure of type-III antifreeze protein allows the reconstruction of AFP–ice interface. Journal of Molecular Recognition 24: 724-732. doi: 10.1002/jmr.1130
Web References
- w1 – Um mehr über das ILL zu erfahren, siehe: www.ill.eu
- w2 – Um mehr über das ESRF und die PSB zu erfahren, siehe www.esrf.eu und www.psb-grenoble.eu
- w3 – Um mehr über das EIROforum zu erfahren, siehe: www.eiroforum.org
Institutions
Review
Falls Sie sich je gefragt haben, wie Fische im eisigen Ozean überleben können finden Sie die Antwort in diesem mitreißendem Artikel, der den Leser durch eine wissenschaftliche Studie von Proteinstrukturen und Proteininteraktionen führt.
Der Artikel kann als Hintergrundlektüre zur Untersuchung von Biomolekülen genutzt werden oder auch als Grundlage für eine Diskussion über die Rolle von Proteinen in lebenden Organismen. Geeignete Verständnisfragen sind:
- Beschreibe, wie arktische Fische an das Leben in den eisigen arktischen Gewässern angepasst sind.
- Wie können AFPs als Frostschutzmittel im Blut der Fische wirken?
- Was sind die Grenzen der Röntgenbeugung in der Untersuchung von AFPs?
- Inwiefern unterscheidet sich Neutronenstreuung von Röntgenstreuung?
- Beschreibe die Schritte, die in der erfolgreichen Untersuchung der Struktur der AFPs durchgeführt wurden.
- Wie unterscheiden sich AFPs von anderen Proteinen?
- Wie unterscheiden AFPs Eis von flüssigem Wasser?
Angela Charles, Malta





