¿De qué se componen las estrellas? Teach article
Traducido por Lucas Baeyens. Descubre cómo sabemos de qué están compuestos el Sol y las estrellas.
A diferencia de otros componentes del Sistema Solar, como planetas y satélites, las estrellas se encuentran muy lejos del alcance de astronaves o, como es el caso del Sol, su temperatura imposibilita cualquier acercamiento. Por tanto, ¿cómo conocemos tanto sobre ellas sin poder aproximar sondas, vehículos exploradores o astronautas? La respuesta radica en la luz. Sabemos que el color de una estrella nos indica su temperatura (Ribeiro, 2015), pero, ¿cómo sabemos de qué están compuestas? La respuesta vuelve a ser la luz estelar, más concretamente, el espectro estelar.
La idea que originó esta actividad se remonta a la edición de 2015 del festival Science on Stage, en Londres, donde se llevó a cabo un debate sobre la posible utilización de experimentos prácticos en el aula para poder enseñar la composición química de una estrella. La actividad que se analiza en este artículo se ha diseñado para que estudiantes de entre 15 y 18 años puedan explorar diferentes espectros de luz y comprender cómo pueden utilizarse para identificar diferentes elementos químicos en lámparas o, lo que es más importante, en la estrella más cercana que tenemos, el Sol.
Espectros de luz
En un célebre experimento realizado en 1666, Isaac Newton empleó un prisma para mostrar que la luz podía dividirse en diferentes colores que componen la luz blanca y demostró que estos colores no se originaban en el cristal, como se creía hasta entonces. También utilizó por primera vez la palabra ‘espectro’ para describir el arcoíris de colores. Estos hallazgos supusieron el punto de partida de la ciencia de la espectroscopia.

Para Newton, el espectro solar parecía ser un continuo. Sin embargo, en 1814, Joseph von Fraunhofer descubrió que, cuando la luz se dispersa lo suficiente a través de una ranura estrecha, el espectro contiene diversas líneas oscuras, conocidas actualmente como ‘líneas de Fraunhofer’ (ver imagen 1). Estas líneas han resultado esenciales para determinar la composición solar, 45 años después, gracias al trabajo de Gustav Kirchhoff y Robert Bunsen.
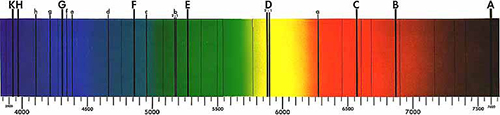
Imagen de dominio público. Fuente: Wikimedia Commons
En 1860, Kirchhoff y Bunsen analizaron un tipo de espectro distinto. En vez de observar líneas oscuras en contraste con un fondo multicolor, estudiaron las líneas brillantes que se perciben sobre fondo oscuro originadas al calentar elementos con el mechero Bunsen. La imagen 2 representa el espectro del sodio, el cual se puede obtener quemando sal de mesa (NaCl) o haciendo brillar una lámpara de sodio a baja presión, como las que se utilizan en las farolas.
Bunsen y Kirchhoff llegaron a la conclusión de que mediante el estudio de las líneas de emisión se podían identificar diferentes elementos químicos y descubrieron dos elementos nuevos en dos años: el cesio y el rubidio.
Kirchhoff continuó investigando y descubrió que las líneas de emisión coincidían con diversas líneas de Fraunhofer. Por ejemplo, la línea amarilla brillante del espectro del sodio se encontraba en la misma posición que la línea oscura en la zona amarilla del espectro solar, denominada ‘D’ por Fraunhofer.

Imagen de dominio público. Fuente: Wikimedia Commons
Tales experimentos revelaron la existencia de tres tipos diferentes de espectros: continuos, de absorción y de emisión. El primero muestra todas las longitudes de onda, el segundo contiene algunas de las longitudes de onda de la luz y el tercero muestra líneas oscuras en un fondo multicolor. Los tres tipos de espectros se forman de acuerdo con las tres leyes de la espectroscopia de Kirchhoff:
- Un gas, líquido o sólido incandescente a alta presión produce un espectro continuo.
- Un espectro continuo que atraviesa un gas frío de densidad baja produce un espectro de absorción.
- Un gas caliente de baja presión emite un espectro de emisión.
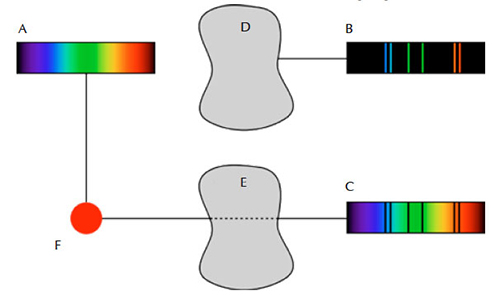
Imagen de dominio público. Fuente: Wikimedia Commons.
Kirchhoff no solo había descubierto que la existencia de un elemento químico era el responsable de que aparecieran líneas espectrales en la misma posición tanto en el espectro de emisión como el de absorción, sino también detectó la existencia de sodio en el Sol. Por tanto, para saber la composición del Sol, o de cualquier otra estrella, tan sólo hay que comparar los espectros de elementos conocidos con los espectros de dicha estrella.
Obtención de espectros de diferentes fuentes de luz
Materiales
- Diversas fuentes de luz (lámparas incandescentes, lámparas fluorescentes, farolas, luces de neón…)
- Espectrómetros; constrúyelo a partir de cajas de cerealesw1 (ver cuadro) o consíguelo comprando y montando un mini-espectrómetro plegable (disponible en líneaw2)
- Espectros de emisión de diferentes elementos; puedes encontrar imágenes en libros o descargarlas por Internetw3.
Construcción de un espectrómetro
Materiales
- Caja de cereales
- Papel grueso
- CD
- Tijeras
- Cinta adhesiva oscura
Paso a paso
- Perfora uno de los lados estrechos de la caja de cereales realizando un corte horizontal. Para que salga una línea recta, puedes utilizar cinta adhesiva para pegar dos trozos pequeños de papel grueso, dejando una pequeña ranura entre ellos. La anchura ideal es de 0,2 mm.
- Recorta el CD por la mitad con las tijeras. En el lado contrario donde has perforado la caja, recorta otra línea horizontal. Alarga la línea más allá de las esquinas de la caja por ambos lados para que cuando coloques el CD por la ranura, quede en un ángulo de 60º con respecto a la base.
- Recorta un agujero en la parte superior, desde el cual puedas observar el CD.
- Cubre los bordes del CD con cinta adhesiva oscura para evitar cualquier luz lateral.
Para más información sobre la construcción del espectrómetro, haz clic aquí.
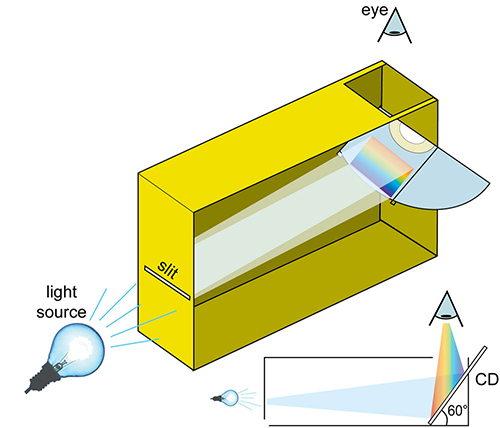
Imagen cortesía de Mark Tiele Westra
Otra alternativa sería emplear el mini-espectrómetro plegable que puedes adquirir online w2. Les permitirá a tus estudiantes hacer fotos del espectro observable utilizando un smartphone.
Nota de seguridad
No dirijas tu mirada directamente al Sol, ni siquiera mediante el espectrómetro. En lugar de ello, dirige tu espectrómetro hacia el cielo para poder observar un espectro de luz solar indirecta.
Paso a paso
Comparación de espectros
Propón a tus estudiantes que observen la luz mediante el espectrómetro desde diversas fuentes luminosas. Esto les demostrará que no todas las fuentes de luz son iguales, ya que sus espectros tampoco lo son.
Preguntas:
- ¿Qué tipo de espectro refleja cada fuente de luz?
- ¿Qué te indica acerca del tipo de fuente de luz?
- ¿Qué tipo de fuente de luz se usa con mayor frecuencia y por qué?
Explicación:
Los estudiantes observarán diferentes espectros según la fuente de luz:
- Una bombilla incandescente emite un espectro continuo con todos los colores presentes.
- Una lámpara de descarga de gas contiene normalmente helio (He), neón (Ne), argón (Ar), kriptón (Kr) y xenón (Xe) (imagen 3). Cada gas emite un espectro de emisión diferente.
- Las farolas suelen contener sodio, por lo que emitirán el espectro de emisión del sodio.
- El espectro emitido por una bombilla LED depende del material semiconductor del LED. Un LED azul creará un espectro continuo con una parte azul más brillante.
- El Sol emite un espectro continuo. Si utilizaras un espectrómetro más sofisticado, verías las líneas de absorción oscuras determinadas por los elementos por los que la luz solar pasa en la atmósfera.
Los diversos espectros indican que tanto las fuentes de luz como los mecanismos que existen detrás de su formación son diferentes, a excepción del Sol y la lámpara incandescente: la fuente de luz más utilizada es incandescente porque emite un espectro continuo, como el Sol.
Análisis de espectros de emisión
Utilizando diferentes lámparas de descarga de gas, invita a tus estudiantes a comparar los espectros de la lámpara con imágenes impresas de espectros de emisión de diversos elementos y a identificar los elementos presentes. Este ejercicio supone la base de la espectroscopia como método de análisis químico.
Nota de seguridad
Las lámparas de descarga de gas requieren alto voltaje, por lo que deberían ser manipuladas únicamente por el profesor.

Imagen cortesía de Heinrich Pniok. Fuente: Wikimedia Commons
Preguntas:

emisión del helio utilizando
un mini-espectrómetro
plegable
Imagen cortesía de Ole Ahlgren
- ¿Tienen todas las líneas espectrales la misma intensidad?
- ¿Qué relación une las líneas espectrales con el color de la lámpara?
- ¿Cómo se pueden emplear los espectros para identificar diferentes elementos químicos?
Explicación:
Algunas longitudes de onda son más intensas que otras, lo que hace que algunas líneas de emisión sean más brillantes que otras. Este fenómeno se refleja en el color de la lámpara. Por ejemplo, la luz de una lámpara de sodio es más amarillenta porque es el color que se emite en mayor medida, aunque también se emita luz roja y verde. Todo elemento tiene su propia longitud de onda, por lo que se pueden utilizar los espectros para identificar qué elementos químicos se encuentran presentes.
Actividades adicionales
Para resultados más detallados, se pueden llevar a cabo actividades adicionales con un espectrómetro capaz de detectar las líneas de absorción del Sol y mediante el uso de un software de registro de datos adecuado. Las imágenes 4 y 5 se obtuvieron utilizando el espectrómetro Ocean Optics Red Tide y el programa informático LoggerPro.
Estos espectros difieren de aquellos obtenidos con un espectrómetro simple, ya que contienen más información, como las longitudes de onda de cada línea espectral y su intensidad relativa. El espectro solar también puede revelar que la presencia de líneas de absorción no implica que ciertas longitudes de onda no existan en absoluto, sino que simplemente son menos intensas que otras.
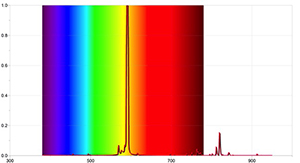
Imagen cortesía de Ole Ahlgren
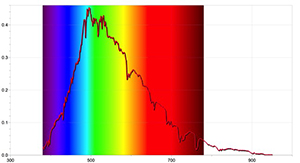
Imagen cortesía de Ole Ahlgren

mercurio mediante el
espectrómetro Ocean Optics
Red Tide y el programa
informático LoggerPro.
Imagen cortesía de Ole Ahlgren
Materiales
Paso a paso
Los estudiantes pueden registrar el espectro solar utilizando el espectrómetro. El software de registro de datos proporcionará la longitud de onda de las líneas de absorción que escojan los estudiantes, que deberían ser las más prominentes. Para determinar qué elementos se encuentran presentes, se pueden emplear dos opciones:
- Los estudiantes deben comparar cada longitud de onda con las que se encuentren en un cuadro como el que ofrece la página web oficial del Observatorio Óptico del SETI en Columbusw6.
- Los estudiantes deben registrar los espectros de emisión de diferentes elementos y comparar las longitudes de onda de las líneas con las del Sol. El número de elementos que se pueden utilizar se limita a aquellos presentes en lámparas de descarga de gas. Se puede quemar metales y obtener el espectro de emisión, pero se reflejarán líneas de otros elementos. Por ejemplo, las líneas más prominentes que se muestran al quemar magnesio (imagen 6) responden a la presencia de nitrógeno.

Imagen cortesía de Ole Ahlgren
Obtener espectros de diferentes fuentes de luz y elementos químicos y compararlos con el espectro del Sol ayudará a los estudiantes a aprender cómo podemos saber la composición del Sol y de otras estrellas.
References
- Ribeiro C (2015) Luz de una estrella en una lámpara eléctrica. Science in School 31: 37–42.
Web References
- w1 – Para más información sobre la construcción de tu propio espectrómetro a partir de una caja de cerales: Westra M (2007) Una mirada nueva a la luz: construye tu propio espectrómetro. Science in School 4: 30-34.
- w2 – Puedes adquirir un kit de mini-espectrómetro portátil desde la tienda online Public Laboratory store (en inglés).
- w3 – Puedes descargar espectros de emisión para diversos elementos en Open Discovery Space (en inglés).
- w4 – Puedes encontrar aquí ejemplos de espectrómetros adecuados para la actividad adicional (en inglés).
- w5 – LoggerPro es un reconocido y galardonado software de análisis y recolección de datos para ordenadores Windows y Mac.
- w6 – Puedes observar líneas de Fraunhofer y sus longitudes de onda en la página web del Columbus Optical SETI Observatory.
Resources
- Para revisar los usos prácticos de la luz:
- Douglas P, Garley M (2010) Química y luz. Science in School 14: 63-68.
- Science on Stage es una red europea de profesores de ciencia, tecnología, ingeniería y matemáticas, creada inicialmente en 1999 por EIROforum, el editor de Science in School. Science on Stage reúne a profesores de ciencias de toda Europa para el intercambio de ideas para la enseñanza. Consiste de colaboradores apasionados de 25 países.
Institutions
Science on StageReview
Los autores de este artículo describen brevemente cómo se descubrieron los espectros y cómo se pueden utilizar diferentes espectros para identificar de qué se componen las estrellas.
Del mismo modo, muestran como construir un espectrómetro básico para realizar mediciones espectrales. Esta actividad puede ofrecer resultados fascinantes para la enseñanza.
Ejemplos de preguntas de comprensión sobre la materia que se trata podrían ser:
- ¿Cómo descubrió Newton el espectro de la luz?
- ¿Qué colores se encuentran en el espectro de la luz?
- ¿Qué colores marcan el comienzo y el final del espectro visible de la luz?
- Describe los hallazgos de Bunsen y Kirchhoff.
Gerd Vogt, Higher Secondary School for Environment and Economics (HLUW), Yspertal, Austria





