Gastronomía molecular en clase de química Teach article
Traducido por José L. Cebollada. Las esferas de alginato valen tanto para las clases de química como para la gastronomía molecular.
La gastronomía molecular es una nueva tendencia de la alta cocina en la que los chefs proporcionan nuevas experiencias gastronómicas mediante el uso de nitrógeno líquido, geles y espumas. Una de las técnicas más conocida es la esferificación mediante alginato de zumos de fruta u otros sabores. Aunque no frecuentes restaurantes con estrellas Michelin, puedes encontrarte esferas en el té de burbujas o bubble tea.
El té de burbujas se inventó en Taiwán en los años 80 y se extendió desde el lejano oriente hacia los países occidentales sólo hace unos años. Consiste en una bebida basada en el té que tiene gelatina de frutas, esferas de tapioca o alginato, rellenas de zumos de fruta o de jarabes.
La fabricación y el análisis de las esferas de alginato puede ser fascinante y utilizarse para el aprendizaje basado en la investigación en el área de ciencias.
En este artículo proponemos el uso de las esferas de alginato para enseñar varios conceptos científicos que presentaremos de manera atractiva. Vamos a aprender a hacer esferas de alginato y a proponer tres experimentos diferentes que se pueden hacer cada uno en una hora de clase: una reacción ácido base, una de quimioluminiscencia con reacciones redox y una convección con efecto termocrómico.
Esferas de alginato
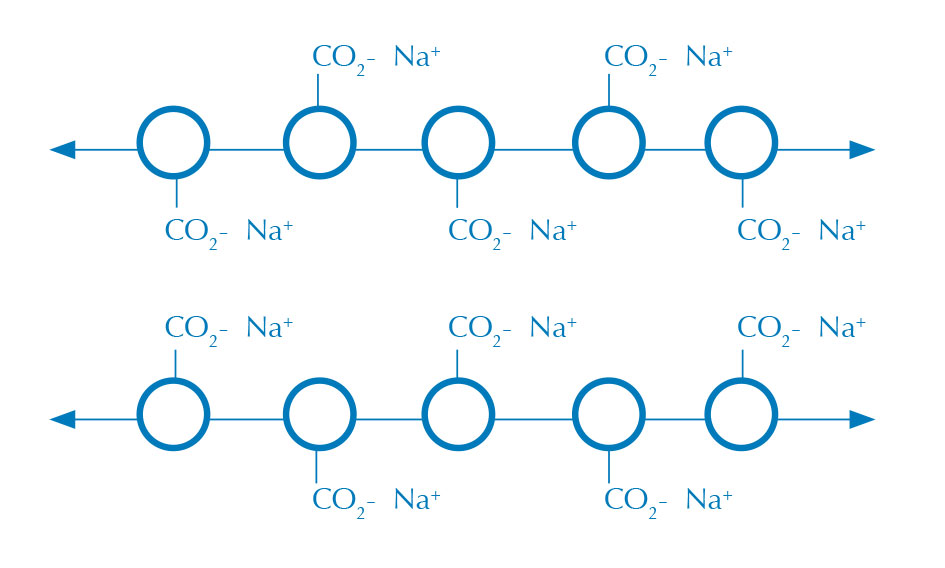
en disolución de NaCl, sin
enlaces cruzados.
Imagen cortesía de Nicola Graf
Las esferas de alginato se forma cuando una solución acuosa de alginato (figura 1) entra en contacto con una disolución con iones calcio, así se crea en la interfase entre las dos disoluciones una membrana de alginato de calcio (figura 2). El alginato es un polisacárido que crea enlaces entrecruzados en presencia de un catión divalente como el calcio, y crea un gel insoluble en agua.
Materiales
- 2 g de alginato de sodio (Na(C6H806))
- 100 ml de agua destilada
- 10 ml de cloruro de calcio (CaCl2) al 0.5% o de lactato de calcio al 1 % (Ca(C3H5O3)2
- Dos vasos de precipitados de 250 ml
- Pipeta o cucharilla
- Varilla de vidrio u otro agitador
- Colador o cuchara
Procedimiento
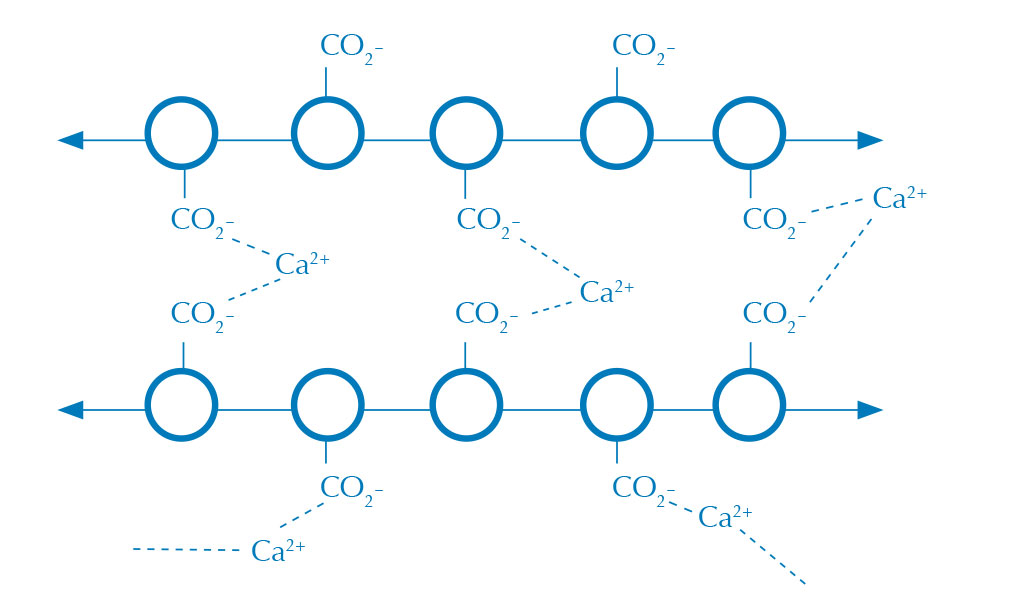
alginato en CaCl2 (enlaces
cruzados).
Imagen cortesía de Nicola Graf
- Añade el alginato al agua en uno de los vasos.
- Espera unos 15 minutos a que se disuelva todo el alginato.
- Vierte la disolución con el ión calcio en el otro vaso de precipitados.
- Añade gotas de la solución de alginato sobre la de calcio con una pipeta o una cuchara. Agita la disolución de calcio para evitar que las esferas de alginato se peguen.
- Las esferas son ahora estables y se pueden separar de la disolución de calcio con una cuchara o un colador.
Cuando los líquidos entran en contacto se forma el alginato de calcio que es gelationoso y encapsula la solución de alginato en esferas. Si añadimos otros compuestos a la disolución como saborizantes, colorantes o indicadores, también se quedarán encapsulados.
Burbujas ácido-base
Materiales
- 2 g de alginato de sodio
- 500 ml de agua destilada
- 10 ml de disolución de cloruro de calcio al 0.5% o de lactato al 1%
- Tres vasos de precipitados de 250 ml
- Pipeta o cucharilla
- Varilla de vidrio o cualquier tipo de agitador.
- Colador
- Solución indicadora
- Diferentes ácidos y bases
Procedimiento
- Sigue las indicaciones anteriores para crear las burbujas de alginato y añade el indicador justo antes de verter la solución de alginato en la de calcio.
- Retira las esferas y colócalas en un vaso de precipitados con agua destilada.
- Ninguna esfera tiene color.
- Añade ácidos o bases al agua y observa el color de las esferas.
Aunque la solución indicadora está en el interior de las esferas la membrana de alginato puede intercambiar iones hidronio (iones hidrógeno hidratados) o iones oxidrilo con el líquido. Los cambios de pH en el líquido que rodea a las esferas producidos por ácidos o bases acaban afectando al pH del interior de las esferas y por eso cambian de color.
Usamos indicadores comerciales en clase pero en casa se pueden utilizar extractos naturales que cambian de color con el pH como la col lombarda o la piel de los rábanos.
Burbujas luminiscentes
También podemos utilizar las esferas de alginato para ilustrar el fenómeno de la luminiscencia. Basta con añadir un compuesto luminiscente a la solución de alginato antes de formar las esferas. Una manera sencilla es utilizar riboflavina (vitamina B2) que muestra fluorescencia con la luz ultravioleta. Puedes usar riboflavina pura o extraerla de algunos alimentos como los sobres de natillas instantáneas.
Materiales
Extracción de la riboflavina (opcional):
- Un sobre de natillas instantáneas que contenga riboflavina (en la etiqueta, E101)
- 200 ml de agua destilada
- Vaso de precipitados
- Agitador
- Embudo con papel de filtro
Fabricación de esferas luminiscentes:
- Dos puntas de espátula de riboflavina en polvo (C17H20NaO6)
- 2 g de alginato de sodio
- 100 ml de agua
- 10 ml de disolución de cloruro de calcio al 0.5% o de lactato al 1%
- Dos vasos de precipitados de 250 ml
- Pipeta o cuchara
- Varilla de vidrio o agitador
- Colador (opcional)
- Luz UV
- 15-20 ml de disolución de ditionito de sodio (Na2S2O4)
- 15-20 ml de peróxido de hidrógeno (20%-35%)
Procedimiento
- Para extraer la riboflavina de las natillas instantáneas en polvo, coloca unos 8 g en 200 ml de agua. Agita bien durante unos 10 minutos y filtra.
- Sique el procedimiento para hacer las esferas de alginato, pero añade la riboflavina a la disolución de alginato junto antes de la esferificación.
- Ilumina con luz UV las esferas que se ha formado. Deben fluorecer emitiendo una luz verde-amarillenta.
- Apaga la luz y verás que las burbujas dejan de fluorecer.
- Vuelve a encender la luz.
- Añade algo de ditionito de sodio a la disolución de esferas de alginato. Verás que desaparece la luminiscencia porque el ditionito de sodio atraviesa la membrana de alginato y reduce a la riboflavina.
- Añade peróxido de hidrógeno para oxidar a la riboflavina y que reaparezca la luminiscencia.
Burbujas térmicas
Si añadimos tinta termocrómica a la solución de alginato podemos ilustrar el fenómeno de la convección. En Japón existe una tinta termosensible basada en cristales violetas de una lactona (no confundir con la tintas térmicas que se usan en impresoras térmicas) que sirve muy bien para ilustrar fenómenos térmicos.
Materiales
- 2 g de alginato de sodio
- 100 ml de agua destilada
- 10 ml de disolución de cloruro de calcio al 0.5% o de lactato al 1%
- Dos vasos de precipitados de 250 ml
- Pipeta o cuchara
- Varilla de vidrio o agitador
- Colador
- 3-5 ml de tinta termocrómica
- Vaso de precipitado con agua resistente al fuego
- Hornillo o estufa
Procedimiento
- Sique el procedimiento para hacer las esferas de alginato, pero añade la tinta a la disolución de alginato junto antes de la esferificación.
- Coloca las esferas en un vaso de precipitados resistente al calor.
- Calienta el vaso hasta que comiencen a ascender las esferas.
Las esferas de alginato comenzarán a moverse por efecto de la convección. Comenzarán a ascender al calentarse y disminuir así su densidad y cuando lleguen arriba y se enfríen, volverán a hundirse al aumentar su densidad. Al mismo tiempo las esferas de alginato cambiarán de color mostrando que la convección está asociada a un cambio de temperatura.
Agradecimientos
Parte de este trabajo ha sido financiado por el proyecto Teaching Enquiry with Mysteries Incorporated (TEMI) (Peleg et al., 2015), perteneciente al 7º programa marco para financiación de la investigación sobre “Ciencia en sociedad” con cargo a la partida Nº 321403.
References
- Peleg R et al. (2015) El misterio de la arena mágica. Science in School 32: 37-40.
Resources
- Para saber más sobre la gastronomía molecular ver:
- Davies E (2014) Del metional al pollo frito. Science in School 30: 44–48.
- Para saber más sobre la esferificación en la gastronomía molecular, ver: www.molecularrecipes.com/spherification-class/basic-spherification
- Un video para aprender a hacer una ‘botella’ de agua comestible de alginato: www.youtube.com/watch?v=YLjzsfgk198
- Los videos de todos estos experimentos se pueden encontrar en el canal de Youtube de TEMI www.youtube.com/channel/UC62-j3UpwF-Z5yh84umnxIQ
- En la web de Chemistry World hay un podcast sobre el alginato de sodio.
- De la web de TEMI se puede descargar una descripción en alemán sobre el aprendizaje basado en la investigación a partir de las ideas del grupo TEMI de la Universidad alemana de Bremen: www.chemiedidaktik.uni-bremen.de/temi/index.html. En breve se pondrá a disposición de los internautas una versión inglesa del Book of Science Mysteries en la web de TEMI: www.teachingmysteries.eu.
- La esferificación se puede usar en muchos experimentos. Puedes ver una actividad que utiliza esferas con algas para investigar sobre la fotosíntesis. La información en www.saps.org.uk o usando el enlace acortado http://tinyurl.com/qxwcafa
- La mayoría de los reactivos y equipamiento que necesitas para hacer estas investigaciones se pueden conseguir fácilmente en distribuidores de productos de laboratorio a colegios. Si no puedes conseguir la tinta termocrómica japonesa puedes comprar en polvo para uso acuoso en tiendas especializadas en tintes como SpecialFX & Coatings en el Reino Unido. Ver www.sfxc.co.uk
Review
Los cambios de color, posición, forma o luminosidad siempre atraen nuestra atención. Si usamos estos cambios en clase podemos contribuir a que los estudiantes disfruten más con la ciencia. Las dos primeras actividades pueden realizarse con alumnos de 15-16 años, mientras que la tercera, en la que se introduce la convección y la luminiscencia también sirven para alumnos más jóvenes, de 11 a 14 años.
Después de las actividades se puede reflexionar sobre el por qué del uso de estas burbujas y discutir sobre las propiedades físicas de la materia.
Enrico Capaccio, Istituto Superiore S Bellarmino, Montepulciano (Siena), Italia





