Neutroni e antigelo: Ricerca sui pesci artici Understand article
Tradotto da Francesca Begali e Giulia Fasoli. Matthew Blakeley dell’ ILL e i suoi colleghi del ESRF e di altri istituti hanno scoperto come l’antigelo nel sangue dei pesci artici permetta loro di sopravvivere a temperature al di sotto dello zero. Lui e Eleanor Hayes spiegano come.

(Myoxocephalus scorpius) ha
proteine antigelo.
Immagine di dominio pubblico;
fonte dell’immagine: Wikimedia
Commons
Quando pensiamo all’Artico, molti di noi pensano ad icebergs, orsi polari e foche. Temperature polari, venti gelati e desolate distese di neve – una sfida per qualsiasi animale che viva lì.

hanno indotto gli animali a
sviluppare alcuni importanti
adattamenti.
Immagine gentilmente
concessa da ucumari; fonte
dell’immagine: Flickr
Siamo a conoscenza di molti dei modi in cui gli animali artici si sono adattati al loro ambiente: la folta pelliccia degli orsi bianchi, lo spesso strato adiposo delle foche, l’attitudine migratoria di molti uccelli. Questi animali, comunque, sono tutti endotermi – mantengono la temperatura corporea costante, ben superiore a quella dell’ambiente glaciale che li circonda.
Per i pesci, la situazione è molto diversa – loro sono in gran parte ectotermi, il che significa che i loro corpi sono alla stessa temperatura dell’ambiente circostante. E i loro habitat sono davvero molto freddi: spesso l’oceano Artico raggiunge temperature di -1°C, e il suo congelamento è impedito solamente dall’alto contenuto salino dell’acqua.
Il sangue dei pesci, che è considerevolmente meno salato, dovrebbe congelare a – 0,5 °C. Per impedire questo, i pesci artici hanno sviluppato proteine antigelo specializzate (AFPs).

concessa da Rita Willaert; fonte
dell’immagine: Flickr
Le proteine antigelo hanno una funzione complessa. Per proteggere i pesci dalla morte per congelamento, devono legarsi ai nuclei dei cristalli di ghiaccio formatisi nel corpo dei pesci, per evitare che questi diventino cristalli di ghiaccio di grandi dimensioni. Tuttavia, come distinguono il ghiaccio dall’acqua liquida?
Le AFPs sono state attentamente studiate usando molte tecniche, inclusa la diffrazione a raggi x, rivelando l’esistenza di una superficie di legame specializzata per il ghiaccio.
La diffrazione a raggi x fa affidamento sul grado in cui i raggi x sono dispersi (diffratti) dalla nuvola elettronica di ogni atomo. Molte molecole hanno schemi di diffrazione caratteristici. Tuttavia, gli atomi di idrogeno (e deuterio), che hanno soltanto un elettrone, disperdono molto poco i raggi x (Figura 1a, sotto), così il segnale della rifrazione a raggi x dell’acqua (H2O) è molto simile a quello degli atomi di ossigeno (O). Come risultato, quando gli scienziati hanno provato a esaminare come il sito di legame con il ghiaccio interagisse con il ghiaccio stesso, non sono stati in grado di identificare tutte le molecole d’acqua sulla superficie.
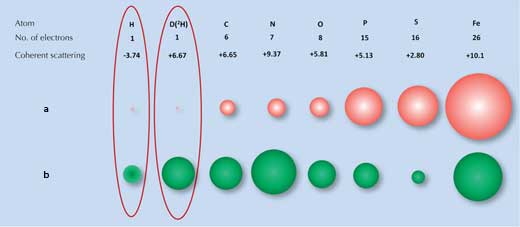
a) I raggi x sono dispersi dagli elettroni, con la forza della dispersione(grandezza delle palline rosse) proporzionale al numero di elettroni.
b) I neutroni sono dispersi dai nuclei, con la forza della dispersione(grandezza delle palline verdi) che dipende dalle specifiche forze nucleari.
Immagine gentilmente concessa da Matthew Blakeley

le proteine antigelo del pesce
artico, Zoarces americanus
Immagine gentilmente
concessa da Derek Keats; fonte
dell’immagine: Flickr
E’ questo il caso in cui un’altra tecnica, la diffrazione di neutroni, è utile. I neutroni sono dispersi dai nuclei atomici invece che dagli elettroni, e la portata dello scattering dipende dalla specifiche forze nucleari. Queste forze a loro volta non dipendono solo dagli elementi ma anche dagli isotopi degli elementi, che si differenziano per il numero di neutroni nei loro nuclei (Figura 1b, sopra). Per nostra fortuna, gli atomi di idrogeno possono essere facilmente rilevati dallo scattering del neutrone e l’isotopo deuterio dell’idrogeno ( idrogeno pesante, che ha un neutrone in più) può essere individuato ancora più affidabilmente. Così il segnale per l’acqua è significativamente diverso da quello dell’ossigeno.
Noi (Matthew Blakeley e i suoi colleghi) abbiamo deciso di studiare un tipo di AFP trovato nel sangue dei pesci artici: l’AFP tipo III. Per evitare i problemi affrontati dagli altri ricercatori, abbiamo usato una combinazione di diffrazione di raggi x e di neutroni per esaminare la struttura della proteina e la sua interazione con le molecole d’acqua. Per i nostri esperimenti, abbiamo usato le attrezzature dell’istituto Laue-Langevin (ILL)w1 e dell’ European Synchrotron Radiation Facility (ESRFw2; vedi box, sotto). La ricerca di neutroni con cristalli così piccoli è stata possibile solo grazie ai progressi nella preparazione dei campioni e nelle strumentazioni che sono avvenuti all’ILL negli ultimi anni.
Come di norma negli studi della struttura delle proteine, abbiamo inserito il gene sintetico per il tipo III dell’AFP nell’ Escherichia coli, dove è stato sovra-espresso per permetterci di avere una quantità sufficiente di proteine. I batteri sono stati nutriti con acqua pesante ( contenente deuterio invece che normali atomi di idrogeno) per assicurarsi che la proteina risultante fosse deuterata: le posizioni di tutti gli atomi di idrogeno erano occupate dal deuterio. Abbiamo poi cristallizzato la proteina in maniera da poter determinare la sua struttura, per controllare se la forma deuterata avesse la stessa struttura di quella normale. (Vedi Cornuéjols, 2009, e Blattmann & Sticher, 2009, per approfondire la cristallografia delle proteine e perfino provare tu stesso.)
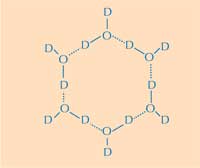
molecole d’acqua. D=
deuterio; O=ossigeno. Clicca
sull’immagine per ingrandire
Immagine gentilmente
concessa da Nicola Graf
Parte della risposta di come l’AFP di tipo III distingue il ghiaccio dall’acqua liquida risiede nel come la struttura delle proteine antigelo si differenzia da quella delle tipiche proteine, che normalmente hanno amminoacidi idrofobici al centro (lontano dalle molecole d’acqua che li circondano) e amminoacidi idrofili sulla superficie. Come è stato mostrato dalle precedenti ricerche, le AFPs sono insolite poichè hanno molti amminoacidi idrofobici sulla loro superficie, per evitare il legame della proteina con l’acqua liquida attraverso legami idrogeno. Questi amminoacidi idrofobici formano parte della superficie di legame con il ghiaccio, che lega i nuclei di ghiaccio ma non l’acqua liquida. Come funziona?
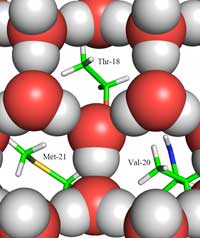
ghiaccio (rappresentato dalle
palline rosse e grigie) e il sito
di legame con il ghiaccio, che
mostra i gruppi metile dei
residui idrofobici Thr-18,
Val-20, Met-21, che
riempiono lo spazio vuoto
nella struttura del ghiaccio.
Clicca sull’immagine per
ingrandire.
Copyright © 2011 John Wiley &
Sons, Ltd; fonte dell’immagine:
Howard et al. (2011)
Qui si trova la seconda parte della risposta: come si differenzia la struttura del ghiaccio da quella dell’acqua liquida. Utilizzando la diffrazione di neutroni, riusciamo a localizzare le posizioni delle molecole d’acqua sulla superficie di legame del ghiaccio. Abbiamo identificato un raggruppamento tetraedrico delle molecole d’acqua legato alla superficie proteica che lega il ghiaccio. Questo raggruppamento tetraedrico è stato trovato nell’acqua liquida (come nel nostro esperimento) ma è anche tipico del ghiaccio; questo ci ha dato il punto di partenza per modellare il resto del cristallo di ghiaccio e dedurre come esso possa legarsi all’AFP. Il modello risultante è composto da anelli d’acqua a sei molecole, che è noto come configurazione a barca: sei molecole d’acqua disposte a esagono, lasciando uno spazio vuoto centrale (vedi Figura 2, sopra). È questo spazio vuoto che permette alleAFPs di tipo III di distinguere la struttura dei nuclei dei cristalli di ghiaccio da quella dell’acqua: le regioni idrofobiche della superficie di legame con il ghiaccio si inseriscono nello spazio vuoto, legandosi con il ghiaccio grazie alle forze di Van der Waals (Figura 3). Al contrario l’acqua liquida non ha uno spazio vuoto dove le regioni idrofobiche come i gruppi metile si possono inserire. Questo evita la presenza di una grande superficie di contatto tra l’acqua liquida e la superficie di legame con il ghiaccio, che sarebbe necessaria per una stretta interazione.

pesci senza proteine antigelo
nell’Artico?
Immagine gentilmente
concessa da dwleindecker /
iStockphoto
Nonostante altri ricercatori avessero proposto che i residui idrofobici giocassero un ruolo importante nel riconoscimento dei nuclei dei cristalli di ghiaccio da parte dell’AFP di tipo III, questo è il primo esperimento che lo conferma.
Studiare come i pesci artici sopravvivano nel loro ambiente è di per sé interessante, ma questa ricerca ha anche potenziali applicazioni industriali. Il tipo III delle AFPs è già incorporato in alcuni gelati per minimizzare la formazione di grandi cristalli di ghiaccio e migliorare così la consistenza. In futuro, i geni che codificano per le proteine antigelo potranno essere inseriti nelle piante per permettere loro di crescere in ambienti con temperature al di sotto dello 0.
Maggiori informazioni riguardo l’ILL e l’ESRF

L’istituto Laue-Langevin (ILL)w1 è un centro internazionale all’avanguardia nella ricerca e nella tecnologia sui neutroni. Essa ha messo in funzione una delle più intense fonti al mondo di neutroni, che alimenta fasci di neutroni verso un gruppo di 40 strumenti di alto livello che sono costantemente perfezionati.
Come un centro servizi, l’ILL mette a disposizione degli scienziati le sue attrezzature e i suoi esperti. Ogni anno, circa 1200 ricercatori da più di 30 paesi visitano l’ILL a Grenoble, in Francia. Ogni anno vengono eseguiti più di 800 esperimenti, concentrati principalmente sulla scienza pura in una grande varietà di campi: fisica della materia condensata, chimica, biologia, fisica nucleare e scienza dei materiali.
L’ European Synchrotron Radiation Facility (ESRF)w2 è un centro internazionale di ricerca che condivide la sede di Grenoble, Francia, con l’ILL. Produce fasci di raggi x di elevata intensità, che sono utilizzati da migliaia di scienziati di tutto il mondo ogni anno.
La complementarietà tra il sincrotrone a fasci di raggi x e fasci di neutroni può aiutarci a comprendere come lavorano i sistemi complessi, come le AFP descritte in questo articolo. Per ottenere il massimo profitto dalla sinergia tra scienze del sincrotrone e dei neutroni, ESRF e ILL sono stati protagonisti nella creazione della Partnership for Structural Biology (PSB) e della Partnership for Soft-Condensed Matter; ulteriori collaborazioni sono previste nell’immediato futuro.
ILL e ESRF sono membri dell’EIROforumw3, l’editore di Science in School.
References
- Blattmann B, Sticher P (2009) Growing crystals from protein. Science in School 11: 30-36.
- Cornuéjols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76.
- Howard EI, Blakeley MP et al. (2011) Neutron structure of type-III antifreeze protein allows the reconstruction of AFP–ice interface. Journal of Molecular Recognition 24: 724-732. doi: 10.1002/jmr.1130
Web References
- w1 – Per sapere di più sull’ ILL, vedi: www.ill.eu
- w2 – Per trovare maggiori informazioni su ESRF e PSB, vedi www.esrf.eu e www.psb-grenoble.eu
- w3 – Per ulteriori informazioni sull’ EIROforum, vedi: www.eiroforum.org
Institutions
Review
Se ti sei mai chiesto come i pesci possono sopravvivere negli oceani glaciali, puoi trovare la risposta in questo articolo veramente interessante che conduce il lettore attraverso un’investigazione scientifica sulla struttura delle proteine e sulle loro interazioni.
L’articolo può essere visto come lettura di riferimento durante lo studio delle biomolecole o come base per una discussione sul ruolo delle proteine negli organismi viventi. Sono incluse idonee domande di comprensione:
- Descrivi come i pesci artici si sono adattati alla gelida acqua dell’Artico.
- Come agiscono le proteine AFP come antigelo nel sangue dei pesci?
- Quali sono i limiti della diffrazione a raggi x nell’analizzare le AFPs?
- In che cosa differisce la diffrazione a neutroni dalla diffrazione a raggi x?
- Descrivi i passaggi coinvolti nello studio portato a termine con successo sulla struttura delle proteine AFP.
- In cosa le proteine AFP differiscono dalle altre proteine?
- In che modo le proteine AFP distinguono il ghiaccio dalle molecole di acqua liquida?
Angela Charles, Malta





