Supporting materials
Download
Download this article as a PDF

In che modo le droghe sociali influenzano il metabolismo? Come viene misurata la tossicità? In che modo il cambiamento climatico influenza gli ecosistemi acquatici? Stimoliamo l'apprendimento attivo rispondendo a queste domande utilizzando la Dafnia.
La Dafnia, una specie fondamentale di microcrostaceo d’acqua dolce, è un organismo modello con diversi vantaggi pratici: la semplicità di allevamento in laboratorio, le dimensioni corporee piccole (2-5 mm), un ciclo vitale breve, la semplicità nel manipolarle, un’elevata fecondità, la riproduzione partenogenetica e costi bassi di mantenimento.[1,2] Grazie al loro esoscheletro traslucente, è possibile osservare gli organi interni della Dafnia al microscopio o con lenti di ingrandimento binoculari.[3] Essendo animali molto sensibili e avendo risposte biologiche fondamentali molto simili a quelle dell’uomo, vengono utilizzate come modelli per testare gli effetti di varie droghe sociali, come il caffè, il tabacco e l’alcol, e per valutare la qualità dell’acqua.[2] Gli ecosistemi di acqua dolce, che sono tra i più minacciati al mondo, forniscono acqua potabile e per l’irrigazione, nutrimento, regolano il clima, prevengono l’erosione e offrono attività ricreative per l’uomo. Il cambiamento climatico sta aumentando la concentrazione di sale nelle acque dolci, con effetti drastici sulla salute e sulla sopravvivenza degli organismi di acqua dolce.
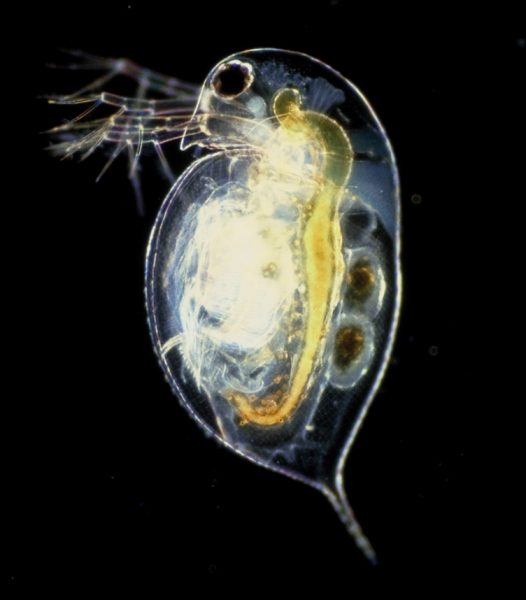
Le attività pratiche descritte in questo articolo sono adatte a studenti tra i 14 e i 19 anni e rappresentano un metodo valido per valutare gli effetti delle droghe sociali sul sistema cardiovascolare e dell’influenza della salinizzazione sulla sopravvivenza della Dafnia. Studiando questi effetti, gli studenti imparano a registrare e a gestire i dati sperimentali per trarre le proprie conclusioni. Partendo dalle conclusioni gli studenti possono dedurre le implicazioni per la salute dell’uomo e capire gli effetti del cambiamento climatico sugli ecosistemi di acqua dolce.
Si possono mantenere le colture in contenitori con al massimo 30 Dafnie per litro in acqua priva di cloro con un pH di 7-8, a 18-25°C, con un fotoperiodo controllato di 16 ore e nutrite 2-3 volte a settimana con microalghe o lievito (5 gocce/litro). Bassi livelli di ossigeno disciolto risultano essere letali.
Per preparare una sospensione di lievito (fungo unicellulare), aggiungere acqua priva di cloro in un contenitore da 1 litro e mescolare con 2 grammi di lievito da panettiere. Conservare la sospensione in frigorifero (4°C) e agitare sempre prima dell’uso per risospendere il lievito. Aggiungere 5 gocce/litro di questo cibo alle colture di Dafnia 2-3 volte alla settimana.
Le microalghe sono organismi microscopici fotosintetici. Giocano un ruolo centrale nella vita sulla Terra, in quanto costituiscono la base della catena alimentare in molti ecosistemi acquatici. La Scenedesmus è una microalga verde fissile, tipica del fitoplancton d’acqua dolce, facile da coltivare e mantenere in laboratorio, utilizzata abitualmente come cibo per la Dafnia.
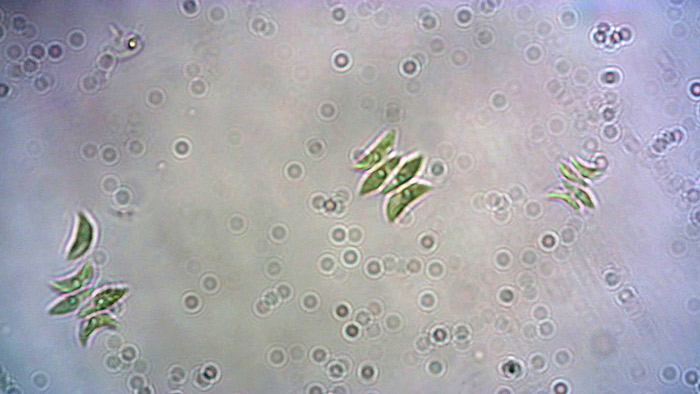
Le colture di Scenedesmus hanno bisogno di acqua priva di cloro con un pH di 7-8, una temperatura minima di 16°C (da 18 a 25°C), con un fotoperiodo minimo di 12 ore garantito da una luce LED (o fluorescente) per acquari. La coltura di microalghe deve essere tenuta in un contenitore aerato (bioreattore) per garantire la CO2 necessaria per la fotosintesi e prevenire la sedimentazione di microalghe sul fondo del recipiente, che limita fortemente la loro riproduzione. Ogni 15 giorni, la coltura deve essere integrata con sali minerali, nella quantità di 3-5 gocce/litro, di un fertilizzante liquido commerciale per piante.

Il consumo di droghe sociali provoca modifiche nel sistema nervoso centrale con conseguenti cambiamenti fisiologici e/o comportamentali. Le droghe stimolanti (caffeina, nicotina) aumentano il metabolismo corporeo, mentre quelle depressive (alcol) lo diminuiscono. La frequenza cardiaca può essere utilizzata come un ottimo indicatore di questi cambiamenti.
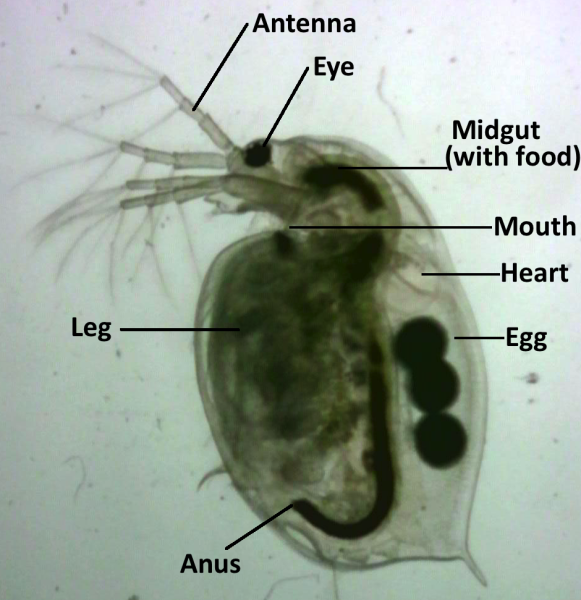
L’osservazione dell’effetto dei farmaci su un organismo vivente in tempo reale permette agli studenti di stabilire una relazione con i possibili effetti dei farmaci nel loro corpo. Il corpo trasparente della Dafnia permette la misura di diversi parametri fisiologici utilizzando metodiche ottiche non invasive. Un biotest è una procedura che utilizza gli organismi viventi per determinare gli effetti di una sostanza chimica. L’attività richiede circa 2 ore per essere completata, ma può essere eseguita in 1 ora se le soluzioni vengono preparate in anticipo.

Sul foglio di lavoro fornito (vedere la tabella di esempio) gli studenti cercano di prevedere gli effetti delle droghe sociali sulla frequenza cardiaca della Dafnia. Prima di cominciare il lavoro sperimentale, guardare il video per imparare a trovare il cuore della Dafnia e come contare i battiti cardiaci.
Attenzione: se viene usato cotone in eccesso, può essere difficile osservare il cuore della Dafnia.
| Previsione (secondo la chiave di lettura sotto riportata) | Frequenza cardiaca controllo (bpm) | Frequenza cardiaca sperimentale (bpm) | |
| Tabacco | |||
| Alcol (6%) | |||
| Alcol (12%) | |||
| Alcol (20%) | |||
| Caffè |
Chiave di lettura::
| +++ | grande aumento della frequenza cardiaca |
| ++ | aumento della frequenza cardiaca |
| + | lieve aumento della frequenza cardiaca |
| 0 | nessuna variazione della frequenza cardiaca |
| – | lieve diminuzione della frequenza cardiaca |
| — | diminuzione della frequenza cardiaca |
| — | grande diminuzione della frequenza cardiaca |
| x | arresto cardiaco |
I conteggi di controllo sotto i 200 battiti al minuto (bpm) o sopra i 300 bpm devono essere ripetuti.
Bisogna prestare attenzione affinché le soluzioni sperimentali non vengano in contatto con la pelle, gli occhi o la bocca degli studenti,
Alla fine dell’attività, gli studenti devono lavarsi le mani.
Il corpo trasparente della Dafnia permette l’osservazione diretta degli organi interni e le misurazioni di caratteristiche fisiologiche, come la frequenza cardiaca. Possono essere usate come sistema modello per studi tossicologici perché sono altamente sensibili a variazioni ambientali e mostrano risposte fisiologiche rapide quando esposte a contaminanti dell’acqua.[5]
E’ dimostrato che l’uso di animali viventi, come parte di esperimenti di ricerca, aumenta la comprensione dei concetti scientifici. Dopo l’esperimento, ponete agli studenti le seguenti domande per favorire la comprensione dell’influenza delle droghe sociali sul sistema nervoso utilizzando la Dafnia come organismo modello:
Qual è lo scopo di avere alcune Dafnie solo in acqua?
Perché si usa la media di tre conteggi dei battiti cardiaci?
Perché si usa una Dafnia nuova per ogni soluzione sperimentale (droga sociale) testata?
Qual è il vantaggio/importanza di usare i cloni?
Confrontare le previsioni con i dati sperimentali.
Discutere come la Dafnia sia un modello biologico adatto per lo studio di molteplici fattori di stress.
La salinizzazione degli ambienti d’acqua dolce è un problema sempre più diffuso a causa delle attività dell’uomo, come l’irrigazione, l’estrazione di risorse, l’accelerazione dell’erosione delle rocce per le piogge acide, l’uso di fertilizzanti in agricoltura e di sali stradali, l’estrazione mineraria e l’edilizia urbana. Il problema è ulteriormente aggravato dal cambiamento climatico dovuto alla riduzione delle precipitazioni, all’aumento dell’evaporazione e alla maggiore necessità per l’irrigazione.[6,7] L’utilizzo di indagini di tipo biologico può aiutare gli studenti a comprendere gli effetti della salinizzazione sulla sopravvivenza della Dafnia, favorendo così un collegamento concettuale tra la sopravvivenza di organismi semplici e gli effetti sugli ecosistemi d’acqua dolce. Questi organismi necessitano di mantenere un equilibrio osmotico tra la concentrazione di ioni all’interno delle proprie cellule e dei propri fluidi corporei, e questo è fortemente influenzato dalla salinità dell’acqua che li circonda.
In questa attività gli studenti determinano la tossicità di NaCl per la Dafnia calcolando il valore della LC50 (concentrazione letale al 50%), definita come la concentrazione tossica che uccide il 50% degli organismi esposti. Questo esperimento dovrebbe durare circa 20 minuti.[1]

Nel controllo, la mortalità non può essere maggiore del 10%.
| NaCl (%) | Numero di Dafnie morte prima | % della mortalità (dopo 20 minuti) | Osservazioni sul comportamento della Dafnia | ||
| 5 min | 10 min | 20 min | |||
| 0 | |||||
| 0.5 | |||||
| 1 | |||||
| 1.5 | |||||
| 2 | |||||
Non usare detergenti per pulire il materiale di vetro. I residui di detergente possono essere tossici per la Dafnia.
Dopo l’esperimento discutere i risultati e favorire la comprensione dell’influenza del cambiamento climatico sul comportamento e sulla sopravvivenza delle Dafnia e di altri organismi acquatici.[8,9] Tra le domande potrebbero esserci anche le seguenti:
Questa attività potrebbe essere anche il punto di partenza per la discussione sull’etica dell’utilizzo di animali vivi nella ricerca. L’uso di organismi molto semplici come la Dafnia è abbastanza incontestabile, ma dove si dovrebbe porre il limite? Maggiori informazioni sul perché l’utilizzo degli animali nella ricerca può essere importante e su come possa essere ridotto al minimo sono disponibili in questo articolo.
[1] Cahill K (2006) Bioassay investigations with Daphnia. My Environment, My Health, My Choices. University of Rochester.
[2] OECD (2004) Test No. 202: Daphnia sp. Acute Immobilisation Test, OECD Guidelines for the Testing of Chemicals, Section 2. OECD Publishing, Paris. doi: doi.org/10.1787/9789264069947-en
[3] Tkaczyk A et al. (2021) Daphnia magna model in the toxicity assessment of pharmaceuticals: a review. Science of the Total Environment 763: 143038. doi: 10.1016/j.scitotenv.2020.143038
[4] Gewin V (2005) Functional Genomics Thickens the Biological Plot. PLOS Biology 3: e219. doi:10.1371/journal.pbio.0030219
[5] Gleichsner AM, Butler SR, Searle CL (2019) Dynamic Daphnia: an inquiry-based research experience in ecology that teaches the scientific process to first-year biologists. CourseSource. doi: 10.24918/cs.2019.2
[6] Kaushal SS et al. (2021) Freshwater salinization syndrome: from emerging global problem to managing risks. Biogeochemistry 154: 255–292. doi: 10.1007/s10533-021-00784-w
[7] Jeppesen E et al. (2020) Salinization increase due to climate change will have substantial negative effects on inland waters: a call for multifaceted research at the local and global scale. The Innovation 1: 100030. doi: 10.1016/j.xinn.2020.100030
[8] Martinez D et al. (2022) Daphnia magna and mixture toxicity with nanomaterials – current status and perspectives in data-driven risk prediction. nanotoday 43: 101430. doi: 10.1016/j.nantod.2022.101430
[9] Müller M et al. (2018) Temperature-driven response reversibility and short-term quasi-acclimation of Daphnia magna. PLOS ONE 13: e0209705. doi: 10.1371/journal.pone.0209705
Download this article as a PDF