Combattere l’HIV con I neutroni Understand article
Tradotto da Monica Menesini. Quando pensiamo agli studi sulla diffrazione, spesso vengono in mente I raggi X, ma anche i neutroni possono fornire informazioni strutturali importanti – e possono aiutare nella lotta contro l’HIV.
Quando si pensa alla cristallografia, la tecnica che più spesso viene in mente è la diffrazione a raggi X. Non c’è da meravigliarsi: in biologia più di 88.000 strutture di proteine, acidi nucleici, virus e macromolecole sono state determinate grazie ai raggi X. Anche la cristallografia neutroni ca- tecnica che si sta rapidamente sviluppando – sta diventando molto utile per disegnare nuovi farmaci. I ricercatori dell’Istituto Laue-Langevin di Grenoble (Francia) hanno utilizzato le loro apparecchiature per determinare le interazioni tra un farmaco antiretrovirale e il virus HIV.

Per gentile concessione di ILL
Da quando la cristallografia delle proteine usando i raggi X è nata, circa 100 anni fa, il suo sviluppo è stato molto rapido e diffuso. I fasci di raggi X ad alta intensità prodotti dai sincrotroni vengono usati routinariamente e permettono di raccogliere dati in tempi brevissimi – qualche secondo – usando piccoli cristalli di pochi micrometri (vedere Cornuejols, 2009).
Invece la tecnologia che usa i neutroni per determinare la struttura di grosse molecole biologiche si è sviluppata molto meno, e la sua applicazione è decisamente meno diffusa. Il motivo principale è che il numero di particelle per centimetro quadrato per secondo (il flusso) prodotto dalle sorgenti di neutroni più intense è vari ordini di grandezza inferiore a quello prodotto da una sorgente di raggi X.
Finora quindi i cristallografi che usavano i neutroni avevano bisogno di cristalli di grandi dimensioni, e ci volevano mesi per ottenere un sufficiente numero di dati. Tuttavia oggi i miglioramenti tecnologici consentono di ottenere dati sufficienti in pochi giorni usando cristalli molto più piccoli. Perché usare i neutroni però se comunque i tempi sono molto più lunghi se comparati alla cristallografia a raggi X? Uno dei motivi è l’atomo più piccolo dell’Universo: l’idrogeno.
L’importanza dell’idrogeno
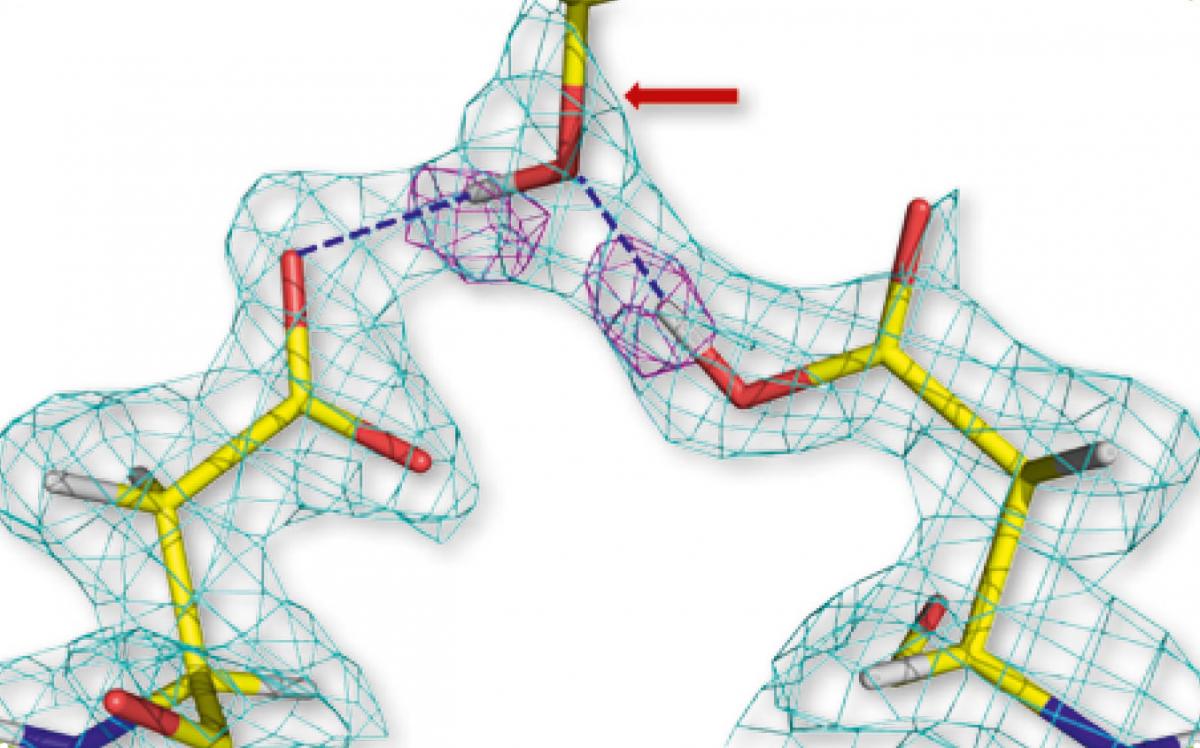
aspartico di due molecole di
proteasi HIV (sinistra e
destra) legati al gruppo
ossidrilico del farmaco
aprenavir (al centro). Le fore
geometriche rosa
rappresentano gli atomi di
idrogeno.
Per gentile concessione di
Andrey Kovalevsky
La maggior parte dei farmaci lavora legandosi ad un enzima coinvolto in una certa malattia e inibendo la sua funzione. Il design di molti farmaci moderni si basa quindi sull’analisi e l’ottimizzazione delle reazioni tra il farmaco e il suo bersaglio. La cristallografia a raggi X – il metodo fino ad oggi favorito – consente di determinare i dettagli strutturali, ma non riesce a rilevare la posizione degli atomi di idrogeno nella molecola. Questi in genere giocano un ruolo determinante nelle interazioni perché possono formare legami a idrogeno, che sono deboli ma molto importanti.
Invece i neutroni possono localizzare la posizione di tutti gli atomi, compresi quelli di idrogeno, e quindi forniscono uno strumento d’indagine potente per analizzare le interazioni con il farmaco, come ha dimostrato un recente studio sull’interazione tra un farmaco antiretrovirale (amprenavir) e il suo enzima bersaglio (proteasi HIV-1). Quest’ultimo è un enzima chiave per il ciclo vitale del virus HIV: taglia i polipeptidi virali producendo le proteine necessarie per la maturazione e la produzione di nuove particelle virali.
I ricercatori hanno diretto il fascio di neutroni verso un piccolo cristallo (dimensioni 0.2 mm3) di proteasi legato all’amprenavir ottenendo una risoluzione di appena 0,2 nanometri. I dati raccolti hanno consentito ai ricercatori di localizzare gli atomi di idrogeno del complesso enzima-farmaco e di identificare quelli coinvolti nei legai a idrogeno tra enzima e farmaco.
Miglior risoluzione
Usando studi precedenti condotti con i raggi X i ricercatori avevano ipotizzato che i legami a idrogeno determinanti per il legame tra proteasi HIV-1 e amprenavir fossero numerosi. Invece lo studio con i neutroni ha rivelato che sono presenti solo due forti legami a idrogeno tra enzima e farmaco (figura 1). Questa scoperta indica ai designer del farmaco nuovi modi di rendere i legami ancora più forti modificando leggermente la struttura del farmaco. E’ sperabile che queste modifiche aumentino l’efficacia del farmaco e rendano possibile una diminuzione del dosaggio.
Per esempio i designer potrebbero rendere i due legami a idrogeno ancora più forti aggiungendo un atomo reattivo come il fluoro alla molecola del farmaco. In alternativa, potrebbero introdurre più legami a idrogeno ad esempio incorporando gruppi atomici di grandi dimensioni che potrebbero espellere le molecole d’acqua che normalmente si trovano nel sito di legame.
La particolare sensibilità dell’analisi con i neutroni nei confronti degli atomi di idrogeno fornisce all’industria farmaceutica un importante strumento per il design dei farmaci su base strutturale. Sebbene la rilevanza della cristallografia a raggi X continuerà sicuramente ad essere notevole per la sua alta risoluzione, usando sia i raggi X, sia i neutroni sarà possibile comprendere più chiaramente l’interazione tra il farmaco e il suo bersaglio, e questo certamente promette di migliorate l’efficacia di nuovi futuri farmaci.
Diffrazione neutronica
Quando un cristallo viene posto lungo il cammino di un fascio di raggi X, questi interagiscono con le nuvole elettroniche degli atomi del cristallo e vengono diffratti in specifiche direzioni. Misurando gli angoli e le intensità prodotte è possibile produrre un’immagine tridimensionale della densità elettronica del cristallo, dalla quale si possono ricavare le posizioni medie degli atomi.
La diffrazione dei neutroni è concettualmente molto simile, con la differenza che i neutroni sono diffratti dai nuclei atomici del cristallo anziché dalle nuvole di elettroni localizzati attorno ad essi. L’intensità della diffrazione per atomi di diverso tipo non dipende quindi dalla configurazione elettronica ma dalle forze nucleari, che possono essere diverse anche tra diversi isotopi dello stesso elemento.
A causa delle loro piccole nuvole elettroniche, l’idrogeno e il deuterio non hanno molto effetto sui raggi X ma per quanto riguarda la diffrazione neutronica il loro effetto è paragonabile a quello degli altri elementi presenti nelle macromolecole biologiche: carbonio, azoto, ossigeno e zolfo. Quindi idrogeno e deuterio non sono rilevabili usando i raggi X ma diventano visibili usando un fascio di neutroni.
La visibilità dell’idrogeno e del deuterio permette di determinare la loro posizione con una risoluzione di circa 1.5 e 2.5 Å (1.5 x 10-10 m e 2.5 x 10-10 m), rispettivamente. Un atomo di idrogeno ha un diametro di circa 1 Å. La cristallografia neutronica risulta quindi particolarmente utile per quegli studi nei quali è importante la conoscenza della posizione dell’atomo di idrogeno, come lo studio dei meccanismi enzimatici o delle interazioni con i farmaci, che possono fornire indicazioni per guidare il design di questi ultimi.
Informazioni su ILL
L’Istituto Laue-Langevin (ILL) w1 è un istituto di ricerca con base a Grenoble, Francia. Da 40 anni è leader della ricerca scientifica e tecnologica riguardante la diffrazione neutronica; i primi esperimenti iniziarono nel 1972. ILL opera utilizzando una delle più intense fonti di neutroni del mondo che alimenta 40 strumenti altamente performanti che sono continuamente aggiornati. Ogni anno 1200 ricercatori provenienti da più di 40 paesi visitano ILL per condurre ricerche nel campo della fisica degli stati condensati, della chimica, della biologia, della fisica nucleare e della scienza dei materiali.
ILL è un membro di EIROforumw2, l’editore di Science in School. Qui è possibile consultare l’elenco degli articoli pubblicati su Science in School e riguardanti ILL.
References
- Cornuejols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70–76.
Web References
- w1 – Ulteriori informazioni su ILL
- w2 – EIRO forum è una collaborazione tra otto delle maggiori organizzazioni Europee di ricerca inter-governamentali, che mettono in comune le loro strutture, risorse ed esperienze per sostenere la scienza europea nell’espressione del suo massimo potenziale. EIROforum pubblica Science in School nell’ambito delle sue attività educative e divulgative.
Resources
- La diffrazione neutronica ha anche aiutato i ricercatori nell’analisi di come l’antigelo presente nel sangue del pesce artico contribuisce alla sua sopravvivenza a temperature sotto lo zero. Per saperne di più:
- Blakely M, Hayes E (2011) Neutroni e antigelo: Ricerca sui pesci artici. Science in School 20.
Institutions
Review
Questo interessante articolo mostra come gli avanzamenti in diverse branche della scienza, in questo caso la diffrazione neutronica, possano essere utilizzati nello sviluppo di nuovi farmaci per il miglioramento della salute umana.
L’articolo può essere utilizzato dai docenti per propria informazione e si presta a supportare l’insegnamento delle scienze con esempi tratti dalla realtà. Può anche essere usato in attività di comprensione o discussione specialmente con gli studenti più grandi. Il tipo di domande dipende dagli aspetti sui quali l’insegnante vuole focalizzare l’attenzione. Un esempio di domanda potrebbe essere qual è il vantaggio di usare i neutroni anziché i raggi X?
Paul Xuereb, Malta





