Guardando il bozzolo Understand article
Traduzione di Luigi Sedda. A Grenoble, in Francia, presso il Laboratorio Europeo di Biologia Molecolare (European Molecular Biology Laboratory) il gruppo di ricerca di Winfried Weissenhorn ha scoperto un metodo per bloccare numerosi e pericolosi virus, basato sull'imprigionamento nei…
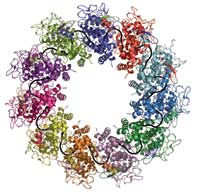
colori) avvolgono una molecola
di RNA (in nero) per formare
un complesso
Immagine cortesemente messa a
disposizione dal Winfried Weissenhorn
È una delle malattie più temute al mondo. Una volta che appaiono i classici sintomi quali confusione, idrofobia, paralisi ed emissione di bava, si è destinati alla morte. Solo cinque persone sono sopravvissute, quattro delle quali con danni neurologici permanenti. Purtroppo non esista ancora una cura, ma le vaccinazioni e i trattamenti preventivi successivi ad un eventuale contatto hanno permesso di ridurne drasticamente i casi in Europa e nel Nord America. La rabbia, resta tuttora una seria minaccia in molte nazioni in via di sviluppo, uccidendo ogni anno più di 70,000 persone.
La rabbia e altre simili malattie virali potrebbero riemergere anche nelle nazioni sviluppate, attraverso il contatto tra le persone e animali (es. pipistrelli). In questo contesto la scoperta di Winfried Weissenhorn, Rob Ruigrok e colleghi non poteva essere più opportuna. Il gruppo di ricerca nasce da una collaborazione tra il Laboratorio Europeo di Biologia Molecolare e l’Unità per l’Interazione Virus e Cellula Ospite (Unit for Virus Host Cell Interactions – UVHCI), con sedi a Grenoble, in Francia. Hanno scoperto la struttura delle proteine che avvolgono il materiale genetico del virus, proteggendolo dal sistema immunitario fino alla sua replicazione. In studio ci sono delle sostanze chimiche che siano in grado di controllare questa struttura protettiva e impedire al virus di replicarsi.
Le implicazioni non riguardano soltanto la rabbia, ma bensì molti altri virus patogeni come l’Ebola, il Borna (causa di meningiti), il morbillo e la rosolia, che presentano una struttura proteica protettiva simile a quella della rabbia. I risultati potranno, inoltre, chiarificare l’origine e lo sviluppo di questi virus. Il virus della rabbia, così come molti altri virus, è formato da una singolo filamento di RNA, una molecola simile al DNA, la fonte dei nostri geni. Ma rispetto al DNA, l’RNA virale non può essere direttamente utilizzato dal virus per costruire le proteine indispensabili per la sua moltiplicazione, infatti è la copia complementare della sequenza chimica di cui ha bisogno (RNA negativo). Affinché il virus possa produrre le proteine dello strato che protegge il suo genoma, e replicarsi, l’RNA deve essere convertito dalla forma “negativa” a quella “positiva” e successivamente tradotto in proteine.

Immagine cortesemente messa a
disposizione dal EMBL Photolab
Winfried Weissenhorn
Image courtesy of EMBL Photolab
Per i virus questo processo presenta molti rischi. Le cellule dei mammiferi, e quindi anche dell’uomo, contengono un sistema di difesa capace di identificare e distruggere RNA estranei. Per proteggersi il virus compatta il suo vulnerabile genoma internamente ad un nucleo-capside, un guscio composto da proteine, le nucleo-proteine, che permette al virus di penetrare nelle cellule e sottometterle alla costruzione di proteine virali. Oltre alla protezione del genoma, le nucleo-proteine permettono il controllo del processo di replicazione e la produzione delle proteine necessarie per la stessa replicazione, infatti, i due processi non possono avvenire simultaneamente. Il nucleo-capside, quindi, assume un ruolo determinante nella vita del virus.
Fino ad ora, le sole informazioni riguardo all’azione delle nucleo-proteine provenivano da complesse immagini prodotte da microscopi ad elettroni, in grado di mostrare come le nucleo-proteine attuassero la polimerasi per la produzione del nucleo-capside, ma non di definire la loro struttura. Questo compito è stato svolto da Rob Ruigrok dell’UVHCI e da Winfried Weissenhorn, che hanno sintetizzato cristalli di nucleo-proteine su cui successivamente è stata studiata la struttura grazie ai raggi X ad alta intensità prodotti dall’European Synchrotron Radiation Facility, a Grenoble. I cristalli sono dei composti chimici simmetrici che se esposti a raggi X, ne diffrangono la radiazione secondo specifiche ordinate geometrie che permettono agli scienziati di dedurre la forma delle molecole. La conoscenza della struttura delle nucleo-proteine consentirà l’elaborazione di medicine in grado di imprigionare il genoma virale all’interno del proprio bozzolo.
Il progetto è nato nel laboratorio di Rob, dove già dagli anni novanta si lavora sulle nucleo-proteine di un certo numero di RNA negativo virale. Il virus della rabbia era al momento quello più facile su cui lavorare e Aurélie Albertini, una dottoranda del laboratorio, ne è riuscita a riprodurre le nucleo-proteine su cellule di insetto coltivate in substrato culturale. Le proteine si sono avvolte attorno alle molecole di RNA della cellula ospite formando degli anelli di 9-13 proteine. Il gruppo di Rob Ruigrok ha subito capito che il comportamento di queste proteine era del tutto paragonabile a quello del nucleo-capside, e ne ha trovato conferma attraverso l’utilizzo di microscopi ad elettroni, strumento divenuto accurato per lo studio delle nucleo-proteine presenti attorno all’RNA virale.
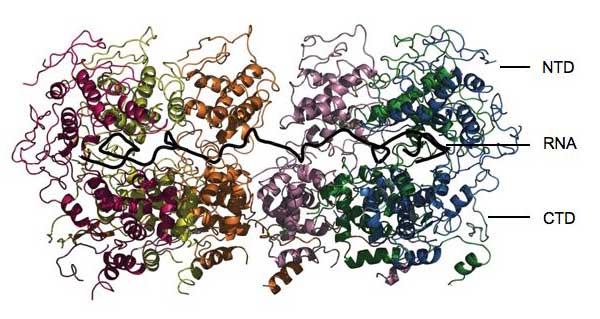
Immagine cortesemente messa a disposizione dal Winfried Weissenhorn
Aurélie lavora sulla produzione di cristalli di RNA-nucleo-proteine, un progetto per il quale fu affiancata da Amy Wernimont, una dottoranda del laboratorio di Winfried. Il lavoro con le molecole non è stato facile, e dopo un lungo periodo, le due dottorande sono riuscite a determinare la struttura proteica ad una risoluzione di 4 Ångströms, risoluzione adatta per distinguere la conformazione spaziale ma non abbastanza per visualizzare la sequenza degli aminoacidi, gli elementi di base delle proteine. Il principale problema della ricerca era la bassa produzione di nucleo-proteine da parte delle cellule.
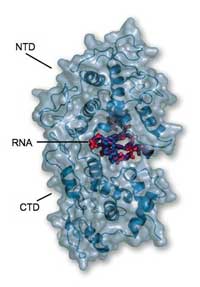
rappresentata in questo modello
evidenzia come l’RNA sia
compresso tra l’NTD (sopra) e il
CTD (sotto) e sia in pratica
inaccessibile alla degradazione
dovuta agli enzimi o alle
polimerasi della cellula ospite
Immagine cortesemente messa a
disposizione dal Winfried Weissenhorn
Grazie agli strumenti per massive cristallizzazioni messi a disposizione da Josan Márquez si è potuto risolvere il problema usando solo piccole quantità di proteine. “La cristallizzazione robotica è stata assolutamente fantastica” dichiara Winfried. “Se avessimo avuto bisogno di grandi quantità, non saremmo mai riusciti a realizzare le condizioni ottimali”. Il gruppo di ricerca alla fine ha trovato le condizioni ottimali, ovvero la precisa concentrazione delle proteine e le proporzioni di reagenti necessari per la cristallizzazione e il raggiungimento di una risoluzione pari a 3.5 Ångström, attraverso la quale è possibile costruire un dettagliato modello della struttura molecolare. A questo lavoro ha contribuito pure Raimond Ravelli per la raccolta dati, l’ottimizzazione del tempo di esposizione ai raggi X, e in generale per il supporto alle varie fasi della ricerca.
I risultati rivelano che le nucleo-proteine avvolgono completamente l’RNA, come i gioielli in una volta di una banca. “Nessun enzima può attaccarlo”, rivela Winfried. La proteina è formata da due parti, o domini, Una di queste viene chiamata CTD, che sta da un lato dell’RNA e si lega agli altri CTD in modo da creare un bozzolo elicoidale. L’altro dominio, l’NTD, sta nell’altro lato dell’RNA e non crea nessun contatto con le altre nucleo-proteine. L’intera struttura è addossata all’RNA mantenendo tutto il resto al di fuori di essa. “Le nucleo-proteine nascondono l’RNA dal sistema immunitario della cellula” dichiara Winfried. “Ma come diviene accessibile per la replicazione e la traduzione?”
La risposta si trova in due strutture filari vaganti che sporgono dalle loro regioni. Queste si comportano come cardini, e permettono all’area dell’NTD di oscillare, e alle nucleo-proteine di curvarsi in modo da creare delle piccole aperture, attraverso le quali gli enzimi virali possono accedere a piccole porzioni del genoma. In particolare, la proteina chiamata fosfoproteina P è in grado di connettere l’RNA polimerasi, l’enzima necessario per copiare il genoma, con le nucleo-proteine, attraverso una delle strutture a cardini.
La lotta ai virus, come quello della rabbia, può essere attuata attraverso composti che interferiscano con il meccanismo dei cardini. “Se i cardini sono responsabili delle aperture che si creano, possiamo agire su di essi affinché non formino le piccole aperture necessarie per la replicazione virale,” dice Winfried. “In questo modo il genoma del virus perderà forza e potrà essere eliminato dalla stessa cellula. Il passo successivo sarà la creazione di medicinali in grado di riconoscere i virus e rinchiuderli all’interno del loro nucleo-capside.
Winfried, inoltre, afferma che i risultati ottenuti hanno permesso di conoscere in maniera più approfondita come l’RNA negativo dei virus possa evolversi. Questo è un tema abbastanza complesso a causa della grande variabilità tra i genomi virali che non permette di definire un unica linea evolutiva. Dall’altra parte, le strutture derivano da particolari sequenze di geni e aminoacidi. Quindi anche se i geni evolvono o cambiano radicalmente, le strutture che essi possono produrre permettono di definire le affinità evolutiva tra i singoli virus.
Le foto al microscopio elettronico delle molecole di RNA negativo di altri virus, come il virus del morbillo, il Margburg virus (causa della febbre emorragica) e una struttura cristallina del Borna virus, evidenziano come tutti abbiano simili strutture nei cardini. Insomma, questi virus si comportano in modo simile al virus della rabbia, e per questo motivo possono essere combattuti allo stesso modo, utilizzando composti che mantengano serrati i loro gusci. La somiglianza tra i loro cardini suggerisce, inoltre, un possibile organismo ancestrale comune, afferma Winfried. “Dalle analisi sequenziali non è possibile relazionarli, ma penso ci possa essere un comune nucleo-capside ancestrale dal quale successivamente i virus si sono evoluti per poter infettare diversi tipi di cellule.”
Resources
- La ricerca descritta in questo articolo è tratta da:Albertini AA, Wernimont AK, Muziol T, Ravelli RB, Clapier CR, Schoehn G, Weissenhorn W, Ruigrok RW (2006) Crystal structure of the rabies virus nucleoprotein-RNA complex. Science 313: 360-363.
- Per maggiori informazioni sul lavoro di Winfried Weissenhorn e Rob Ruigrok, visita il sito www2.ujf-grenoble.fr/pharmacie/laboratoires/gdrviro/
Institutions
Review
L’articolo illustra la natura di una ricerca scientifica come un entità dinamica e in continuo sviluppo. Ogni segreto nella vita delle singole cellule, o nei più semplici organismi, che venga rivelato grazie all’utilizzo di tecnologie sofisticate, ha ripercussioni sull’innovazione della medicina e il controllo e la lotta alle malattie.
Marie Walsh, Irlanda
