Química verde Understand article
Traducido por Jose Viosca. No siempre la química es respetuosa con el medio ambiente; la química verde trabaja para cambiar eso.
La química tiene una compleja reputación. Todos nos beneficiamos de los bienes de consumo y las medicinas que la industria química produce, pero también hay un lado oscuro – el gran consumo de energía y los disolventes, reactivos y desechos tóxicos. Desde hace más de 20 años, los químicos han tratado de limpiar los procesos químicos dando lugar a la creciente área de la química verde.
También conocida como química sostenible o química ambientalmente benigna, la química verde es un concepto que poco a poco se introduce en las escuelas. Dos de sus pioneros campeones, Paul Anastas y John Warner, definen la química verde como ‘el diseño de productos y procesos químicos que reducen o eliminan el uso y generación de sustancias peligrosas’.
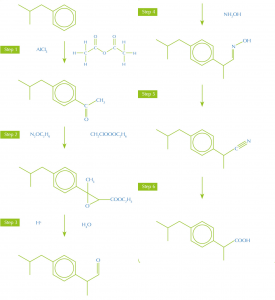
ibuprofeno, orginalmente en
6 pasos, ha sido reemplazada
con una síntesis en tres
etapas
Imagen cortesía de Nicola Graf
La eliminación o reducción de desechos, el consumo de energía o una mayor seguridad son de interés no solo para la humanidad y el entorno, también para la industria. Un informe del año 2011 sugirió que la química verde podría ahorrar 65.5 mil millones de $ para el 2020.
Las principales ideas de la química verde pueden resumirse en unos pocos puntos, que podrían discutirse en clase de forma general o en profundizad considerando los procesos químicos enseñados tradicionalmente en las escuelas. Aquí lo enfocaremos desde la perspectiva de la química climática. La lista de los 12 principios de la química verde puede consultarse onlinew1, pero aquí nos limitaremos a los aspectos mas aplicables al nivel de química escolar: economía atómica, fuente de reactivos, uso de sustancias ambientalmente benignas y reducción del consumo de energía.
Reducir desechos
Un tema central en la química verde es la cantidad de reactivos y disolventes que son transformados en el producto deseado en lugar de en desechos. Eliminar los desechos elimina los problemas ambientales asociados, como subraya la idea de la economía atómica que se trabajará con unos ejercicios sencillos para los estudiantes (ver caja). La fuente de los materiales de partida también debería considerarse. Los reactivos tendrían que ser renovables cuando fuera apropiado u obtenibles de fuentes abundantes y accesibles.
Los fármacos, concretamente, son obtenidos a menudo en una síntesis con múltiples etapas. No es tan sencillo como poner en un tubo de reacción el reactivo A junto con el B. El producto de una reacción es utilizado en la siguiente, y así varias veces. El problema es que el rendimiento en cada etapa se aleja del 100%, perdiéndose en el camino una importante cantidad de materiales, disolventes y energía.
Además, las rutas de síntesis con menos etapas y más productivas producen menos desechos, teniendo en mente los otros principios verdes. Por ejemplo, el ibuprofeno, analgésico, era fabricado originalmente en una síntesis de seis etapas a partir del reactivo inicial isobutilbenzeno. Ahora, una nueva síntesis más eficaz solo emplea 3 etapas (figura 1).
Reducir toxicidad
La química verde intenta usar solamente sustancias que no dañen el medio ambiente. En uno de los peores desastres industriales del mundo, hubo una fuga de un gas utilizado en la producción de pesticidas, el metil-isocianato (CH3NCO), en una planta de la Union Carbide India Limited en Bopal, India, en el año 1984. Miles de personas fueron expuestas. Varios miles murieron y alrededor de medio millón de heridos sufrieron enfermedades temporales o permanentes.
Además de elegir reactivos menos tóxicos, los químicos verdes también intentan cambiar a disolventes inorgánicos como el agua y el dióxido de carbono súper crítico. Los disolventes hidrocarburos usados antes son tóxicos y emiten gases de invernadero, mientras que los disolventes halogenados son normalmente carcinogénicos y también son gases de invernadero y fuentes de radicales libres – que destruyen el ozono.
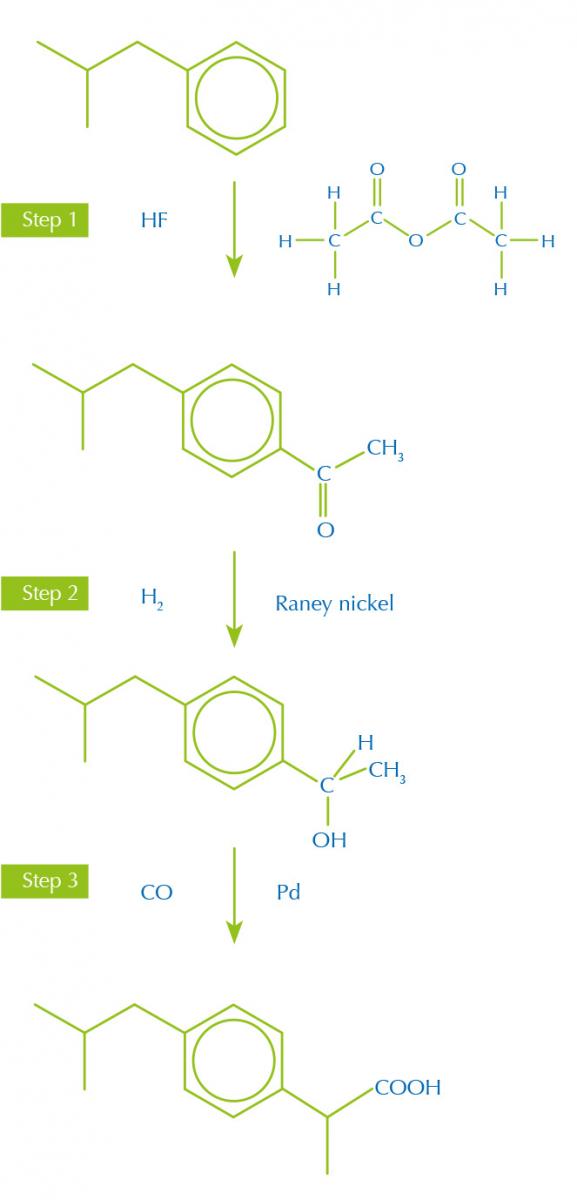
moderna de ibuprofeno
Imagen cortesía de Nicola Graf
Reducir emisiones
La industria química necesita una cantidad enorme de electricidad; reducirla es importante económica y ambientalmente. La energía se emplea para calentar y aumentar la presión de las reacciones y para transportar materiales. Los científicos buscan rutas de reacción alternativas que trabajen a temperaturas y presión mas bajas, reduciendo la cantidad de dióxido de carbono producido por los combustibles fósiles.
Encontrar catalizadores más eficientes para las reacciones existentes también disminuiría los reactivos y el consumo de energía. Idealmente, los catalizadores podrían emplear metales abundantes como el hierro en lugar de metales exóticos como el platino, que es escaso y cuya obtención requiere una energía considerable. Algunos catalizadores se ‘envenenan’ durante la reacción, lo que significa que algunas sustancias se unen a los sitios activos de los catalizadores formando productos en las superficies que pueden ser tóxicos y difíciles de desechar sin peligro.
Química verde en los combustibles
Los biocombustibles son sustitutos deseables a los combustibles fósiles. El etanol es un conocido biofuel que se produce en muchos procesos de fermentación. El etanol puede producirse a partir de vegetales como la hierba y las cáscaras de trigo. Con una adaptación, los vehículos pueden utilizar etanol puro (E100) o mezclas de etanol-petróleo como la alconafta (desde E5 a E25). Sin embargo, el etanol no es un buen combustible porque:
- No evapora tan fácilmente como la gasolina
- Tiene solo el 70% de la densidad energética de la gasolina
- Tiende a atraer el agua
- Es ácido a las temperaturas del motor, pudiendo causar corrosión
- Requiere una adaptación en los motores.
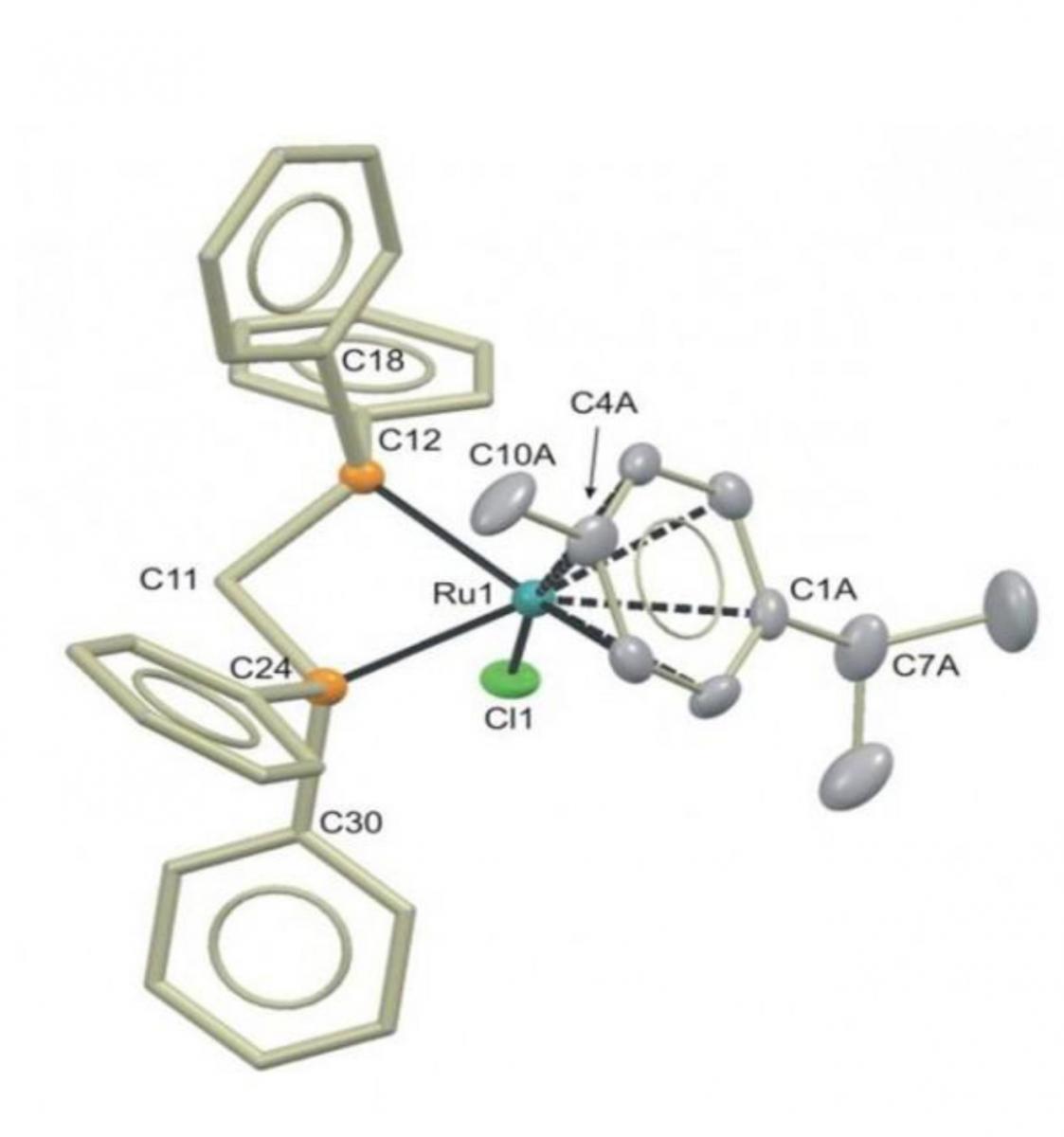
rutenio empleado para
fabricar butan-1-ol a partir
de etanol
Imagen cortesía de Duncan
Wass/Universidad de Bristol
El butan-1-ol con una densidad energética de 29 MJ/l (la del petróleo es 32 MJ/l) sería mucho mejor aditivo para combustibles que el etanol (19.6 MJ/l). El butan-1-ol puede producirse a partir de biomasa (biobutanol) o combustibles fósiles (petrobutanol), aunque ambos requieren mucha energía y catalizadores biológicos (enzimas) con baja eficiencia. Separar el butan-1-ol de una mezcla de productos también es costoso energéticamente.
Desde hace mucho, el objetivo de la industria química ha sido producir butan-1-ol condensando dos moléculas de etanol
CH3CH2OH + HOCH2CH3 → CH3CH2CH2CH2OH + H2O
En el 2013, sin embargo, un gran avance permitió producir butan-1-ol a partir de etanol con una eficiencia mayor del 95% usando un catalizador de rutenio. El reto ahora es hacer el proceso a gran escala para la industria.
Los problemas ambientales estarán ahí, por eso la química verde tendrá cada vez más protagonismo. Gente brillante y joven hará falta para aplicar los principios de la química verde en las ciencias químicas y la ingeniería.
Economía atómica
Tradicionalmente, los químicos han calculado la eficacia de una reacción mediante el rendimiento en porcentaje.
Rendimiento (%) = (moles obtenidos de producto / moles esperados de producto) x 100
Barry Trost de la Universidad de Standford en EEUU, introdujo el concepto de economía atómica como una visión alternativa a la eficacia de una reacción. La economía atómica relaciona la masa total de materiales de partida con la masa del producto deseado. Así, el cálculo destaca los recursos malgastados: si hay poco del material inicial en el producto, deben estar en los desechos.
Economía atómica (%) = (masa de producto deseado / masa total de reactivos) x 100
Es fácil demonstrar con cálculo que un químico que use la economía atómica preferirá usar materiales iniciales simples a la hora de construir un producto antes que romper una gran molécula en trozos y producir un montón de desechos.
Considera las reacciones en que el óxido de magnesio es el producto deseado:
2Mg + O2 → 2MgO
2 x 24 = 48 g 32 g 2 x 40 = 80 g
Economía atómica = (80 / (48 + 32)) x 100 = 100%
MgCO3 → MgO + CO2
84 g 40 g 44 g
Economía atómica = (40 / 84) x 100 = 48%
Los estudiantes más avanzados pueden reflexionar sobre qué cambios en la producción del ibuprofeno mejorarían la economía atómicaw2.
References
- Anastas PT, Warner C (1998) Green Chemistry Theory and Practice. New York, NY, USA: Oxford University Press. ISBN: 0198502346
- Trost BM (1991) The atom economy – a search for synthetic efficiency, Science 254: 1471–1477
Web References
- w1 – Los 12 principios de la química verde pueden encontrarse en la web de la Sociedad Americana de Química.
Esta web ofrece varios recursos educativos, sobre la química verde, como libros, recursos online y protocolos experimentales para todas las edades (desde enseñanza secundaria a grado universitario). - w2 – La web ‘Learn’ de la Royal Society of Chemistry tiene una lección sobre la síntesis del ibuprofeno, que también considera la estructura y diana de este fármaco.
Resources
- Mira estas actividades prácticas relacionadas con el cambio climático:
- Shallcross D, Harrison T (2008) Practical demonstrations to augment climate change lessons. Science in School 10: 46–50.
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Fomentando el interés hacia los combustibles: experimentos sobre el cambio climático. Science in School 11.
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Observando los cielos: experimentos sobre el cambio climático. Science in School 12.
Review
Tal como apuntan los autores, la química tiene un halo negativo entre estudiantes y público en general, pero la química que hay detrás de objetos y materiales es indispensable para nuestra vida. Por ello, recomiendo usar este artículo antes de impartir un curso de química en el colegio.
Las ideas están claramente explicadas con un estilo sencillo y ejemplos de la vida diaria como la síntesis de fármacos o los biocombustibles. Por supuesto, valdría la pena profundizar, idealmente con actividades prácticas.
Ambos objetivos son alcanzables con los materiales proporcionados en las referencias y recursos.
Los accidentes ocurridos en la historia como el desastre Bopal pueden ser un elemento para estimular la discusión sobre los riesgos químicos, la sostenibilidad ambiental y el papel de la química verde.
Gulia Realdon, Italy





