Lebendiges Licht: die Chemie der Biolumineszenz Teach article
Übersetzt von Nicola Reusch. Erleuchtung der Chemiestunde durch Biolumineszenz.

Qualle
Mit freundlicher Genehmigung
von Chris Favero; Bildquelle:
Flickr
Die Biolumineszenz zählt zu den natürlichen Wundern der Welt. Die bloße Schönheit tanzender Glühwürmchen-Lichter oder glühender, blauer Plankton-Wellen im Ozean fasziniert die Menschheit seit Jahrtausenden. Auch heute erfreuen wir uns gerne an solchen Lichtspielen. Allerdings sind wir mittlerweile auch in der Lage, die Chemie hinter diesen Phänomenen zu verstehen – und sie sogar für die Anwendung in Laboren anzupassen.
Eine Großzahl verschiedener Organismen, von Insekten, Fischen und Weichtieren bis hin zu Bakterien und Plankton, kann – wie seit Tausenden von Jahren bekannt – Licht emittieren. Der Romanautor Pliny the Elder beschrieb den essbaren Schellfisch Pholas dactylus, der, in Verstörender Art und Weise, Licht emittiert, wenn er gegessen wird. Auch, dass der Baumpilz Omphalotus olearius nachts strahlend leuchtet, hat Pliny angemerkt.
Das vielleicht spektakulärste biolumineszente Schauspiel stammt von Dinoflagellaten, einer Planktonart, die die bläulich glühenden Wellen verursacht, die manchmal an der Oberfläche von Ozeanen zu beobachten sind. Exotischere Formen der Biolumineszenz sind in der Tiefe des Ozeans zu finden, in die kein Sonnenlicht dringt. Dort erzeugen viele Spezies ihre eigenen Leuchterscheinungen. Bekannter Weise nutzen Seeteufel ihr Licht, um ihre Opfer anzulocken.

Photinus pyralis
Mit freundlicher Genehmigung
von Terry Priest; Bildquelle:
Flickr
Die Biolumineszenz – Licht, das von lebenden Organismen erzeugt wird – ist in der Natur weitverbreitet. Doch welche Vorteile bietet sie? Tatsächlich sind einige zu nennen:
- Aposematismus (toxische Erscheinung/Warnfärbung) – für potentielle Raubtiere ungenießbar erscheinen. Beispiel: die Glühwürmchen Photinus ignitus und Lucidata atra.
- Verteidigung – Räuber durch die Emission heller Blitze erschrecken. Beispiel: sogenannte Sternchaser, eine Unterart der Myctophidae oder Laternenfische.
- Balzverhalten – Kommunikation vor und nach der Paarung. Beispiel: Glühwürmchen.
- Lockmittel – Beute zur Lichtquelle anlocken. Beispiel: Anglerfische.
- Tarnung – hilft dem Tier dabei, sich an den Hintergrund anzupassen. Wie unten zu sehen, sieht ein Meerestier vor der hellen Wasseroberfläche dunkel aus. Wenn es aber selbst Licht produziert, kann es sich so vor potentiellen Feinden verstecken. Beispiel: Tintenfische wie Abralia verany.
Leuchtende Farben
In der Natur erzeugt die Biolumineszenz unterschiedliche Farben: hauptsächlich Blau, Grün und Gelb. Die unterschiedlichen Lichtfarben, die eine Art emittiert, hängen von der Umwelt, in der sie entstanden ist, ab. Die blaue Emission ist meist in der Tiefe des Ozeans anzutreffen. Grünes Licht findet man bei Arten, die an Küstenlinien leben und gelbe (und grüne) Emission lässt sich im Frischwasser und bei Landtieren beobachten.
Doch was steckt hinter der Chemie, die die Biolumineszenz ermöglicht? Und wie werden die unterschiedlichen Farben – Blau, Grün, Gelb – erhalten?
Aus chemischer Sicht sind die meisten Biolumineszenz-Phänomene die Folge von Oxygenierungs-Reaktionen: Sauerstoff reagiert mit Substanzen, die Luziferin genannt werden, wobei Energie in Form von Licht entsteht. Die Reaktionen werden durch Enzyme, die Luziferasen, katalysiert. Bei diesem Prozess werden die Luziferine mit Sauerstoff angereichert und es entstehen Oxyluziferine. Wie in Tabelle 1 gezeigt, können sich die Luziferine der unterschiedlichen Arten chemisch gesehen deutlich voneinander unterscheiden.
|
Biolumineszierende Art |
Luziferin |
Oxyluziferin |
|---|---|---|
|
Dinoflagellaten |
Dinoflagellat-Luziferin [3 Dinoflagellate luciferin.docx] C33H3806N4Na2 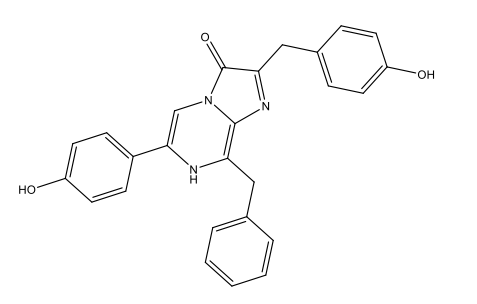 |
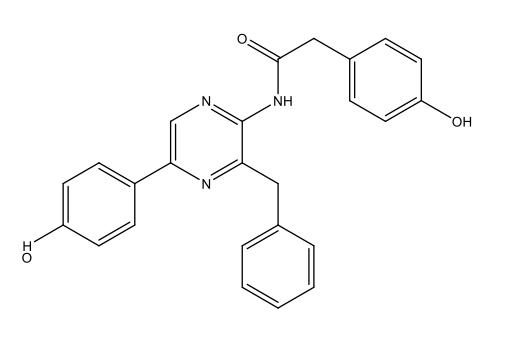 |
|
Tintenfische, Garnelen, einige Fische |
Coelenterazine C26H2103N3 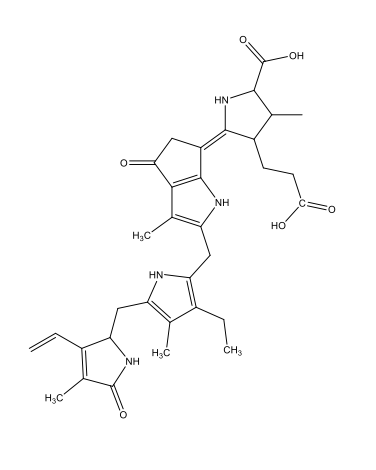 |
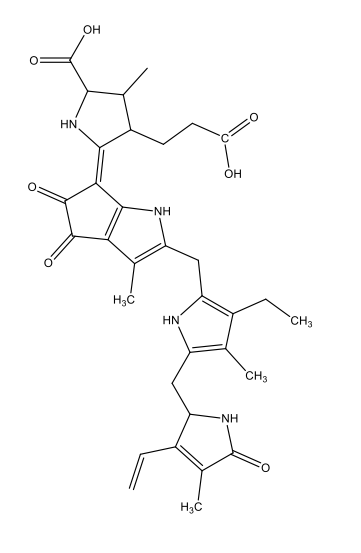 |
|
Glühwürmchen |
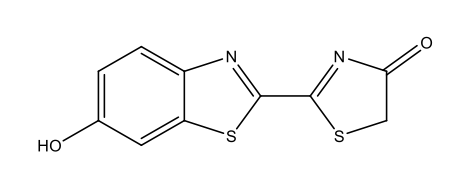
Glühwürmchen-Luziferin C11H8N2O3S2 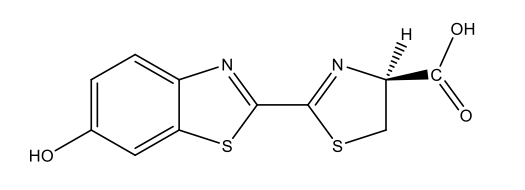 |
 |
Diese Reaktionen sind sehr effizient: Etwa 98% der Energie werden in Form von Licht freigesetzt. Zum Vergleich: Die Effizienz üblicher Glühbirnen, die auch eine große Energiemenge in Form von Wärme abgeben, liegt bei nur 2%.
Einige Luziferine kommen in unterschiedlichen Arten vor und können, wie in Tabelle 2 zusammengestellt, mehr als nur eine Lichtfarbe erzeugen. Weitere licht-emittierende Substanzen, die Fluorophore, können die Farbe der Lumineszenz ebenfalls ändern. Die Quallenart Aequorea victoria enthält ein solches Fluorophor, das auch als Grün Fluoreszierendes Protein (GFP) bekannt ist. GFB absorbiert das blaue Licht der ursprünglichen Reaktion und gibt es bei längeren Wellenlängen als grünes Licht wieder ab. Die Biolumineszenz der Qualle ist also grün.
|
Luziferin |
Lumineszenz-Maximum (nm) |
Ungefähre Farbew1 |
|
|---|---|---|---|
| Glühwürmchen-Luziferin | 560 (at pH=7.1) | Grün |
 |
| 615 (at pH=5.4) | Orange |
 |
|
| Bakterielles Luziferin | 490 | Türkis |
 |
| Dinoflagellaten-Luziferin | 474 | Blau |
 |
| Coelenterazin | 450-480 as an anion | Blaub bis Türkis |
 |
| 400 in the –COOH form | Violett |
 |
|
In den vergangenen Jahrzehnten spielte speziell dieses Biolumineszenz-System eine wichtige Rolle in der wissenschaftlichen Forschung: das Gen, das das GFP kodiert, wird mittlerweile als genetische Markierung verwendet, um bestimmte Proteine zu verfolgen und wenn spezielle Gene exprimiert werden. GFP leuchtet grün unter blauem oder UV-Licht, weshalb es leicht nachzuweisen ist (siehe Furtado, 2009). Diese Arbeit wurde als so wichtig angesehen, dass für sie der Nobelpreis für Chemie 2008w2vergeben wurde.
Glücklicherweise sind derartige chemische Reaktionen leicht nachzumachen, wie der folgende Versuch zeigt.
Schülerversuch: Biolumineszenz im Labor
Bei diesem Versuch können Schülerinnen und Schüler selbst eine lumineszierende Reaktion, als Folge der Mischung chemischer Reagenzien, verfolgen. Der wichtigste Reaktant ist Luminol, eine synthetische, chemilumineszierende Substanz, die bei der chemischen Reaktion ein bläuliches Leuchten erzeugt. Auch wenn die Reaktionen von Luminol und Luziferin unterschiedlich sind – die Oxidation von Luminol wird von Kaliumhexacyanoferrat und nicht von einem Enzym katalysiert (für weitere Details siehe Welsh, 2011)– das Ergebnis ist identisch: Lumineszenz.
Der abschließende Versuchsteil sollte in einer dunklen Umgebung durchgeführt werden, um das Lichtspektakel möglichst gut erkennen zu können.
Material
- 1 g Luminol (5-Amino-2,3-dihydrophthalazin-1,4-dion)
- 50 ml Natriumhydroxid (NaOH) 10% w/w-Lösung
- 50 ml Kaliumhexacyanoferrat (K3[Fe(CN)6]) 3% w/w-Lösung
- Etwa 0,5 g Kaliumhexacyanoferrat (K3[Fe(CN)6])
- 3 ml Wasserstoffperoxid (H2O2) 30% m/m-Lösung
- Bechergläser
- Trichter
- Funnel
- Messzylinder
- Kolben
Durchführung
Sicherheitshinweis:
Schutzbrillen, Laborkittel und Handschuhe sollten getragen werden. Vorsicht ist bei der Arbeit mit 30%-iger Wasserstoffperoxid-Lösung geboten, da sie in Anwesenheit eines Katalysators heftig reagieren kann. Die Flasche ist direkt nach dem Abfüllen der 3 ml wieder zu verschließen.
Siehe auch die generellen Science in School Sicherheitshinweise.
- Löse in einem Becherglas 1 g Luminol in 450 ml destilliertem Wasser.
- Füge 50 ml 10%-ige Natriumhydroxid-Lösung hinzu und rühre die Mischung durch.
- Entnehme 50 ml der so hergestellten Lösung und gebe sie zu 350 ml destilliertem Wasser in ein weiteres Becherglas. Jetzt hast du Lösung A hergestellt.
- Vermische in einem dritten Becherglas Kaliumhexacyanoferrat mit 350 ml destilliertem Wasser und 3 ml Wasserstoffperoxid-Lösung. Das ist Lösung B.
- Gebe gleiche Mengen von Lösung A und B in unterschiedliche Messzylinder.
- Gebe etwas Kaliumhexacyanoferrat in einen Kolben und setze den Trichter auf den Kolben.
- Stelle den Kolben an einen dunklen Ort.
- Gebe nun die Lösungen A und B gleichzeitig in den Kolben und beobachte was passiert.
Als Resultat lässt sich eine wunderschöne, hellblaue Lumineszenz beobachten!
- Entsorgung: Erhitze die Lösung im Abzug und enge sie soweit ein, dass das Volumen etwa 1/8 der Ursprungsmenge entspricht. Gebe die restliche Lösung in den Schwermetallabfall.
Was passiert dabei?
Die Oxidation von Luminol findet in mehreren Stufen statt.
- Während Lösung A vorbereitet wird (Schritt 2), reagiert Luminol mit der Base (OH–):
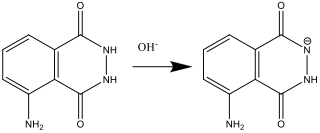
- Während Lösung A vorbereitet wird (Schritt 2), reagiert Luminol mit der Base (OH–):
- Beim Vermischen von Lösung A und B (Schritt 8) wird Luminol von den Hexacyanoferrat(III)-Anionen oxidiert, wobei Radikalanionen entstehen:
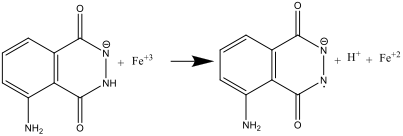
Das Hexacyanoferrat-Ion übernimmt also gleich zwei Aufgaben: Es katalysiert die Bildung des Superoxid-Radikalanions O2.-.und oxidiert Luminol zu einem Radikalanion. Eisen muss dabei in einem Komplex wie [Fe(CN)6] 3 vorliegen, um das Ausfallen von Fe(OH)3 in dem stark basischen Milieu zu verhindern.
- Das Luminol-Radikalanion und das Superoxid-Radikalanion O2.- reagieren dann zu:
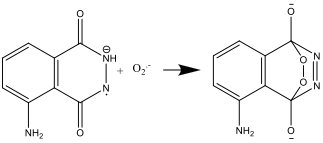
- Das Produkt dieser Reaktion ist instabil und zerfällt zu Stickstoff und einer angeregten Form des Aminophthalat-Ions:
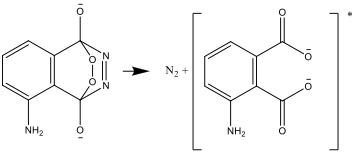
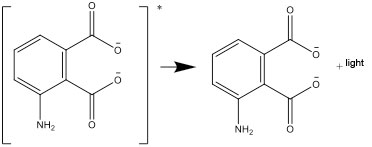
- Diese angeregte Form geht in eine stabile Form über und gibt die dabei freiwerdende Energie als Licht ab:
Diskussionsfragen
- Woher kommt die Energie, die in der Luminol-Reaktion in Form von Licht freigesetzt wird?
- Welche Aufgabe hat Kaliumhexacyanoferrat? Welche Substanz übernimmt diese Rolle in natürlichen Lumineszenzreaktionen?
- Welche Substanz ist für die Oxidation in der Luminol-Reaktion verantwortlich? Ist es in der Natur die gleiche?
Weiterführendes
Es gibt eine Menge Informationen über Biolumineszenz (weitere Beispiele sind in den weiterführenden Materialien zu finden). Die Schülerinnen und Schüler können im Anschluss eigenständig zu folgenden Themen recherchieren:
- Der Nutzen der Biolumineszenz in der Natur: Finde weitere Gründe warum die Anpassung durch Biolumineszenz nützlich ist. Finde für jede Art der Anpassung Arten, die davon profitieren.
- Die Chemie der Biolumineszenz: Finde einige spezifische Chemilumineszenz-Reaktionen, die in der Natur vorkommen. Wie ähnlich sind diese Reaktionen der Luminol-Reaktion?
- Die Farben der Biolumineszenz: Finde mehr darüber heraus, wie die Farben der Biolumineszenz gebildet werden.
- Die Evolution der Biolumineszenz: Entwickelte sich die Biolumineszenz einmal oder mehrere Male?
- Die Verwendung von Luminol bei der Untersuchung von Tatorten: Finde heraus, wie Luminol in der Forensik genutzt wird und wie die Chemie dahinter funktioniert (siehe zum Beispiel Welsh, 2011).
Chemie mit Pliny the Elder
Im Rahmen eines größeren, interdisziplinären Projekts zusammen mit 14- bis 15-jährigen Schülerinnen und Schülern, können außerdem alte wissenschaftliche Techniken erforscht werden. Pliny the Elder (23-79 AD) war ein Romanautor und Naturalist, dessen Enzyklopädie Naturalis Historia einen Großteil der naturwissenschaftlichen Kenntnisse der Zeit umfasst. Wir haben zum Beispiel zu Beginn jeden Themas einen Abschnitt aus der Naturalis Historia besprochen. Anschließend haben wir herausgearbeitet, wie man entweder das Experiment, das im Text beschrieben wird, oder ein ähnliches Experiment nachstellen könnte
Auf diese Weise wurden die Schülerinnen und Schüler in den gleichen „vor-wissenschaftlichen“ Zustand wie Pliny versetzt und haben anschließend, durch die Laborarbeit und die Diskussion, moderne wissenschaftliche Kenntnisse der Themengebiete erlangt. Selbst die unbegeistertsten Schülerinnen und Schüler ließen sich so motivieren.
Zu den weiteren Aktivitäten des Projekts zählten die Synthese von Indigo (Farusi, 2012), die Herstellung von Mosaiksteinen mit Borsäure und die Herstellung von Eisengallustinte (Farusi, 2011), Das gesamte Projekt wurde im Rahmen des internationalen Science on Stage-Festivalsw3 in Kopenhagen, Dänemark, 2011 vorgestellt.
References
- Farusi G (2007) Monastic ink: linking chemistry and history. Science in School 6: 36-40
- Farusi G (2011) Duften wie Julius Caesar: die Herstellung antiker Parfüms im Labor. Science in School 21: 40-46
- Farusi G (2012) Indigo: Wiederherstellung des Farbstoffs der Pharaonen. Science in School 24: 40-46
- Furtado S (2009) Lebewesen grün einfärben: GFP. Science in School 12: 19-23
- Welsh E (2011) Was ist Chemolumineszenz? Science in School 19: 62-68
Web References
- w1 – Ein einfaches Werkzeug, um eine Wellenlänge in Nanometern in eine hexadezimale oder RGB-Farbe zu konvertieren , ist auf der Academo-Webseite, einer kostenlosen Zusammenstellung von Bildungsressourcen, zugänglich.
- w2 – Auf der Webseite des Nobelpreises ist eine Seite für den Nobelpreis für Chemie 2008 zu finden, den Osamu Shimomura, Martin Chalfie und Roger Y Tsien erhielten.
- w3 – Science on Stage ist ein Netzwerk von lokalen, nationalen und internationalen Veranstaltungen für Lehrer, das 1999 vom EIROforum, dem Herausgeber von Science in School, gestartet wurde. Bei jeder nationalen Veranstaltung wird eine Lehrervertretung ausgewählt, die ihr Land beim internationalen Science on Stage-Festival vertritt. Auf dem Festival teilen etwa 350 Lehrer von Grund- und weiterführenden Schulen aus 25 Ländern ihre innovativsten Ideen in Seminaren, bei Aufführungen und bei der Lehr-Messe.Das nächste internationale Festival wird vom 29. Juni – 2. Juli 2017 in Debrecen in Ungarn stattfinden. Die Teilnehmer werden auf den nationalen Veranstaltungen in 25 Ländern ausgewählt. Für weitere Informationen zum Bewerbungsprozess, kontaktieren Sie bitte ihren nationalen Ausschuss.
Resources
- Zwei Artikel über (Bio)Lumineszenz:
- Douglas P, Garley M (2010) Chemie und Licht. Science in School 14: 63-68
- Judson O (2015) Luminous life. National Geographic
- Eine ansprechende und informative Animation über die Biolumineszenz.
- Ein stimmungsvolles Video mit Musik, indem die außergewöhnliche Schönheit der Biolumineszenz im Ozean zelebriert wird.
- Ein kurzes Video, das zeigt, wie Luminol hergestellt wird.
- Ein längeres Video über die Herstellung von Luminol.
Institutions
Science on StageReview
Die Biolumineszenz hat die Menschheit seit Tausenden von Jahren fasziniert und stellt immer noch ein wichtiges Forschungsgebiet dar, besonders in Projekten zur Erforschung der Ozeane. Die chemischen Reaktionen, die zur Erzeugung von Licht durch Organismen führen, sind ein wichtiges Beispiel der Biochemie. Die praktischen Versuche in diesem Artikel sind nützlich, um die Schülerinnen und Schüler zu begeistern, zu motivieren und wissenschaftliche Diskussionen anzuregen.
Marie Walsh, Limerick Institute of Technology, Irland





