O que é a quimioluminescência? Understand article
Traduzido por António Daniel Barbosa. Medusas brilhantes, pirilampos tremeluzentes, tubos luminosos divertidos; Emma Welsh introduz o belo e misterioso mundo da quimioluminescência.

Imagem cortesia de Erik
Solheim; fonte da imagem:
Wikimedia Commons
Pirilampos, medusas e tubos luminosos – um voa, outro vive no fundo do oceano e o outro proporciona divertimento em discotecas. Qual é o elo de ligação? A resposta reside em reacções químicas intrigantes que produzem luz.
A quimioluminescência consiste na produção de luz a partir de uma reacção química. Dois produtos químicos reagem para formar um intermediário excitado (de alta energia), que se decompõe libertando parte da sua energia como fotões de luz (ver o glossário para todos os termos a negrito) para alcançar o seu estado fundamental (ver Figura 1, abaixo).
A + B -> AB* -> Produtos + Luz
Intermediário
excitado
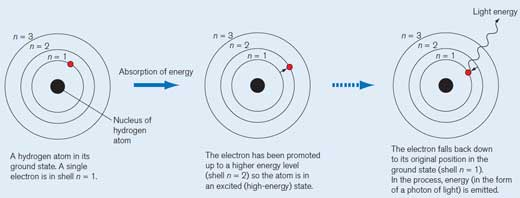
Um átomo de hidrogénio no seu estado fundamental. Um único electrão encontra-se no nível n = 1. Cada nível electrónico tem a sua própria energia.
Quando o átomo de hidrogénio absorve um quantum (quantidade definida) de energia, é promovido para um nível de energia superior (nível n = 2) e passa a estar num estado excitado (de alta energia). Um asterisco (*) é colocado junto à molécula para indicar este estado.
O electrão regressa à sua posição original no estado fundamental (nível n = 1). Neste processo, uma quantidade de energia (um fotão) é libertada sob a forma de radiação electromagnética. O comprimento de onda depende da quantidade de energia. Se o comprimento de onda encontra-se dentro da gama da luz visível, a transição electrónica será observada como luz de uma cor específica. O comprimento de onda determina a cor (ver a Figura 2, abaixo)
Imagem cortesia de Chemistry Review
As reacções quimioluminescentes habitualmente não libertam muito calor, uma vez que a energia é libertada sob a forma de luz. O luminol produz uma luz quando reage com um agente oxidante; a química desta reacção é apresentada na Caixa 1.
Caixa 1: Luminol, um produto químico que brilha no escuro
A libertação de um fotão de luz a partir de uma molécula de luminol é um processo bastante complexo e com múltiplas etapas. Numa solução básica (alcalina), o luminol existe em equilíbrio com o seu anião, que contém uma carga -2. O anião pode existir em duas formas (ou tautómeros), com as duas cargas deslocalizadas nos dois oxigénios (a forma enol) ou nos dois azotos (a forma cetol, ver Figura 3, abaixo).
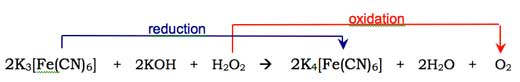
O oxigénio molecular (O2) ccombina-se com a forma enol do anião do luminol, oxidando-o a um peróxido cíclico. O oxigénio necessário é produzido numa reacção redox (isto é, uma reacção na qual ocorre redução e oxidação) envolvendo o peróxido de hidrogénio (H2O2), hidróxido de potássio e (por exemplo) hexocianoferrato(III) de potássio (K3[Fe(CN)6] também conhecido por ferricianeto de potássio). O ião hexocianoferrato(III) ([Fe(CN)6]3-) é reduzido ao ião hexocianoferrato(II) ([Fe(CN)6]4-, originando ferrocianeto de potássio, K4[Fe(CN)6]), enquanto que os dois átomos de oxigénio do peróxido de hidrogénio são oxidados do estado de oxidação -1 a 0:
O peróxido cíclico é posteriormente decomposto para formar 3-aminoftalato (ácido 3-amino-1,2-benzenodicarboxílico) num estado excitado, juntamente com uma molécula e azoto (N2) – ver Figura 3, abaixo. Esta reacção de decomposição é favorecida porque a molécula de peróxido cíclica é altamente instável, e a reacção envolve a quebra de algumas ligações fracas. É igualmente favorecida devido ao aumento de entropia (desordem) pela libertação da molécula de gás. Quando o 3-aminoftalato regressa ao estado fundamental, um fotão de luz azul é libertado.
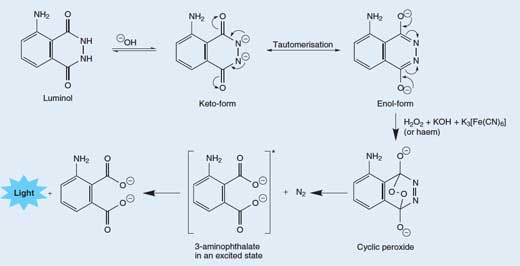
Os tautómeros são moléculas com a mesma fórmula molecular, mas arranjos diferentes dos átomos ou ligações. Os dois tautómeros podem ser interconvertíveis; as setas curvas mostram os movimentos dos electrões que conduzem à mudança entre as duas formas. Clique na imagem para ampliar
Imagem cortesia de Chemistry Review
Quimioluminescência nas ciências forenses
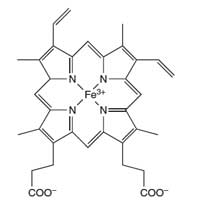
hemoglobina
O átomo de ferro (Fe) no
centro do anel porfirina
catalisa a reacção do luminol
Imagem cortesia de Chemistry
Review
Os cientistas forenses usam a reacção do luminol para detectar sangue nos locais de crime. Uma mistura de luminol numa solução diluída de peróxido de hidrogénio é pulverizada na área onde os cientistas forenses suspeitam da existência de sangue. O ferro presente no grupo heme da hemoglobina (ver Figura 4) do sangue funciona como catalisador da reacção descrita na Caixa 1. A sala tem de estar no escuro e se o sangue estiver presente, um brilho azul, que dura cerca de 30 segundos, será observado. Os investigadores forenses podem gravar este brilho usando um filme fotográfico, que pode ser utilizado em tribunal como prova da presença de sangue no local. (Uma actividade pedagógica sobre ciência forense pode ser consultada em Wallace-Müller, 2011.
Uma vez que o ferro actua como catalisador, são apenas necessárias quantidades residuais, desta forma apenas uma pequena quantidade de sangue é necessária para produzir um resultado positivo. Isto significa que o sangue pode ser detectado mesmo quando não é visível a olho nu.

do crime
Imagem cortesia de How Stuff
Works
Um dos inconvenientes em usar o luminol é que esta reacção pode ser catalisada por outros produtos químicos que podem estar presentes no local do crime, por exemplo, ligas contendo cobre, alguns líquidos de limpeza como lixívia, ou até rábano. Os criminosos hábeis podem limpar o sangue com lixívia, que destrói a prova de sangue, mas o branqueamento do tapete pode alertar as pessoas mais cedo para a existência de crime. A urina também contém pequenas quantidades de sangue, que podem ser suficientes para catalisar a reacção do luminol. A aplicação do luminol numa área pode impedir a execução de outros testes nesse local. No entanto, apesar destes inconvenientes, o luminol é ainda usado pelos cientistas forenses como ferramenta para resolver crimes.
Na discoteca
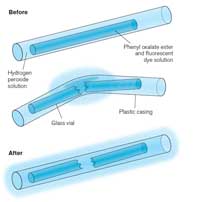
funcionamento de um tubo
luminoso. Clique na imagem
para ampliar
Imagem cortesia de Chemistry
Review
Quando um tubo luminoso é quebrado e começa a brilhar, a luz produzida é um exemplo de quimioluminescência (ver Figura 5). Os tubos luminosos consistem num tubo de plástico contendo uma mistura que inclui difenil oxalato e um corante (que confere a cor ao tubo luminoso). Dentro do tubo de plástico encontra-se um tubo de vidro mais pequeno que contém peróxido de hidrogénio. Quando o tubo exterior é dobrado, o tubo interior quebra-se libertando o peróxido de hidrogénio que inicia uma reacção química que produz luz (ver Caixa 2). A cor da luz que um tubo luminoso produz é determinada pelo corante usado (ver Caixa 3).
As reacções de quimioluminescência, como as dos tubos luminosos, são dependentes da temperatura. A reacção será mais rápida se a temperatura aumentar – quebrar o tubo luminoso em água quente produzirá um brilho fantástico, mas não durará tanto como duraria à temperatura ambiente. Por outro lado, a velocidade da reacção diminui a baixas temperaturas; esta é a razão pela qual manter o tubo luminoso no frigorífico durante algumas horas pode permitir que este brilhe intensamente outra vez quando for removido e aquecido, doutra forma teria deixado de brilhar muito antes disso. A reacção não pára totalmente no frigorífico mas é atrasada para que o brilho seja dificilmente detectado.
Caixa 2: Química de um tubo luminoso
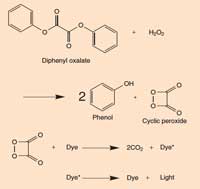
ampliar
Imagem cortesia de Chemistry
Review
Quando o difenil oxalato reage com o peróxido de hidrogénio (H2O2) é oxidado para formar fenol e um peróxido cíclico. O peróxido reage com a molécula do corante para formar duas moléculas de dióxido de carbono (CO2) e no processo um electrão na molécula do corante é promovido a um estado excitado. Quando a molécula do corante excitada (de alta energia) regressa ao estado fundamental, um fotão de luz é libertado. A reacção é dependente do pH. Quando a solução é ligeiramente alcalina, a reacção produz uma luz mais brilhante.
Nota de segurança
O fenol é tóxico, se o tubo luminoso verter, ter o cuidado de não ficar com o líquido nas mãos; se tal acontecer, lavar as mãos com água e sabão rapidamente. Ver também as regras gerais de segurança da Science in School.
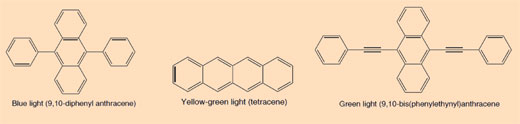
Caixa 3: O que produz as diferentes cores dos tubos luminosos?
Os corantes usados nos tubos luminosos são compostos aromáticos conjugados (arenos). O grau de conjugação reflecte-se nas diferentes cores da luz emitida quando um electrão transita de um estado excitado para o estado fundamental
Tubos luminosos vivos

Imagem cortesia de Terry
Priest; fonte da imagem: Flickr
Já alguma vez ao andar na praia à noite observou faíscas de luz à volta dos pés? Ou estando no campo à noite observou pirilampos a voar? Estes são exemplos de bioluminescência e cerca de 90% da vida no fundo dos oceanos apresenta igualmente este estranho fenómeno. Estes organismos evoluíram para produzir luz porque esta tem muitas funções úteis. Brilhar pode servir como isca para apanhar uma presa, como camuflagem ou para atrair potenciais parceiros. Algumas bactérias também usam a bioluminescência para comunicar.
O termo “verme brilhante” descreve as larvas de diversas espécies de insectos, incluindo pirilampos; alguns brilham para assustar predadores, enquanto outras espécies usam o seu brilho para atrair presas. Existem espécies de lulas e crustáceos que podem libertar nuvens de líquido bioluminescente para confundir os predadores enquanto fogem. Organismos que vivem no fundo dos oceanos evoluíram para produzir principalmente luz azul ou verde porque estas são facilmente transmitidas na água do oceano. Isto acontece porque a luz azul possui um comprimento de onda inferior ao da luz vermelha, o que significa que demora mais tempo a ser absorvida pelas partículas da água.
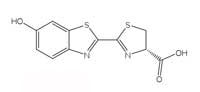
luciferina dos pirilampos.
Clique na imagem para
ampliar
Imagem cortesia de Chemistry
Review (structure)
As reacções de bioluminescência usam ATP (adenosina trifosfato) como fonte de energia. A estrutura das moléculas que produzem luz varia de espécie para espécie, mas todas recebem genericamente o nome de luciferina. A estrutura da luciferina dos pirilampos é mostrada na Figura 6, à esquerda. Quando os pirilampos brilham, a luciferina é oxidada para produzir um complexo excitado, que regressa ao estado fundamental, libertando um fotão de luz, tal como a reacção de quimioluminescência do luminol descrita na Caixa 1. No entanto, os pirilampos não usam peróxido de hidrogénio e hexocianoferrato(III) de potássio para oxidar a luciferina; em vez disso usam o oxigénio molecular e a enzima designada por luciferase (este é também um nome genérico – as luciferases variam de espécie para espécie).

descoberta na medusa
Aequorea victoria
Imagem cortesia de Typoform
/ the Royal Swedish Academy
of Sciences (RSAS)
Luciferase
Luciferina + O2 → Oxiluciferina + Luz
Diversos estudos têm investigado a aquorina, uma proteína encontrada em algumas medusas, que produz luz azul na presença de cálcio (ver Shaw, 2002, e Furtado, 2009) e que pode, desta forma, ser usada em biologia molecular para medir os níveis de cálcio nas células. Alguns cientistas desenvolveram outras ideias para a utilização da bioluminescência no futuro, por exemplo árvores de natal que se auto-iluminam. Consegue pensar noutras potenciais aplicações para este fantástico fenómeno natural?
Glossário
ampliar
Imagem cortesia de Chemistry
Review
Anião: um átomo (ou grupos de átomos) que contém uma carga negativa.
ATP: adenosina trifosfato presente em todas as formas de vida conhecidas. Consiste na moeda energética primária das células. O ATP é formado a partir de ADP (adenosina difosfato) e fosfato durante reacções que produzem energia (como a oxidação da glucose) e é quebrado (a ADP e fosfato) para libertar esta energia de forma a promover reacções desfavoráveis.
Bioluminescência: Produção de luz por seres vivos. A bioluminescência pode resultar da absorção de luz (fluorescência ou fosforescência, por exemplo em muitos peixes de mar profundo) ou de uma reacção química (quimioluminescência, por exemplo nos pirilampos).
Catalisador: Substância que faz uma reacção ocorrer mais rapidamente, mas que não sofre uma alteração química permanente durante a reacção (isto é, não é usada na reacção). Os catalisadores funcionam fornecendo uma via alternativa de menor energia para a reacção ocorrer.
Quimioluminescência: Tipo de luminescência na qual os electrões são excitados por uma reacção química, por exemplo a reacção do luminol descrita na Caixa 1.
Conjugados: Sistemas conjugados surgem principalmente na química quando existem ligações duplas próximas. Os átomos num sistema conjugado são mantidos juntos por ligações covalentes e possuem ligações simples e múltiplas alternadas (principalmente duplas, mas ligações triplas são também capazes de estar em conjugação). Os alcenos são planos; os sistemas conjugados têm de ser sempre planos para permitir a deslocalização dos electrões em todo o sistema. As moléculas de corante na Caixa 3 são exemplos de compostos conjugados.
Ligações covalentes: Ligações entre dois átomos nas quais um par de electrões é partilhado entre eles.

deslocalizados num sistema
conjugado
Imagem cortesia de Chemistry
Review
Deslocalizados: Quando as moléculas contêm ligações conjugadas, os electrões podem mover-se ao longo de todo o sistema conjugado. Estes são designados por electrões deslocalizados. Os electrões num anel benzénico são deslocalizados, sendo esta a razão pela qual as ligações carbono-carbono possuem o mesmo comprimento.
Fluorescência: Tipo de luminescência no qual os electrões são excitados pela luz, por exemplo nas marcas de segurança presentes nas notas.
Luminescência: Produção de luz, habitualmente a baixas temperaturas, por exemplo através de reacções químicas ou energia eléctrica. Pelo contrário, a incandescência consiste na luz produzida por altas temperaturas.
Fosforescência: O mesmo que fluorescência, mas o brilho dura mais tempo (de acordo com algumas definições, acima de 10 nanosegundos), por exemplo tubos luminosos que brilham no escuro.
Agradecimentos
A versão original deste artigo foi publicada na Chemistry Review e é reproduzida com a gentil permissão do editor, Phillip Allan. Para subscrever a Chemistry Review, uma revista destinada a estudantes de química entre os 16-19 anos, visitar: www.philipallan.co.uk/chemistryreview
References
- Furtado S (2009) Painting life green: GFP. Science in School 12: 19-23.
- Shaw A (2002) Genetic chess by the light of a jellyfish. Chemistry Review 12(1): 2-5
- Wallace-Müller K (2011) O jogo detective de DNA. Science in School 19: 30-35.
Resources
- Para algumas experiências com luminol, consultar o website de Declan Fleming para estudantes mais velhos, tudo sobre a quimioluminescência do luminol: www.chm.bris.ac.uk/webprojects2002/fleming/experimental.htm
- Para aprender sobre outros tipos de luz na química, consultar:
-
Douglas P, Garley M (2010) Chemistry and light. Science in School 14: 63-68.
-
Review
Este artigo oferece uma forma de motivar os estudantes para perceber as reacções químicas. Mesmo que eles não estejam interessados em saber a razão pela qual um tubo brilhante brilha no escuro, irão estar ansiosos por perceber como os pirilampos ou as medusas produzem luz, ou para descobrir como o sangue é detectado nos locais de crime. Este artigo pode servir tanto como uma introdução às reacções químicas ou para fornecer exemplos atractivos de reacções redox e também para ilustrar os níveis de energia de um átomo.
O artigo pode ser adaptado para diferentes faixas etárias e para diferentes assuntos e tópicos. Para estudantes entre os 14-15 anos, pode ser usado para ensinar química (estrutura atómica e movimento de electrões entre níveis de energia, introdução a reacções químicas) ou biologia (bioluminescência). Para este grupo etário, o professor terá de simplificar a informação no artigo e omitir os detalhes das reacções. Para estudantes entre os 16-18, o artigo pode ser usado para ensinar química (reacções redox, catalisadores, a influência da temperatura na velocidade das reacções, o efeito do pH numa reacção e as ligações covalentes), física (o espectro electromagnético e fotões) ou genética (engenharia genética). Questões de compreensão apropriadas podem ser:
- O que é a quimioluminescência?
- Os cientistas forenses usam a quimioluminescência para que fins?
- Explica algumas funções biológicas da bioluminescência.
- Porque deves manter o tubo luminoso no frigorífico quando não estas a usá-lo?
- Como poderás fazer uma árvore de Natal que se auto-ilumine?
Ana Gil, Espanha