Da placa de Petri para o prato: a saga da carne cultivada Understand article
Comida do futuro: trincaria um proveta-burger ou um bife de placa de Petri? Como se produz carne cultivada em laboratório e o que pode significar para a saúde, a agricultura e o meio ambiente?
Em 2013, um cientista juntou-se a dois especialistas em alimentos, para trincar um hambúrguer na TV. “Parecido com carne”, “não tão suculento”, “com sabor a carne”, declararam os provadores.[1] Embora aquele hambúrguer não tenha ganho nenhum prémio culinário, foi certamente um marco na nossa história culinária. Este veredicto caracterizou o primeiro hambúrguer do mundo criado em laboratório.[2] Custou cerca de US$ 330 000 e demorou dois anos a ser produzido. Dez anos depois, a realidade de termos comida produzida em laboratório na nossa mesa de jantar, pode estar um pouco mais próxima.

Imagem: PA Images/Alamy Stock Photo
As emissões provenientes da pecuária representam 14,5% do total das emissões de gases com efeito de estufa, principalmente devido às emissões de metano pelos ruminantes.[3] A produção pecuária está associada à perda de biodiversidade e à necessidade de grandes áreas de terreno e recursos, incluindo água.[4] Além disso, a pecuária industrial levanta preocupações éticas adicionais acerca do bem-estar animal. Alternativas de carne de origem não animal, baseadas proteínas vegetais como o tofu ou leguminosas, estão em crescimento como resposta a uma população ambientalmente consciente. Em contraste, a carne baseada em células/cultivada visa uma replicação exata da carne, através do cultivo de células animais em laboratório, em vez de criar animais numa quinta.
A cultura de células fora de um organismo é uma prática habitual em laboratórios de investigação há décadas. As culturas de células são fundamentais para a testagem de hipóteses numa fase inicial, antes de serem explorados modelos com os animais. A produção em larga escala de vacinas, como as vacinas da poliomielite e da varicela, também é realizada com culturas celulares.[5] No entanto, a agricultura celular na produção de alimentos é uma aspiração muito mais recente e, se alcançada, permitirá o consumo de carne de vaca, frango ou marisco cultivados em laboratório num futuro próximo. De facto, já podemos comer frango cultivado em laboratório em Singapura, onde a carne cultivada da ‘Eat Just’ foi oficialmente aprovada em 2020.[6]
Como se produz, então, um hambúrguer em laboratório?
Produção de carne no laboratório
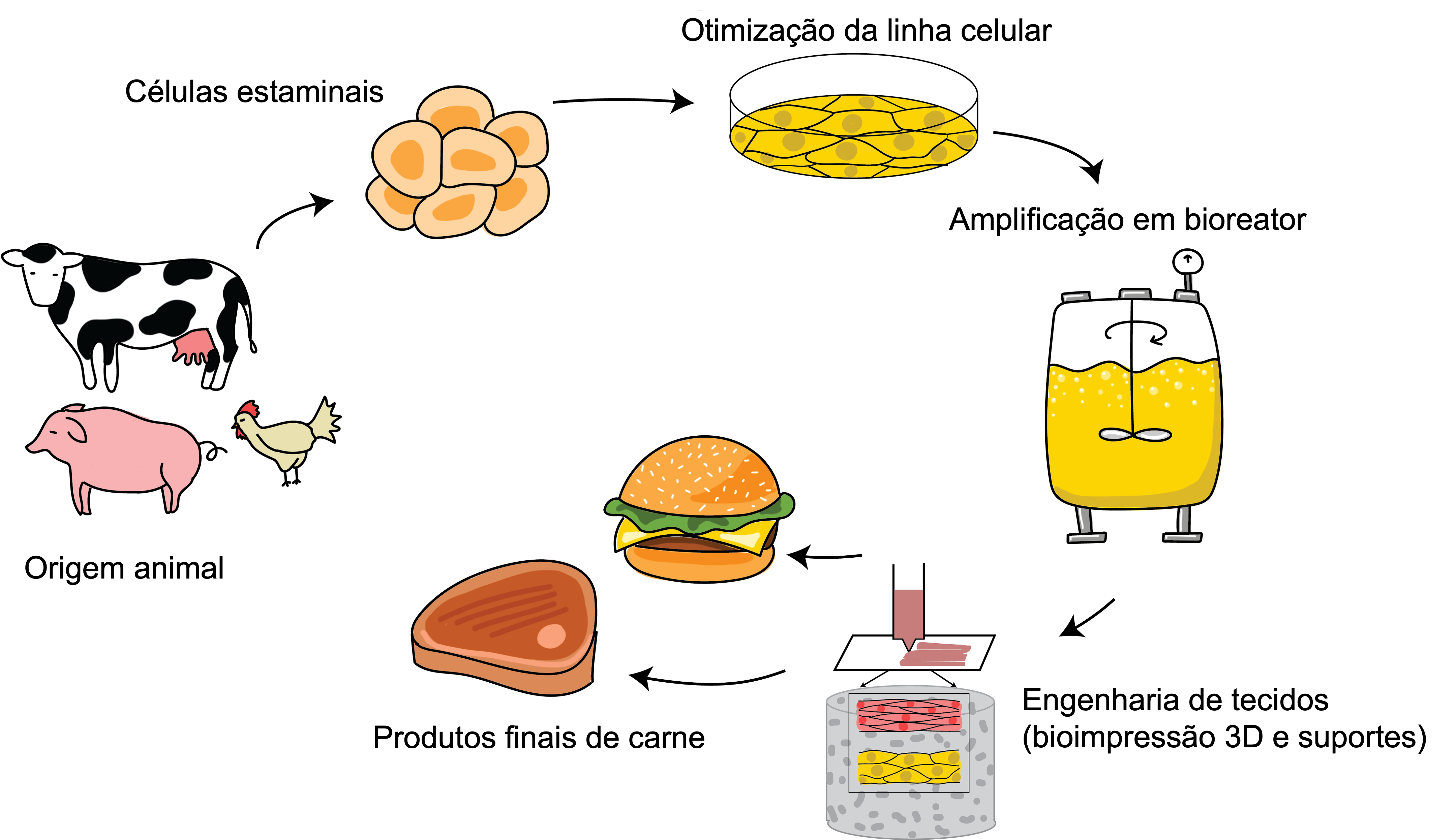
De forma resumida, a produção de carne cultivada envolve a recolha das células animais certas, otimizando-as para o crescimento fora do animal, ampliando a sua produção (através da engenharia de tecidos para imitar o tecido animal) e, finalmente, transformando-as num produto alimentar. (Figura 2).
A primeira questão é: quais são as células certas? A carne é composta principalmente por músculos, com células ricas em proteínas dispostas em feixes de fibras. Esses músculos e o tecido adiposo adjacente são alimentados por uma rede de vasos sanguíneos. Por isso, o material inicial ideal seriam células capazes de se multiplicar em grande quantidade e gerar esses componentes do tecido da carne.[8]
Quais as células a usar?
As células estaminais adultas de tecido muscular são uma escolha habitual para carne cultivada. Podem ser obtidas através da recolha de amostras de tecido (biópsias) de um animal vivo ou de tecido sobrante de um animal abatido (figura 3). No entanto, estas células em cultura só se replicam durante um curto período de tempo, pelo que é necessário um fornecimento constante de novas células.[9] Os investigadores estão a tentar criar células estaminais adultas com maior capacidade de autorrenovação, ainda sem sucesso, pelo que alguns laboratórios estão a explorar o potencial das células estaminais pluripotentes (PSCs), especificamente células estaminais embrionárias (ESCs)[10] ou células estaminais pluripotentes induzidas (iPSCs) criadas por modificação de células adultas maduras (figura 3).[11,12] Estas conseguem replicar-se indefinidamente e originar todos os tipos de células. No entanto, conduzir a sua diferenciação para o tipo de célula que queremos é um desafio.
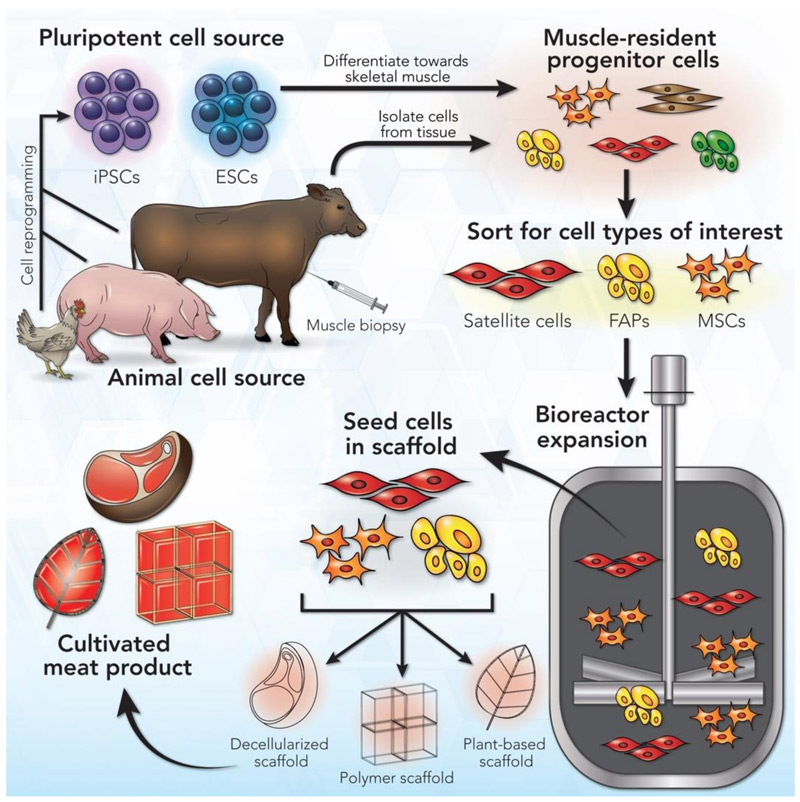
Imagem de Ref. [8], CC BY 4.0
Amplificando
A cultura de células em laboratório ocorre geralmente em placas planas não maiores que um Frisbee (figura 4), mas a obtenção de células para a produção comercial de alimentos requer uma escala enorme. Grandes bioreatores, que podem conter milhares de litros de cultura, devem garantir condições estéreis ideais para o crescimento celular, tais como temperatura e níveis de CO2 corretos, circulação de nutrientes e os suportes necessários.

Imagem cortesia do autor
As células são cultivadas num meio líquido rico em nutrientes como aminoácidos, glicose, vitaminas e sais.[5] Um componente comum é o soro fetal bovino (FBS), que contém muitos fatores de crescimento que podem manter a proliferação celular. O FBS é colhido em fetos de vacas prenhes após o abate, pelo que o seu uso é controverso. Também é caro e variável de lote para lote, representando um obstáculo significativo para tornar a carne celular económica e eticamente sustentável. A adição de extratos ricos em proteínas de plantas ou microrganismos, como leveduras e cianobactérias, juntamente com fatores de crescimento proteicos produzidos em laboratório, pode ser um substituto, mas é difícil alcançar o crescimento celular ideal com essas alternativas. No entanto, muitas empresas estão a investigar estas opções mais baratas e algumas já anunciaram o abandono da utilização do FBS, o que é uma medida promissora.[13]
Outro desafio significativo é a produção de diferentes tipos de carne. Uma massa uniforme de células não terá a textura certa. A cultura líquida de células em larga escala torna mais fácil a produção de carne triturada em vez de carne estruturada como um bife. A engenharia de tecidos combinada com a bioimpressão 3D está agora a ser otimizada para desenvolver fibras de músculos, gordura e capilares sanguíneas em matrizes de suporte especiais (feitas, por exemplo, de colagénio) para as moldar numa forma e textura apropriadas (figura 3).[14] Duas empresas israelitas revelaram bifes cultivados em laboratório em 2021 e 2018.[15,16] Provavelmente demorará algum tempo até que estes produtos estejam comercialmente disponíveis, pois aumentar a produção com suportes comestíveis e baratos não é tarefa fácil.
Comparações com a carne convencional
Como se compara o impacto ambiental e na saúde da carne cultivada com o da carne convencional?
Um estudo de 2020 comparou as emissões de gases de efeito estufa (GEE) de várias fontes nutricionais e descobriu que a carne bovina tem as maiores emissões de GEE (cerca de 25,6kg de CO2 equivalente em média), muito acima da carne de aves (cerca de 3,35kg de CO2 equivalente) ou da carne de porco (cerca de 5,76kg de CO2 equivalente). Em comparação, as emissões da carne cultivada (cerca de 5,56 kg de CO2 equivalente, em média) foram cinco vezes inferiores às da carne bovina de criação, mas comparáveis ou superiores às da carne de aves e suínos. Sendo uma nova indústria em rápida evolução, as emissões projetadas para a carne cultivada são bastante variáveis, com diferentes pressupostos relativamente à escala e à eficiência da produção, mas uma grande fração das emissões da carne cultivada provém da energia utilizada. Mudando no futuro para fontes de energia mais renovável e uma produção padronizada e eficiente em termos energéticos, poderá potencialmente reduzir a pegada de carbono. Atualmente, o consumo de alimentos à base de plantas é, de longe, a fonte de proteína mais sustentável, com as emissões de carbono do tofu, ervilhas e leguminosas sendo 4 a 17 vezes menores do que a fonte de proteína animal com menor emissão.[4] Na ausência de uma diferença significativa nas emissões de carbono, a carne de aves de criação versus carne de aves cultivada podem ser uma questão de bem-estar animal e não uma opção ambiental.
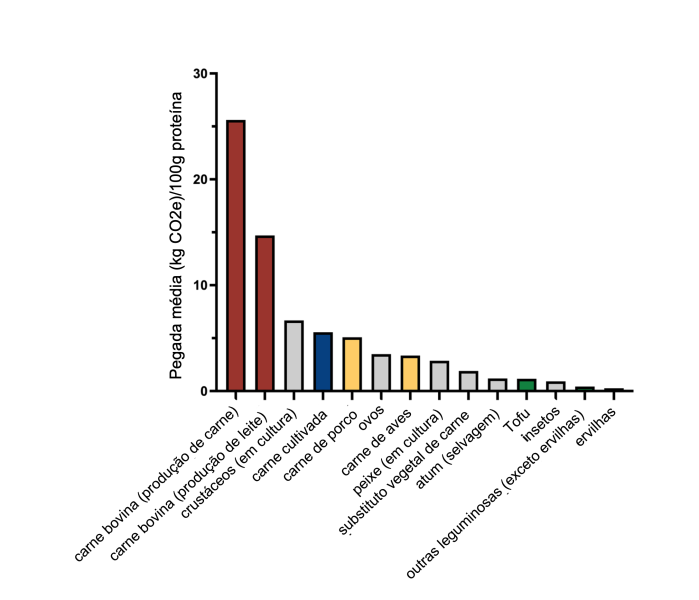
Imagem recriada a partir de dados da Ref. [4].
As condições de esterilidade usadas em culturas celulares reduzem o risco de propagação de zoonoses, que podem ser transmitidas dos animais para os humanos. No entanto, a necessidade de esterilidade é um desafio adicional. O protocolo atual para a carne cultivada baseia-se nos protocolos de segurança praticados na produção dos medicamentos, que requerem técnicas assépticas (incluindo a utilização de plásticos descartáveis) para a manipulação das células e para o fabrico dos meios de cultura, o que aumenta os custos ambientais.
O valor nutritivo da carne cultivada pode variar, dependendo do tipo e das condições de crescimento das células utilizadas para a produzir. Muitas empresas de carne cultivada visam imitar exatamente o sabor e o perfil nutritivo da carne de criação. No entanto, alguns laboratórios estão a explorar formas de melhorar o conteúdo nutritivo da carne, por exemplo, utilizando células modificadas com maior teor de ácidos gordos ómega-3 ou redução do colesterol, para produzir uma carne mais saudável.
Embora o custo de produção de carne cultivada seja agora muito inferior ao dos protótipos iniciais, continua a ser mais elevado do que o da carne convencional, constituindo uma barreira à sua introdução como substituto da carne convencional. O frango cultivado da ‘Eat Just’ custa cerca de US$ 23 em restaurantes, o que é comparável à carne de alta qualidade. O custo elevado é principalmente motivado pelos custos do crescimento celular (principalmente do meio de cultura), pelo que uma maior expansão e métodos de produção mais eficientes poderão reduzir bastante os custos da carne cultivada.
O que se segue agora?
Para além dos aspetos técnicos, o próprio conceito de carne cultivada levanta outras questões. A carne cultivada visa converter aqueles que ainda desejam o sabor da carne, que a comem com frequência e não são grandes fãs de proteína vegetal. Oferece uma opção mais sustentável sem ter que abrir mão do consumo de carne. A agricultura celular abre também uma porta bizarra, mas eticamente questionável, para o cultivo de carne de animais exóticos, como zebra ou tigre (uma empresa do Reino Unido já está a trabalhar nisso). Comercializada como ‘Carne inocente, ‘Carne boa’, ‘Carne limpa’, é possível que a carne cultivada encontre novos consumidores nos vegetarianos ou veganos que abandonaram a carne por razões éticas, o que não representaria necessariamente um ganho ambiental. No entanto, a utilização de células animais em carne cultivada ainda pode ser um fator de divisão. Também há questões em aberto sobre a necessidade de carne cultivada. Uma dieta vegetariana continua a ser a fonte de proteína menos exigente em energia e mais sustentável, e mesmo uma substituição de carne bovina por aves e suínos reduziria o impacto ambiental. No entanto, a alimentação pode ter laços emocionais e culturais complexos, e fazer com que a maior parte do mundo mude para hábitos alimentares mais sustentáveis é crucial para o nosso futuro coletivo. Quaisquer que sejam o seu paladar e valores, esta nova tecnologia poderá potencialmente fornecer novas opções para viver de uma forma mais amiga do planeta e com os animais com quem o partilhamos.
References
[1] Artigo do The Guardian sobre especialistas em alimentos provando os primeiros hambúrgueres sintéticos: https://www.theguardian.com/science/2013/aug/05/world-first-synthetic-hamburger-mouth-feel.
[2] Post MJ (2014) Cultured beef: medical technology to produce food. J Sci Food Agric 94: 1039–1041, doi:10.1002/jsfa.6474
[3] Gerber PJ et al. (2013) Tackling climate change through livestock : a global assessment of emissions and mitigation opportunities. Food and Agriculture Organization of the United Nations (FAO), Rome.
[4] Santo RE et al. (2020) Considering Plant-Based Meat Substitutes and Cell-Based Meats: A Public Health and Food Systems Perspective. Frontiers in Sustainable Food Systems 4. doi:10.3389/fsufs.2020.00134
[5] Segeritz CP, Vallier L (2017) Basic Science Methods for Clinical. Academic Press. ISBN: 9780128030776
[6] O artigo da Reuters sobre a aprovação em Singapura da venda de carne cultivada em laboratório: https://www.reuters.com/article/eat-just-singapore-idINL4N2II0BV.
[7] Lu H et al. (2022) Bioprocessing by Decellularized Scaffold Biomaterials in Cultured Meat: A Review. Bioengineering 9: 787.
[8] Reiss J, Robertson S, Suzuki M (2021) Cell Sources for Cultivated Meat: Applications and Considerations throughout the Production Workflow. International Journal of Molecular Sciences 22: 7513. doi: 10.3390/ijms22147513
[9] Redondo PA et al. (2017) Elements of the niche for adult stem cell expansion. J Tissue Eng 8: 1–18. doi: 10.1177/2041731417725464.
[10] Kinoshita M et al. (2021) Pluripotent stem cells related to embryonic disc exhibit common self-renewal requirements in diverse livestock species. Development 148: dev.199901. doi: 10.1242/dev.199901.
[11] Verma R, Lee Y, Salamone DF (2022) iPSC Technology: An Innovative Tool for Developing Clean Meat, Livestock, and Frozen Ark. Animals 12: 3187. doi: org/10.3390/ani12223187
[12] Su Y et al. (2021) Establishment of Bovine-Induced Pluripotent Stem Cells. Int J Mol Sci 22: 10489. doi:10.3390/ijms221910489
[13] Messmer T et al. (2022) A serum-free media formulation for cultured meat production supports bovine satellite cell differentiation in the absence of serum starvation. Nature Food 3: 74–85, doi:10.1038/s43016-021-00419-1.
[14] Kang DH et al. (2021) Engineered whole cut meat-like tissue by the assembly of cell fibers using tendon-gel integrated bioprinting. Nat Commun 12: 5059. doi:10.1038/s41467-021-25236-9 (2021).
[15] Um artigo no The Guardian sobre um bife impresso em 3D com células-tronco bovinas: https://www.theguardian.com/environment/2021/dec/08/worlds-largest-lab-grown-steak-unveiled-by-israeli-firm.
[16] Um artigo no The Guardian sobre o primeiro bife cultivado em laboratório: https://www.theguardian.com/environment/2018/dec/14/worlds-first-lab-grown-beef-steak-revealed-but-the-taste-needs-work.
Resources
- Assista a um vídeo da BBC sobre os custos ocultos (sociais, económicos e ambientais) de uma dieta vegana.
- Aprenda sobre linhas celulares de carne cultivada.
- Leia um artigo sobre os aspetos culturais e sociais da carne cultivada: Bryant CJ (2020) Culture, meat, and cultured meat. J Anim Sci 98: skaa172. doi: 10.1093/jas/skaa172
- Que proteínas têm a menor pegada de carbono? Leia este artigo da BBC Future para descobrir.
- Ensine sobre a ciência das abelhas e seus produtos açucarados através de uma série de atividades práticas: Scheuber T (2023) To bee or not to bee: the biology of bees and the biochemistry of honey. Science in School 62.
- Aprenda sobre a toxicologia e os efeitos fisiológicos de medicamentos usando Daphnia como organismo modelo: Faria HM, Fonseca AP (2022) From drugs to climate change: hands-on experiments with Daphnia as a model organism. Science in School 59.
- Explore a quimiotaxia e o método científico com bolores viscosos: Buchta A, Dunthorn M (2023) Moving slime: exploring chemotaxis with slime mould. Science in School 62.
- Investigue a resistência aos antibióticos e a descoberta de medicamentos: Fernandez MD, Soler ML, Godinho T (2021) Microbiology: Discovering antibacterial agents. Science in School 55.
- Aprenda sobre a importância do uso de animais na investigação e algumas abordagens de ponta para o minimizar: Schmerbeck S et al. (2021) Organ-on-chip systems and the 3Rs. Science in School 54.
- Descubra mais sobre doenças e agentes patogénicos de plantas: Harant A, Pai H, Cerfonteyn (2023) Plant pathology: plants can get sick too! Science in School 62.
- Leia um artigo sobre os efeitos ambientais das embalagens de alimentos: Barlow C (2022) Plastic food packaging: simply awful, or is it more complicated? Science in School 56.
- Saiba mais sobre a transição para as energias renováveis na Europa: Süsser D (2023) Clean energy for all: can sun and wind power our lives? Science in School 62.