Von der Petrischale auf den Teller: Die Reise von kultiviertem Fleisch Understand article
Essen der Zukunft: Würdest du in einen Reagenzglas-Burger oder ein Petrischalen-Steak beißen? Wie wird Fleisch im Labor gemacht und welche Rolle könnte es für Gesundheit, Landwirtschaft und die Umwelt spielen?
2013 saßen ein Wissenschaftler und zwei Lebensmittelexperten zusammen und bissen im Fernsehen abwechselnd in einen Burger. „Fast wie Fleisch“, „nicht so saftig“, „fühlt sich im Mund wie Fleisch an“; erklärten die Verkoster. [1] Obwohl dieser Burger wohl keine kulinarische Auszeichnung gewonnen hätte, war er definitiv ein Meilenstein der kulinarischen Geschichte. Denn dieses Urteil beschrieb den ersten im Labor gezüchteten Burger der Welt. [2] Er kostete ungefähr $330 000 und brauchte zwei Jahre in der Herstellung. Zehn Jahre später ist eine Realität mit laborbasierter Nahrung auf unseren Esstischen wohl ein kleines bisschen näher gerückt.

Bild: PA Images / Alamy Stock Photo
Emissionen von Vieh machen 14.5 % unserer gesamten Treibhausgasemission aus, hauptsächlich wegen der Methanemissionen von widerkäuenden Tieren. [3] Viehzucht steht im Zusammenhang mit dem Verlust von Biodiversität und benötigt eine Menge Land und Ressourcen, wie zum Beispiel Wasser. [4] Außerdem wirft industrielle Tierhaltung zusätzliche ethische Fragen bezüglich des Tierwohls auf. Tierfreie Fleischalternativen, die hauptsächlich auf Pflanzenprotein aus Quellen wie Tofu oder Hülsenfrüchten basieren, sind für die Versorgung einer umweltbewussten Bevölkerung im Kommen. Im Gegensatz dazu versucht zellkulturbasiertes, kultiviertes Fleisch durch das Kultivieren von tierischen Zellen im Labor, Fleisch genau zu replizieren, anstatt Tiere auf einer Farm aufzuziehen.
Zellen außerhalb eines Organismus zu kultivieren ist in Forschungslaboren bereits seit Jahrzehnten Routine. Zellkulturen sind wichtig, um Hypothesen in ihren Anfangsstadien zu testen, bevor sie in Tiermodellen untersucht werden. Die Produktion von Impfstoffen im großen Maßstab, zum Beispiel gegen Polio oder Windpocken, wird ebenfalls durch Zellkultur erreicht.[5] Zelluläre Landwirtschaft zur Lebensmittelproduktion ist allerdings ein viel neueres Ziel und könnte uns in naher Zukunft ermöglichen, laborgezüchtetes Rindfleisch, Hühnchen oder Meeresfrüchte zu essen. Tatsächlich kann man in Singapur bereits jetzt laborgezüchtete Hühnchenbrust mampfen, wo Eat Just’s kultiviertes Fleisch 2020 die behördliche Zulassung erhielt. [6]
Also, wie macht man einen Burger im Labor?
Fleisch im Labor herstellen
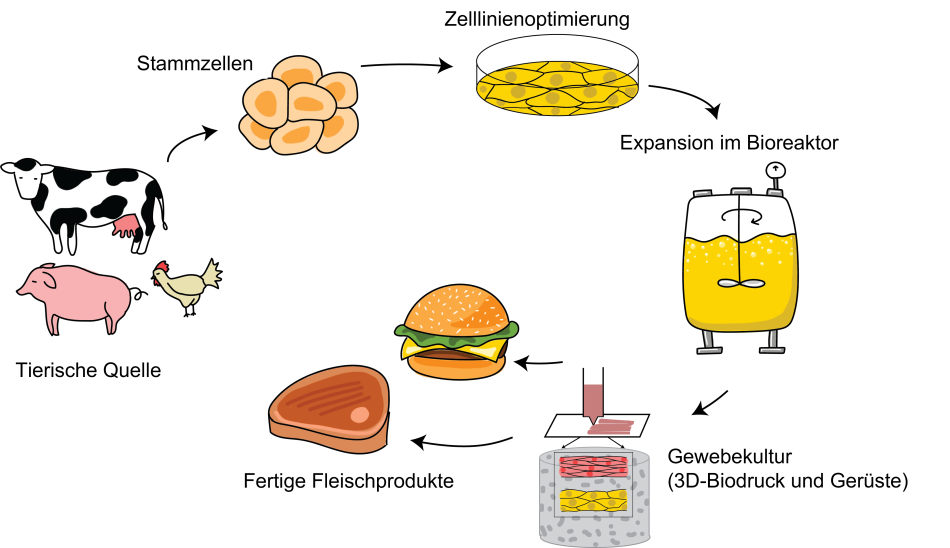
Kurz gesagt beinhaltet die Produktion von kultiviertem Fleisch das Sammeln der richtigen tierischen Zellen, deren Optimierung für ein Wachstum außerhalb des Tieres, das Hochskalieren der Produktion dieser Tierzellen (mit Gewebekulturen, um Tiergewebe nachzuahmen) und schließlich die Herstellung eines Nahrungsmittels daraus. (Abbildung 2).
Die erste Frage ist, welche die richtigen Zellen sind. Fleisch besteht hauptsächlich aus Muskeln, mit proteinreichen Zellen, die in Faserbündeln angeordnet sind. Diese Muskeln und das benachbarte Fettgewebe werden von einem Netzwerk von Blutgefäßen versorgt. Das ideale Startmaterial wären also Zellen, die sich in großem Maßstab vermehren und diese Fleischgewebekomponenten erzeugen können.[8]
Welche Zellen nutzen?
Adulte Stammzellen aus Muskelgewebe sind eine gängige Wahl für Kulturfleisch. Man kann sie aus Gewebeproben (Biopsien) von lebenden Tieren oder aus Gewebe eines geschlachteten Tieres gewinnen (Abbildung 3). Aber diese Zellen können sich in Kultur nur für eine kurze Zeit replizieren, so dass ein ständiger Nachschub an neuen Zellen benötigt wird. [9] Forscher versuchen, adulte Stammzellen mit einer verbesserten Kapazität zur Selbsterneuerung zu entwickeln, aber das ist weiterhin eine Herausforderung. Daher erforschen manche Labore das Potential von pluripotenten Stammzellen (PSCs), genauer gesagt embryonalen Stammzellen (ESCs)[10], oder induzierten pluripotenten Stammzellen (iPSCs), die durch rückentwickeln reifer adulter Stammzellen hergestellt werden. Diese dazu zu bekommen, sich zum richtigen Zelltyp zu differenzieren, ist allerdings schwierig.
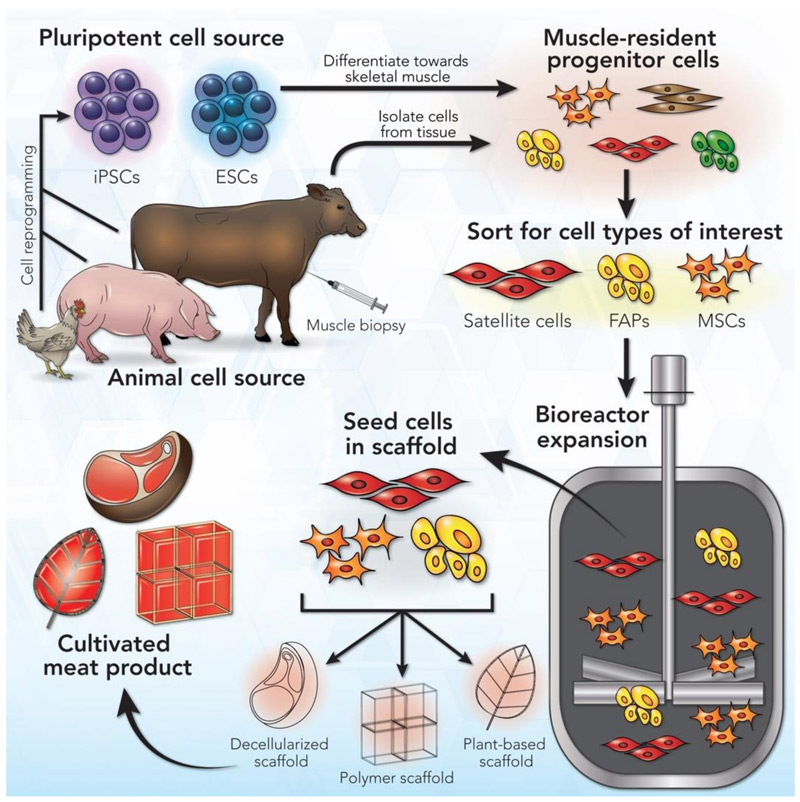
Bild aus Ref.[8], CC BY 4.0
Hochskalieren
Zellkultur im Labor wird normalerweise in flachen Schalen nicht größer als ein Frisbee durchgeführt (Abbildung 4), aber um Zellen für die kommerzielle Lebensmittelproduktion herzustellen braucht man einen riesigen Maßstab. Große Bioreaktoren, die tausende Liter Kultur fassen können, müssen optimale, sterile Bedingungen für Zellwachstum bereitstellen, wie zum Beispiel die richtige Temperatur, CO2-Gehalt, Nährstoffzirkulation und jedes notwendige Gerüst.

Die Zellen werden in flüssigem Medium reich an Nährstoffen wie Aminosäuren, Glukose, Vitaminen und Salzen gezüchtet. [5] Ein gängiger Bestandteil ist fetales Kälberserum (fetal bovine serum, FBS), welches viele Wachstumsfaktoren enthält, die die Zellvermehrung aufrecht erhalten können. FBS wird nach dem Schlachten aus den Feten tragender Kühe gewonnen und sein Einsatz ist daher umstritten. Außerdem ist es teuer und variiert von Charge zu Charge, was es zu einer großen Hürde für ökonomisch und ethisch nachhaltiges Kulturfleisch macht. Als Ersatz können proteinreiche Extrakte aus Mikroorganismen, wie Hefe oder Cyanobakterien, zusammen mit im Labor hergestellten Proteinwachstumsfaktoren eingesetzt werden, aber es ist schwierig, mit diesen Alternativen optimales Zellwachstum zu erreichen. Dennoch untersuchen viele Firmen diese preiswerteren Optionen und einige haben schon angekündigt, sich von der FBS-Nutzung abzukehren. Ein vielversprechender Schritt.[13]
Eine andere beachtliche Herausforderung ist es, verschiedene Fleischstücke herzustellen. Eine unstrukturierte Zellmasse hat nicht die richtige Konsistenz. Mit Flüssigkultur im großen Maßstab ist es einfacher, Hackfleisch herzustellen als strukturiertes Fleisch wie ein Steak. Gewebekulturen kombiniert mit 3D Biodruck werden nun optimiert um auf speziellen Gerüstmatrizen (zum Beispiel aus Kollagen) Muskeln, Fett und Blutgefäße herzustellen und ihnen die richtige Form und Konsistenz zu geben (Abbildung 3).[14] Zwei israelische Unternehmen haben 2021 und 2018 im Labor hergestellte Steaks vorgestellt.[15,16] Es wird aber wahrscheinlich noch eine Weile dauern, bis diese Produkte kommerziell erhältlich sind, da das Hochskalieren der Produktion mit essbaren und preiswerten Gerüsten kein einfaches Unterfangen sind.
Der Vergleich mit konventionellem Fleisch
Wie ist der Einfluss von Kulturfleisch auf Umwelt und Gesundheit im Vergleich zu konventionellem Fleisch?
Eine Studie von 2020 hat die Treibhausgasemissionen von verschiedenen Nahrungsquellen verglichen und kam zu dem Schluss, dass Rindfleisch die höchsten Emissionen verursacht (Median von 25.6 kg CO2 Äquivalenten), weit mehr als Geflügel (ungefähr 3.35 kg CO2 Äquivalente) oder Schweinefleisch (ungefähr 5.76 kg CO2 Äquivalente). Im Vergleich waren die Emissionen von Kulturfleisch (Median von 5.56 kg CO2 Äquivalenten) fünf Mal niedriger als für Rindfleisch aber vergleichbar mit oder höher als Geflügel und Schwein. Da es eine sich schnell entwickelnde Industrie ist, sind Vorhersagen zu Emissionen von Kulturfleisch sehr variabel, da unterschiedliche Annahmen zu Maßstab und Effizienz der Produktion herangenommen werden. Klar ist aber, dass ein großer Teil der Emissionen von Kulturfleisch vom nötigen Energieeinsatz stammt. Eine Verlagerung in Richtung hin zu mehr erneuerbarer Energie und eine standardisierte energieeffiziente Produktion könnten den CO2-Fußabdruck also potentiell verkleinern. Derzeit sind pflanzenbasierte Nahrungsmittel mit Abstand die nachhaltigsten Proteinquellen, da die CO2-Emissionen von Tofu, Erbsen und Hülsenfrüchten 4-17-mal niedriger sind als die am wenigsten emittierende tierische Proteinquelle.[4] Ohne einen signifikanten Unterschied bezüglich der CO2-Emissionen könnte die Entscheidung zwischen Geflügel aus Zellkultur oder Zucht eher eine Frage des Tierwohls als eine Entscheidung für die Umwelt sein.
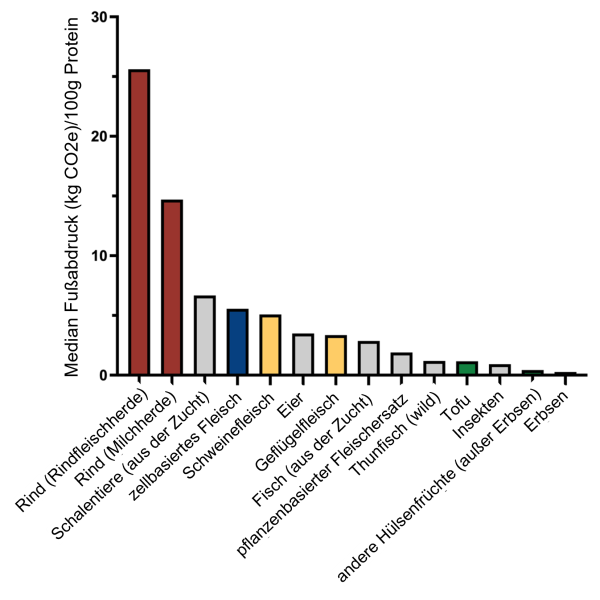
Grafische Darstellung der Daten aus Ref [4].
Die sterilen Bedingungen in der Zellkultur reduzieren das Risiko, zoonotische Krankheiten zu verbreiten, die von Tieren auf Menschen überspringen könnten. Aber die Notwendigkeit von Sterilität ist dennoch eine zusätzliche Herausforderung. Das aktuelle Setup für Kulturfleisch basiert auf Produktionssetups für Therapeutika mit pharmazeutischer Qualität, welche aseptische Methoden bei der Handhabung der Zellen und der Manufaktur der Wachstumsmedien erfordern (wie die Nutzung von Einwegplastik), was die Umweltlast erhöht.
Der Nährwert von Kulturfleisch kann mit dem verwendeten Zelltyp und den Wachstumsbedingungen schwanken. Viele Hersteller von Kulturfleisch versuchen, den Geschmack und das Nährwertprofil von Zuchtfleisch genau nachzuahmen. Aber manche Labore versuchen, den Nährstoffgehalt von Fleisch zu verbessern, zum Beispiel mit Zellen mit erhöhtem Omega-3-Fettsäuregehalt oder reduziertem Cholesterin, und damit das Fleisch gesünder zu machen.
Obwohl die Kosten der Kulturfleischproduktion jetzt viel geringer sind als bei den ersten Prototypen, bleiben sie doch höher als für konventionelles Fleisch, und das ist ein Hindernis für seine Einführung als Ersatz dafür. Eat Just’s Hühnchen kostet um die 23$ im Restaurant, also vergleichbar mit Fleisch der Spitzenqualität. Die hohen Kosten kommen hauptsächlich von den Kosten der Zellvermehrung (hauptsächlich vom Wachstumsmedium), also könnten weiteres Hochskalieren und effizientere Produktionsmethoden die Kosten von Kulturfleisch substanziell senken.
Und was jetzt?
Die technischen Aspekte dahingestellt, wirft das Konzept von Kulturfleisch viel größere Fragen auf. Kulturfleisch zielt darauf ab diejenigen, die es nach dem Geschmack von Fleisch verlangt und die keine großen Fans von pflanzenbasiertem Fleischersatz sind, zu konvertieren. Es bietet eine nachhaltigere Option, für die man nicht darauf verzichten muss, Fleisch zu essen. Zelluläre Landwirtschaft eröffnet außerdem die wunderliche aber ethisch fragwürdige Tür zur Kultivierung von exotischem Tierfleisch, wie Zebra oder Tiger (ein UK-basiertes Unternehmen arbeitet bereits daran). Als ‚unschuldiges Fleisch‘, ‚gutes Fleisch‘, ‚sauberes Fleisch‘ vermarktet, könnte Kulturfleisch neue Verbraucher unter Vegetariern und Veganern finden, die aus ethischen Gründen auf Fleisch verzichten, was nicht unbedingt einen Gewinn für die Umwelt bedeuten würde. Dennoch könnte die Nutzung von tierischen Zellen in Kulturfleisch weiterhin ein spaltender Faktor sein. Es gibt auch offene Fragen zum Bedarf an Kulturfleisch. Eine pflanzenbasierte Ernährung ist und bleibt weiterhin die am wenigsten energieintensive und nachhaltigste Proteinquelle und bereits eine Verlagerung weg vom Rind in Richtung Geflügel und Schwein würde schon unsere Umweltbelastung verringern. Aber Essen kann komplexe emotionale und kulturelle Verbindungen haben und den Großteil der Welt dazu zu bekommen, nachhaltigere Essgewohnheiten anzunehmen, ist entscheidend für unsere kollektive Zukunft. In welche Richtung auch immer dich deine Geschmacksknospen und Werte leiten, diese neue Technologie könnte zusätzliche Möglichkeiten schaffen für eine Lebensweise, die freundlicher ist zu unserem Planeten und den Tieren, mit denen wir ihn teilen.
References
[1] Artikel aus The Guardian darüber wie Lebensmittelexperten die ersten synthetischen Hamburger probieren: https://www.theguardian.com/science/2013/aug/05/world-first-synthetic-hamburger-mouth-feel.
[2] Post MJ (2014) Cultured beef: medical technology to produce food. J Sci Food Agric 94: 1039–1041, doi:10.1002/jsfa.6474
[3] Gerber PJ et al. (2013) Tackling climate change through livestock : a global assessment of emissions and mitigation opportunities. Food and Agriculture Organization of the United Nations (FAO), Rome.
[4] Santo RE et al. (2020) Considering Plant-Based Meat Substitutes and Cell-Based Meats: A Public Health and Food Systems Perspective. Frontiers in Sustainable Food Systems 4. doi:10.3389/fsufs.2020.00134
[5] Segeritz CP, Vallier L (2017) Basic Science Methods for Clinical. Academic Press. ISBN: 9780128030776
[6] The Reuters Artikel darüber, wie Singapur den Verkauf von laborgezüchtetem Fleisch zulässt: https://www.reuters.com/article/eat-just-singapore-idINL4N2II0BV.
[7] Lu H et al. (2022) Bioprocessing by Decellularized Scaffold Biomaterials in Cultured Meat: A Review. Bioengineering 9: 787.
[8] Reiss J, Robertson S, Suzuki M (2021) Cell Sources for Cultivated Meat: Applications and Considerations throughout the Production Workflow. International Journal of Molecular Sciences 22: 7513. doi: 10.3390/ijms22147513
[9] Redondo PA et al. (2017) Elements of the niche for adult stem cell expansion. J Tissue Eng 8: 1–18. doi: 10.1177/2041731417725464.
[10] Kinoshita M et al. (2021) Pluripotent stem cells related to embryonic disc exhibit common self-renewal requirements in diverse livestock species. Development 148: dev.199901. doi: 10.1242/dev.199901.
[11] Verma R, Lee Y, Salamone DF (2022) iPSC Technology: An Innovative Tool for Developing Clean Meat, Livestock, and Frozen Ark. Animals 12: 3187. doi: org/10.3390/ani12223187
[12] Su Y et al. (2021) Establishment of Bovine-Induced Pluripotent Stem Cells. Int J Mol Sci 22: 10489. doi:10.3390/ijms221910489
[13] Messmer T et al. (2022) A serum-free media formulation for cultured meat production supports bovine satellite cell differentiation in the absence of serum starvation. Nature Food 3: 74–85, doi:10.1038/s43016-021-00419-1.
[14] Kang DH et al. (2021) Engineered whole cut meat-like tissue by the assembly of cell fibers using tendon-gel integrated bioprinting. Nat Commun 12: 5059. doi:10.1038/s41467-021-25236-9 (2021).
[15] Ein The Guardian-Artikel über ein 3D-gedrucktes Steak aus Rinderzellen: https://www.theguardian.com/environment/2021/dec/08/worlds-largest-lab-grown-steak-unveiled-by-israeli-firm.
[16] Ein The Guardian-Artikel über das erste laborgezüchtete Steak: https://www.theguardian.com/environment/2018/dec/14/worlds-first-lab-grown-beef-steak-revealed-but-the-taste-needs-work.
Resources
- Sieh dir ein Video der BBC über die versteckten Kosten (sozial, ökonomisch und ökologisch) einer veganen Ernährung an.
- Lern mehr über Kulturfleisch-Zelllinien.
- Lies einen Artikel über die kulturellen und sozialen Aspekte von Kulturfleisch: Bryant CJ (2020) Culture, meat, and cultured meat. J Anim Sci 98: skaa172. doi: 10.1093/jas/skaa172
- Welche Proteine haben den niedrigsten CO2-Fußabdruck? Lies diesen BBC Future Artikel um es herauszufinden.
- Lehre die Wissenschaft hinter Honigbienen und ihren zuckrigen Produkten mit einer Reihe praktischer Aktivitäten: Scheuber T (2023) To bee or not to bee: the biology of bees and the biochemistry of honey. Science in School 62.
- Lerne etwas über die Toxizität und physiologischen Effekte von Drogen mit Daphnia als Modellorganismus: Faria HM, Fonseca AP (2022) From drugs to climate change: hands-on experiments with Daphnia as a model organism. Science in School 59.
- Untersuche Chemotaxis und die wissenschaftliche Methode mit Schleimpilzen: Buchta A, Dunthorn M (2023) Moving slime: exploring chemotaxis with slime mould. Science in School 62.
- Untersuche Antibiotikaresistenz und Medikamentenentwicklung: Fernandez MD, Soler ML, Godinho T (2021) Microbiology: Discovering antibacterial agents. Science in School55.
- Lerne etwas darüber, wie wichtig Tierversuche in der Forschung sind und über hochmoderne Ansätze, um sie zu vermeiden: Schmerbeck S et al. (2021) Organ-on-chip systems and the 3Rs. Science in School
- Finde etwas über Pflanzenkrankheiten und Pathogene heraus: Harant A, Pai H, Cerfonteyn (2023) Plant pathology: plants can get sick too! Science in School 62.
- Lies einen Artikel über die Umweltauswirkungen von Lebensmittelverpackungen: Barlow C (2022) Plastic food packaging: simply awful, or is it more complicated? Science in School 56.