Fumi viola: l’importanza dello iodio Understand article
Tradotto da Valeria Soro. Lo iodio, con i suoi caratteristici vapori viola, ha una miriade di applicazioni – dai comuni disinfettanti alle innovative celle solari.

Immagine per gentile
concessione di Eleanor A
Merritt
Cosa rende lo iodio cosi importante e interessante? Non solo evapora in spettacolari fumi viola, ma incide su molti aspetti della vita sulla terra e sulla civiltà umana. Sapevate, per esempio, che lo iodio protegge le alghe marine dallo stress ossidativo (per esempio dal Sole), previene alcune anomalie congenite nell’uomo, e ha molte applicazioni a livello industriale?
La scoperta dello iodio risale al 19mo secolo e alle guerre Napoleoniche. Con gli Inglesi che assediavano i porti Europei, i Francesi si trovarono di fronte alla carenza di salnitro (KNO3) per la produzione di polvere da sparo. Cosi il chimico Bernard Courtois esplorò la potenzialità delle alghe marine (alghe brune,Laminaria sp.) come risorsa di potassio per questa cruciale sostanza. Aggiunse acido solforico concentrato alle ceneri delle alghe e rimase sorpreso dai bellissimi fumi di colore viola che venivano prodotti.

Gay-Lussac, fisico e chimico
francese, di François
Séraphin Delpech
(1778–1825)
Immagine di dominio pubblico
/ Wikimedia Commons
Nonostante Courtois avesse il sospetto che i suoi vapori viola fossero un nuovo elemento, non aveva abbastanza risorse economiche per continuare le sue ricerche. Furono i suoi colleghi, come Joseph Gay-Lussac, a confermare i suoi risultati e a chiamare l’elemento iodio, dalla parola greca iodes, che significa viola o violetto.
Gay-Lussac continuò a esplorare la chimica dello iodio, e nonostante la guerra, i chimici Francesi trovarono un modo per collaborare con i chimici Inglesi, in particolare con Sir Humphry Davy. Inizialmente, Davy credeva che il vapore fosse un composto del cloro, ma presto concluse che si trattava in realtà di un nuovo elemento.

sono i più forti accumulatori
di iodio tra i sistemi viventi.
Fotografia scattata sulla riva
di Dunstaffnage, vicino Oban,
Scozia, Regno Unito
Immagine per gentile
concessione di FCK
Con l’aiuto della spettroscopia di assorbimento dei raggi X, adesso sappiamo che le alghe accumulano iodio sotto forma di ioduro (I-), che agisce come antiossidante per proteggerle contro lo stress ossidativo causato dall’ozono atmosferico (O3). Questo in qualche modo spiega perché possiamo trovare piccole trace della molecola dello iodio (I2) nell’atmosfera delle regioni costiere e perché l’assunzione di iodio da parte dell’uomo che vive in queste regioni dipende dalla abbondanza delle alghe piuttosto che dalla vicinanza al mare.
Per la maggior parte del secolo successivo, lo iodio continuerà ad essere estratto dalle alghe. Oggi, tuttavia, viene rimosso dalle salamoie contenenti iodio naturale in giacimenti di gas e petrolio in Giappone e America, o dalle caliche cileni (sali di nitrato), che contengono iodato di calcio (Ca(IO3)2). Lo iodio viene commercializzato nella forma solida nero-violaceo.
La chimica dello iodio
Lo iodio appartiene alla famiglia degli alogeni, e quindi condivide la maggior parte delle tipiche caratteristiche degli elementi di questo gruppo. Vista la sua alta elettronegatività, lo iodio forma ioduri con la maggior parte degli elementi nel suo stato di ossidazione convenzionale, -I. Molti composti contenenti ioduro sono frequentemente usati come reagenti nella sintesi organica – soprattutto per la iodinazione, ossidazione e formazione del legame C–C.
Lo iodio presente nell’atmosfera in genere deriva da processi biologici e chimici dell’oceano – come il sistema antiossidante dello ioduro nelle alghe. La maggior parte dello iodio è in definitiva rimosso dall’atmosfera con la formazione delle nubi. Nell’oceano, lo iodio è in genere dissolto e si trova come iodato (IO3–,forma ossidata) e ioduro (I–, forma ridotta). Nello strato esterno della terra (litosfera), la maggior parte dello iodio si trova in sedimenti marini e terrestri; i livelli di iodio sono bassi nelle rocce eruttive.
L’importanza fisiologica dello iodio
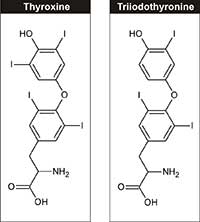
(T4) e triiodotirosina (T3)
Immagine per gentile
concessione di Michael
Zimmermann
Fisiologicamente, lo iodio è un elemento essenziale, richiesto per la sintesi degli ormoni tiroidei – triiodotirosina e tiroxina – che regolano la crescita, lo sviluppo e il metabolismo cellulare. L’assunzione giornaliera raccomandata di iodio per gli adulti è di 150 µg, che può essere assunta attraverso i latticini, alghe e il sale da tavola iodizzato.
Il classico sintomo di carenza di iodio è il rigonfiamento della tiroide (gozzo). Come i livelli di iodio si riducono, la ghiandola pituitaria anteriore secerne crescenti livelli di ormone tireostimolante nel tentativo di massimizzare l’assorbimento di iodio disponibile; questo porta alla crescita eccessiva della ghiandola tiroidea.
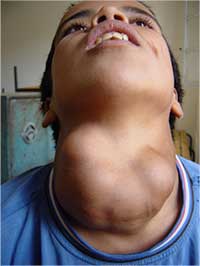
il gozzo causato dalla
mancanza di iodio
Immagine per gentile
concessione di Michael
Zimmermann
Ma l’effetto più dannoso dovuto alla mancanza di iodio si riscontra nello sviluppo del cervello dei bambini, che porta a ritardo mentale. Inoltre, la grave carenza di iodio durante la gravidanza è associata ad una maggiore incidenza della morte prenatale, aborto spontaneo e anomalie congenite.
Il modo più efficace per prevenire la carenza di iodio è aggiungere ioduro di potassio (KI) o iodato di potassio (KIO3) al sale da tavola. Questa pratica di iodizzazione del sale viene effettuata in circa 120 paesi, con il risultato di più del 70% della popolazione mondiale avente a disposizione sale iodato.
L’uso industriale dello iodio
Lo iodio e i suoi composti sono usati in una miriade di prodotti, dal cibo ai farmaci, dal mangime ai catalizzatori industriali. Per esempio, lo iodio è un potente antimicrobico. Per più di un secolo, la tintura di iodio – una miscela di etanolo, acqua, iodio e ioduro di potassio – era usata come disinfettante per le ferite. Questa adesso è stata largamente rimpiazzata da ionofori solubili in acqua (iodio complessato con tensioattivi), che sono meno irritanti per la pelle. Per esempio, iodopovidone, una miscela di polivinilpirrolidone e iodio, è ampiamente usata come disinfettante chirurgico.
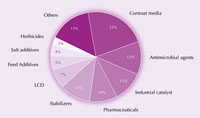
industriale dello iodio
Immagine per gentile
concessione di di Tatsuo Kaiho
Nella produzione industriale di acido acetico, i composti allo iodio come lo ioduro di rodio (il processo Monsanto) o ioduro di iridio (il processo Cativa della BP) sono usati per catalizzare la carbonilazione del metanolo.
Lo ioduro di argento (AgI), usato nelle prime lastre fotografiche, è oggi usato nella inseminazione delle nuvole per avviare la pioggia e per il controllo del clima. Poiché lo AgI ha una struttura cristallina simile al ghiaccio, questo può indurre il congelamento fornendo siti di nucleazione. Questo è stato effettuato durante le Olimpiadi di Beijing nel 2008 per prevenire la pioggia durante la cerimonia di apertura e chiusura.

due generatori di ioduro di
argento sui lati per
l’inseminazione delle nuvole.
Immagine per gentile
concessione di Christian Jansky
/ Wikimedia
Con il suo alto peso atomico (126.9) e un grande numero di elettroni, lo iodio è anche un eccellente assorbente per i raggi X ed è usato come mezzo di contrasto nelle radiografie. Queste sostanze sono sicure tanto da poter essere somministrate nell’uomo e permettono di visualizzare i tessuti molli negli esami radiografici.
Lo iodio è comunemente usato nella produzione di schermi a cristallo liquido delle televisioni, computers e cellulari, che utilizzano pellicole polarizzanti per filtrare la luce. Queste pellicole sono comunemente costituite da strati di alcol polivinilico. Qui, lo iodio agisce come un cross-linker e assicura che la struttura sia polarizzante.
Lo iodio nell’industria energetica

Tricastin, Francia, è situata
vicino ad una regione
densamente popolata.
Approssimativamente ogni
cinque anni, le compresse di
ioduro di potassio sono
distribuite alle persone che
vivono nelle vicinanze della
centrale per prevenire danni
alle ghiandole tiroidee in
caso di incidente nucleare.
Immagine per gentile
concessione di AIEA /
Wikimedia
Lo iodio è usato in una delle più promettenti cellule fotovoltaiche sul mercato per la produzione di ‘energia verde’ a basso costo: cella fotoelettrica costituita da un colorante che trasferisce elettroni al biossido di titanio. È anche conosciuta come cella di Grätzel dal nome del suo inventore, che è composta da elettroliti di poliioduro come strato di trasporto di cariche tra il catodo e l’anodo (per saperne di più, vedi Shallcross et al., 2009).
Dei 37 isotopi conosciuti dello iodio, tutti tranne uno, lo 127I, sono radioattivi. La maggior parte dei radioisotopi, che sono prodotti da reazioni di fissione nelle centrali nucleari e nelle armi, hanno vita breve, ciò ne permette l’uso come traccianti e agenti terapeutici in medicina. Per esempio, gli isotopi dello iodio possono essere usati per visualizzare la ghiandola tiroidea, che assorbe iodio radioattivo quando viene iniettato nel circolo sanguigno.
Sfortunatamente, lo 131I radioattivo, rilasciato da incidenti nucleari – come il disastro di Fukushima, in Giappone, nel 2011 – è anche assorbito dalla tiroide. Poiché emette β-particelle ad alta energia, questo danneggia le cellule e causa il cancro. Per contrastare questo effetto, le compresse allo ioduro di potassio (KI) non radioattivo sono ingerite in modo da saturare la capacità della tiroide di assorbire lo iodio radioattivo.
Questi sono solo alcuni esempi delle diverse applicazioni dello iodio. Chiaramente, nonostante questo elemento sia conosciuto da oltre duecento anni, è ben stabilito nella chimica moderna, fisica e medicina.
lo iodio in aula
Senza dubbio abbiamo tutti preso familiarità con il colorato esperimento della ‘reazione dell’orologio a iodio’ tra perossido di idrogeno, ioduro di potassio, amido e tiosolfato di iodio – ma ci sono molti altri modi di introdurre nella pratica lo iodio a scuola. Per esempio:
- Quando catalizzato dall’acqua, l’alluminio e lo iodio reagiscono per produrre spettacolari nuvole di vapori viola allo iodio.
- In una reazione diretta tra un metallo e un non metallo, la polvere di zinco reagisce con una soluzione di iodio nell’etanolo per formare ioduro di zinco in una reazione di riduzione esotermica.
- Lo ioduro di potassio può essere usato per determinare la presenza di amido in un’ampia varietà di alimenti.
- Diverse soluzioni, incluso lo ioduro di sodio acquoso, può essere elettrolizzato e i prodotti identificati agli elettrodi. Gli studenti possono poi utilizzare la loro esperienza pratica e le conoscenze teoriche per costruire semplici equazioni ioniche.
I dettagli di questi e molti altri esperimenti di classe possono essere scaricati dal sito internetw1 Learn Chemistry.
Ringraziamenti
Questo articolo è stato adattato da una pubblicazione più estesa presente nelAngewandte Chemie International Edition (Küpper et al., 2011).
References
- Küpper FC, Feiters MC, Olofsson B, Kaiho T, Yanagida S, Zimmermann MB, Carpenter LJ, Luther GW, Lu Z, Jonsson M, Kloo L (2011) Commemorating two centuries of iodine research: an interdisciplinary overview of current research. Angewandte Chemie International Edition 50: 11598-11620. doi:10.1002/anie.201100028
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Looking to the heavens: climate change experiments. Science in School 12: 34-39.
Web References
-
w1 – Il sito internet The Learn Chemistry della Royal Society of Chemistry del Regno Unito offre una vasta gamma di fonti scaricabili per supportare l’insegnamento e l’apprendimento della chimica.
Review
In questo breve aggiornamento sull’elemento iodio, gli autori guidano i lettori attraverso la storia e le diverse applicazioni di questo importante elemento, dalla medicina all’industria e alla produzione di energia. I suggerimenti per esperimenti di laboratorio per la scuola aggiungono interesse e fascino a questo tema.
Dato lo stile chiaro e pulito, consiglio questo articolo non solo a insegnanti di scienze Europei ma anche ai loro studenti di età 13-18 anni. Potrebbe anche essere usato nelle lezioni di chimica (la tavola periodica, gli alogeni), biologia (ghiandole endocrine, la tiroide e le sue malattie) e fisica (isotopi, radioattività e celle solari). C’è anche una opportunità interdisciplinare per affrontare la storia della scienza (la scoperta degli elementi), il ruolo degli scienziati nello sviluppo delle armi, o le relazioni tra scienziati di paesi che si oppongono durante i periodi di guerra.
Domande idonee di comprensione del testo includono:
- Dall’articolo si può dedurre che le alghe accumulano iodio:
- per ossidare l’ozono atmosferico
- Per assorbire ozono atmosferico
- per produrre ozono atmosferico
- per proteggersi dall’ozono atmosferico.
- Se non assumiamo abbastanza iodio:
- le nostre ghiandole tiroidee si gonfiano / atrofizzano
- la nostra ghiandola pituitaria anteriore secerne meno / più ormone stimolante la tiroide
Giulia Realdon, Italia





