La plastica nelle automobili: polimerizzazione e riciclo Teach article
Tradotto dalla classe 5B LSSA I.I.S. Badoni A.S. 2017/18. Che tipologie di plastiche vengono utilizzate per la fabbricazione delle autovetture? Come vengono sintetizzate e riciclate? Marlene Rau e Peter Nentwing illustrano due attività tratte dal progetto ‘Chemie in Kontext’.

concessa da Niko Guido /
iStockphoto
Molti adolescenti sono interessati alle automobili, le quali contengono molti differenti varietà di plastiche: polimeri prodotti a partire dal petrolio o da materiali rinnovabili.
L’interesse per le macchine può dunque essere sfruttato per introdurre il tema delle plastiche e dei polimeri, per esempio nelle lezioni di chimica organica.
Fate osservare ai vostri studenti alcune auto.
Cosa sanno già sulle plastiche impiegate per la fabbricazione di auto? Cosa gli piacerebbe scoprire? Potrebbero organizzare le loro conoscenze in funzione delle diverse parti delle autovetture. (Vedere la Tabella 1, sotto riportata)
Tabella 1: L’uso delle plastiche nelle auto
- Le plastiche possono rendere più ecologiche le autovetture? (minore consumo di carburante, riciclo delle componenti plastiche)
- Fari e luci di posizione trasparenti
- Pneumatici estivi e invernali
- Robuste cinture di sicurezza
- Plastiche resistenti al calore vicine al motore
- Gommapiuma nei sedili dell’auto
Il punto principale è che le componenti dell’auto hanno requisiti specifici (es. la cintura di sicurezza deve essere forte ma allo stesso tempo flessibile), il che significa che i loro componenti necessitano di caratteristiche ben precise (es. il materiale non si deve strappare), quindi vanno utilizzati tipi di materiali specifici ( es. polietilene tereftalato). Se gli studenti non dovessero fare autonomamente questi collegamenti, chiedete loro perché una sola tipologia di plastica non sarebbe sufficiente per la costruzione di un’auto.
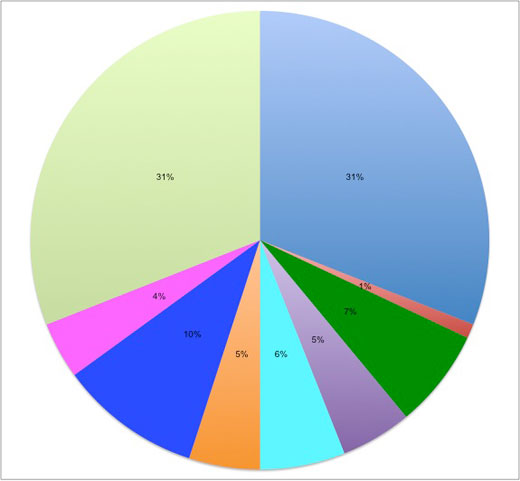
Acrilonitrile butadiene stirene terpolimero: 31%
Polietilene tereftalato: 1%
Policarbonato / polimero acrilonitrile butadiene stirene: 7%
Vetro acrilico: 7%
Polipropilene: 6%
Polibutilene tereftalato: 5%
Poliacetato: 10%
Policarbonato: 4%
Poliammide: 31%
Immagine gentilmente concessa dal Leibniz Institute for Science and Mathematics Education
Le attività in questo articolo si riferiscono a due argomenti della Tabella 1: la plastica usata per le luci posteriori e come viene riciclata la plastica delle automobili. Ciascuna attività prevede un foglio di lavoro e informazioni di base. Le attività fanno parte di un piano didattico più ampio (vedere il r iquadro) adatto a studenti di 16+ anni, che dovrebbero lavorare in gruppi di due o tre. Prevedere una o due lezioni da 45 minuti per ogni attività.
Il progetto ‘Chemistry in context’
‘Chemie im Kontext’ ( Chimica nel contesto) è un progetto coordinato dal Leibniz Institute for Science and Mathematics Education all’Università di Kiel, Germania. Tra il 2002 e il 2008, insegnanti di chimica, altri insegnanti di scienze e rappresentanti delle autorità scolastiche svilupparono unità didattiche per l’insegnamento della chimica per le scuole di ogni ordine e grado, collegando le esigenze curricolari a contesti della vita quotidiana. Esempi di risorse e indicazioni per sviluppare ulteriori materiali sono disponibili onlinew1.Una serie di risorse prodotte dagli insegnanti può essere ordinata gratuitamente, e quattro dei piani di lezione sono liberamente accessibili online (tutti in tedesco). Un libro di testo e una guida per insegnanti (in tedesco) sono pubblicati da Cornelsen Verlag.
Questo articolo è un estratto di uno dei piani di lezione. Il programma completo include sei diverse attività, una per ogni riquadro nella Table 1.
Polimerizzazione: plastica per i fari dell’auto

Immagine gentilmente concessa
da BASF 1998
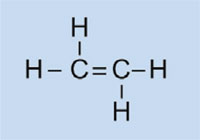
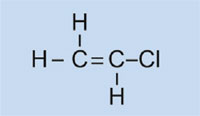
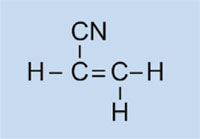
I fari delle auto hanno coperture in plastica in modo da mantenerli puliti e asciutti, e – in alcuni casi – per conferire un colore (per esempio rosso per i fari posteriori e arancione per gli indicatori di direzione). Il materiale usato deve essere trasparente, leggero, colorabile, facilmente modellabile e abbastanza resistente. In questa attività, sintetizzeremo la plastica che viene utilizzata, il polimetilmetacrilato o PMMA.
Il polimetilmetacrilato è comunemente conosciuto come vetro acrilico o plexiglass, e fa parte di una categoria di plastiche chiamate polimerizzati, o polimeri di addizione. La loro caratteristica comune è che le loro unità monomeriche di base contengono uno o più doppi legami. Sotto l’influenza dei radicali (molecole con un elettrone spaiato), queste unità subiscono una polimerizzazione radicalica a dare macromolecole a catena lunga.
Le caratteristiche della macromolecola dipendono dalle sue catene laterali, che a loro volta dipendono dai monomeri utilizzati. Utilizzando monomeri differenti nella formazione di plastiche polimerizzate, possiamo creare plastiche idonee per diverse applicazioni nelle auto. Per esempio, le catene laterali ingombranti del PMMA impediscono alla plastica di formare, mentre solidifica, strutture cristalline che rifrangerebbero la luce. Invece, plastiche amorfe di questo tipo sono trasparenti, il che le rende utili sostituti del vetro: più leggere, più malleabili e meno inclini alla frantumazione.
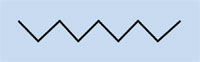
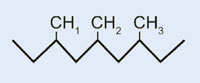
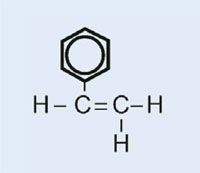
È possibile spiegare la polimerizzazione radicalica prendendo come esempio il serbatoio del carburante delle auto, che è costituito da polietilene. Il polietilene si forma a partire da da monomeri di etene (o etilene, C2H4) per mezzo di una reazione iniziata dal perossido di benzoile. Quando viene scaldato ad una temperatura di 90 °C, il perossido di benzoile si scinde in due radicali. Se uno di questi si lega ad una molecola di etene, il doppio legame dell’etilene si rompe, e si forma un nuovo radicale di dimensioni maggiori. In questo modo ha inizio una reazione a catena, che si ferma solo quando due radicali reagiscono tra di loro.
|
Monomero |
Polimero |
|---|---|
|
Etene
|
Polietilene
|
|
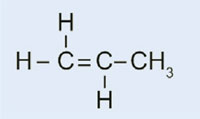
Propene
|
Polipropilene
|
|
Cloruro di vinile
|
Polivinilcloruro
|
|
Stirene
|
Polistirene
|
|
Acrilonitrile
|
Poliacrilonitrile
|
|
Metacrilato di metile
|
Polimetilmetacrilato
|
|
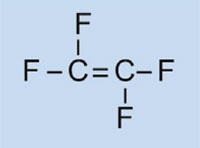
Tetrafluoroetilene
|
Politetrafluoroetilene
|


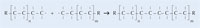
Per gentile concessione del Liebniz Institute for Science and Mathematics Education
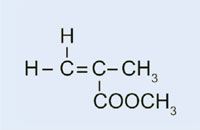
Nel nostro esperimento useremo il perossido di benzoile per dare inizio ad un processo simile: invece di utilizzare etene per produrre polietilene, useremo metacrilato di metile per produrre polimetilmetacrilato.
Foglio di lavoro per studenti 1: sintetizzare un polimero trasparente
Materiali

Immagine gentilmente
concessa da Leibniz Institute
for Science and Mathematics
Education
- 2-metilpropenoato di metile (noto anche come metil-metacrilato; C5H8O2)
- Perossido di benzoile (C14H10O4)
- Colorante Rosso Sudan
- Acqua
- Acetone (propanone, C3H6O)
Attrezzatura per ogni gruppo
- Bilancia
- Piastra riscaldante
- Provetta
- Beaker
- Vetro d’orologio
- Spatola
- Pipetta
- Contenitore di alluminio di un lumino da tè (candela per scaldavivande).
Nota di sicurezza
usare guanti, occhiali protettivi e lavorare sotto cappa. 2-metilpropenoato di metile, perossido di benzoile e acetone sono infiammabili; l’acetone è anche irritante. Tutti e tre devono essere usati con cautela. Il Rosso Sudan avanzato non va gettato nelle acque di scarico
Vedere anche la nota di sicurezza generale.
Procedimento
- Pesare 0.2 g di perossido di benzoile nella provetta.
- Aggiungere 10 ml di 2-metilpropenoato di metile.
- Per colorare la plastica risultante, aggiungere una piccola quantità di colorante Rosso Sudan (abbastanza da coprire la punta della spatola).
- Posizionare la provetta nel beaker pieno di acqua a 90° e metterlo sulla piastra riscaldante; vedere la Figura 3, qui sotto.
sperimentale
Immagine gentilmente
concessa dal Leibniz Institute
for Science and Mathematics
Education
La reazione avverrà in circa 20 minuti, dopo di che la miscela dovrebbe apparire viscosa. Nel frattempo, leggere le informazioni alla voce ‘Polimerizzazione: la plastica per le luci dell’auto’ e determinare il meccanismo di reazione per la polimerizzazione radicalica del 2-metilpropenoato di metile.
- Versare la soluzione nel contenitore di alluminio di una candela per scaldavivande.
Se la plastica inizia a solidificare nella provetta, si può scioglierla di nuovo con l’acetone. Si può quindi continuare l’esperimento come descritto, lasciando un po’ più di tempo per permettere all’acetone di evaporare.
- Coprire il supporto di alluminio con il vetro d’orologio per mantenere calda la plastica e permetterle di indurirsi più velocemente.
- Lasciar solidificare il polimetilmetacrilato per 24 ore, poi rimuoverlo dal supporto di alluminio.
Come verifichereste le proprietà della vostra plastica e come le confrontereste con quelle del vetro?
Riciclare le plastiche delle auto

di diversi combustibili; da
sinistra a destra: olio
combustibile; rifiuti plastici
olefinici; lignite.
Cliccare sull’immagine per
ingrandire Immagine
gentilmente concessa da
Leibniz Institute for Science
and Mathematics Education
In questa attività, gli studenti prima impareranno come le plastiche provenienti dalle auto possano essere riciclate, successivamente proveranno loro stessi a riciclarle: trasformando una bottiglia di plastica in un pezzo di plastica sagomata.
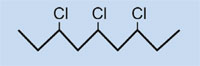
Cosa succede quando abbiamo un’automobile da smaltire? Ci potrebbero venire in mente cumuli di macchine arrugginite e vecchi copertoni destinati alla discarica, ma in realtà molte componenti delle auto vengono riciclate per recuperare risorse pregiate, specialmente metalli.
Le materie plastiche che si trovano in un’automobile possono anche essere riciclate, essenzialmente in tre modi: ancora come parti dell’auto, o come sostanze chimiche o carburante.
- Le automobili possono essere riparate usando vecchie parti di plastica come i paraurti. Ma quando questi componenti invecchiano, comunque, le loro caratteristiche cambiano, rendendoli inappropriati per il riutilizzo: la radiazione solare, per esempio, rende la maggior parte delle plastiche friabili. Fortunatamente, alcune parti plastiche possono essere fuse e rimodellate, ottenendo articoli per i quali i requisiti di qualità sono inferiori, come paletti per recinzioni o panchine da giardino.
- Attraverso processi chimici, alcuni polimeri possono essere scissi nelle loro componenti monomeriche, che tornano quindi disponibili per nuove sintesi. Le plastiche possono anche essere usate per produrre altre risorse per l’industria chimica; per esempio, una tonnellata di determinati tipi di plastiche usate produce circa 600 kg di metanolo, che è un’importante risorsa per le industrie della plastica, ma che viene anche usato per la produzione di energia nelle celle a combustibile.
- Le plastiche tritate possono essere usate direttamente come combustibile, sostituendo petrolio e carbone, per esempio in impianti che trasformano i rifiuti in energia. Queste possono anche rimpiazzare il carbone usato per la produzione di ferro nelle fornaci. (Vedere figura 4.)
Foglio di lavoro per studenti 2: riciclaggio della plastica in classe
In questa attività si riciclerà un rifiuto di plastica come può essere una bottiglia, trasformandola in pezzi di plastica forgiati in forme diverse. Ciò che si può fare è limitato solo dall’immaginazione: portachiavi, pendenti, decorazioni per alberi di Natale.

Immagine gentilmente concessa
da hippokrat / iStockphoto
Materiali necessari per ogni gruppo
- Un becco Bunsen
- Un treppiede con una rete metallica
- Stampini per biscotti di forme diverse
- Un foglio di alluminio
- Un coltello
- Rifiuti di plastica (preferibilmente bottiglie di PET per l’ acqua minerale)
- Un assortimento di coloranti
Nota di sicurezza
Usare occhiali di sicurezza e lavorare sotto la cappa di aspirazione. Non permettere che la fiamma venga a contatto diretto con la plastica. Stare attenti a non tagliarsi.
Leggere anche le note generali sulla sicurezza.
Procedimento
- Utilizzare il coltello per spezzettare i rifiuti di plastica il più finemente possibile.
- Coprire il fondo e i lati delle taglierine per biscotti con il foglio di alluminio e riempirli fino a una profondità di circa 0,5 cm con la plastica spezzettata. Volendo, provare ad aggiungere agli scarti di plastica una piccola quantità di colorante.
- Posizionare gli stampini sulla rete metallica sopra il Bunsen e scaldarli lentamente finché la plastica fonde.
- Una volta che si è raffreddata togliere la plastica e rimuovere il foglio d’alluminio.
Confrontare le caratteristiche della plastica prima e dopo il riciclaggio. Quali conclusioni si possono trarre sul riciclaggio della plastica?
Nel vostro gruppo, discutete i tre metodi di riciclaggio descritti sotto il titolo ‘Ricilare plastica dalle auto’ e confrontate le possibili applicazioni. Riflettete sull’esperimento che avete effettuato: quali sono possibili applicazioni per la vostra plastica?
Studiare le plastiche con i raggi X

Alla European Synchrotron Radiation Facility (ESRF)w2, fibre ad alte prestazioni, come la plastica Kevlar®, sono state studiate per più di dieci anni. Cinque volte più resistente dell’acciaio, a parità di peso, il Kevlar viene impiegato negli pneumatici delle biciclette e nei giubbotti antiproiettile, nelle vele da regata e nei cavi da ormeggio.
Molto del lavoro della ESRF sulle fibre ad alte prestazioni riguarda la loro morfologia skin-core: le differenze strutturali tra gli strati esterni della fibra e il suo centro.
Queste differenze possono influenzare le proprietà meccaniche della fibra, quindi la comprensione della morfologia skin-core potrebbe permetterci di modificare in modo mirato le proprietà delle fibre durante il processo di produzione.
EI raggi X microfocalizzati della ESRF vengono usati di routine per nuovi studi su questi materiali eccezionali, sia per la ricerca accademica che per quella industriale. Questo perché nessun’altra tecnica fornisce simili informazioni senza sezionare le fibre, e quindi alterarne potenzialmente la struttura interna. Per maggiori informazioni, vedere Capellas Espuny, 2009.
ESRF è un membro di EIROforumw3, l’editore di Science in School.
References
- Capellas Espuny M (2009) A new look into fibre-reinforced composite materials. ESRF News 50: 12-13. www.esrf.eu/UsersAndScience/Publications/Newsletter
Web References
- w1 – Per ulteriori informazioni sul progetto (in inglese e in tedesco) e per scaricare le risorse online (in tedesco), visitare il sito di Chemie im Kontext www.chik.de
- w2 – ESRF, un centro internazionale di ricerca a Grenoble, Francia, produce fasci di raggi X ad alta intensità, dei quali usufruiscono ogni anno migliaia scienziati da tutto il mondo . Per ulteriori informazioni vedere: www.esrf.eu
- w3 – Per ulteriori informazioni su EIROforum, vedere: www.eiroforum.org
Resources
- Per saperne di più sul progetto ‘‘Chemie im Kontext’, vedere:
-
Parchmann I et al. (2006) Chemie im Kontext: a symbiotic implementation of a context-based teaching and learning approach. International Journal of Science Education 28(9): 1041-1062
-
Nentwig P et al. (2007) Chemie im Kontext: situated learning in relevant contexts while systematically developing basic chemical concepts. Journal of Chemical Education 84: 1439
-
- Per un’attività teatrale in classe basata sulla polimerizzazione radicalica dell’etene per ottenere il polietilene, vedere:
-
Sturm B (2009) Lo spettacolo della scienza. Science in School 13.
-
- Per saperne più sulla ricerca nel campo delle plastiche biodegradabili, vedere:
-
Bradley D (2007) Plastica, naturalmente. Science in School 5.
-
Review
La chimica è solitamente vista dagli studenti come distante e pericolosa, ma noi ne siamo circondati ed essa gioca un ruolo fondamentale nel miglioramento della qualità della nostra vita. Attività come quelle descritte in questo articolo, che impiegano materiali di uso quotidiano, possono aiutare a migliorare la considerazione generale della chimica e ad incoraggiare l’interesse da parte degli studenti.
Queste attività possono essere utilizzate nelle lezioni di chimica organica e in biologia, per discutere dell’importanza del riciclaggio. Anche se gli autori suggeriscano queste attività per studenti di 16+ anni, possono essere usate anche da studenti più giovani (14+ anni).
Mireia Guell Serra, Spagna