Supporting materials
Download
Download this article as a PDF

Traduzione di Monica Mauri, Tutti abbiamo sentito dire che una dieta ricca di cibi antiossidanti è molto salutare. Gianluca Farusi ed i suoi studenti hanno confrontato i livelli di antiossidanti presenti in una serie di alimenti e bevande.
Molti problemi di salute, tra i quali l’arteriosclerosi, gli attacchi cardiaci, il morbo di Alzheimer, alcuni tipi di tumore e le cataratte senili, sono associati a molecole molto reattive chiamate radicali liberi. Queste molecole si producono normalmente durante la respirazione aerobica, e vengono utilizzate dall’organismo, ad esempio, come difesa dai microrganismi.
Tuttavia, un rapporto non equilibrato tra radicali (ossidanti) e antiossidanti, può portare alla malattia
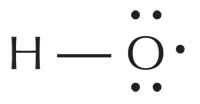
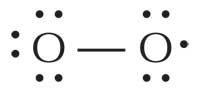
I radicali liberi sono così reattivi in quanto essi possiedono uno o più elettroni spaiati. Vengono prodotti e si trovano in molte cellule e organelli cellulari; l’anione radicale superossido (O2–), per esempio, è il radicale più comune nell’organismo, poiché viene utilizzato dai globuli bianchi per attaccare virus e batteri. Tuttavia, quello di gran lunga più reattivo è il radicale ossidrile (HO·), che si trova nel perossisoma (dove vengono scomposti gli acidi grassi) e nel reticolo endoplasmatico. Anche fattori esterni possono influenzare la produzione di radicali; per esempio l’esposizione ai raggi ultravioletti (UV) provoca la formazione di radicali ossigeno nello stato di singoletto (1ΔO2·).
Nell’organismo, i radicali liberi possono portare ad una varietà di problemi. In particolare, essi reagiscono – danneggiandoli – con lipidi, proteine e acidi nucleici, DNA compreso (Arking, 2006). Per proteggersi dai continui attacchi radicalici, il nostro corpo ha due fondamentali forme di protezione: enzimatica e non-enzimatica. I più importanti enzimi che utilizziamo per difenderci dagli attacchi dei radicali liberi sono gli enzimi antiossidanti superossido-dismutasi, catalasi e glutatione-perossidasi. I principali antiossidanti non-enzimatici sono la melatonina, l’ α-tocoferolo (vitamina E), l’acido ascorbico (vitamina C) e il β-carotene (precursore della vitamina A).
Tutti e quattro gli antiossidanti non-enzimatici sono essenziali nella dieta, e si trovano in una varietà di alimenti. Il cancro, in particolare, ha una minore incidenza tra coloro i quali mangiano molta frutta e verdura, e si è ipotizzato che i benefici sulla salute siano dovute agli antiossidanti che esse contengono (Polidori et al., 2009; Swirsky Gold et al., 1997), che contrastano gli effetti dannosi dei radicali liberi. Allo stato attuale, ci sono poche prove che gli integratori di antiossidanti (es. compresse) abbiano qualche effetto benefico.
L’esperimento sotto riportato confronta i livelli di antiossidanti in diversi tipi di alimenti e bevande, cioè l’efficacia dei diversi tipi di cibi e bevande nel combattere i radicali, cioè come “spazzini di radicali”.
Per educare i miei alunni diciassettenni ad uno stile alimentare responsabile, nella speranza di ridurre il loro rischio di sviluppare le malattie precedentemente menzionate, ho messo a punto un’attività basata sulla reazione di Briggs-Rauscher: una reazione oscillante nella quale si alternano la fase radicalica gialla e quella non-radicalica blu.
Aggiungendo campioni di differenti tipi di cibi e bevande alla reazione e misurando gli intervalli di tempo tra le due colorazioni, gli studenti potevano confrontare l’efficacia dei campioni nell’eliminazione dei radicali. Naturalmente si tratta di una valutazione relativa, e non assoluta. Una cosa alla volta…
Soluzione di perossido di idrogeno 4 M: versare 400 ml di acqua distillata in una beuta da 1 l. Indossando i guanti, aggiungere 410 ml di perossido di idrogeno al 30%. Diluire con acqua distillata fino a 1.0 l.
Soluzione 0.20 M in potassio iodato e 0.077 M in acido solforico: porre 43 g di potassio iodato e circa 800 ml di acqua distillata in una beuta da 1 l. Aggiungere 4.3 ml di acido solforico concentrato. Riscaldare ed agitare la miscela fino alla dissoluzione dello iodato di potassio. Diluire la soluzione con acqua distillata fino al volume di 1.0 l.
Soluzione 0.15 M in acido malonico e 0.20 M in solfato di manganese: sciogliere 16 g di acido malonico e 3.4 g di solfato di manganese(II) monoidrato in circa 500 ml di acqua distillata in una beuta da 1 l. In un beaker da 100 ml, portare ad ebollizione 50 ml di acqua distillata. In un beaker da 50 ml, mescolare 0.30 g di amido solubile con circa 5 ml di acqua distillata ed agitare la miscela per formare una poltiglia. Versare la poltiglia nell’acqua bollente e continuare a scaldare ed agitare la miscela fino alla dissoluzione dell’amido. Versare la soluzione di amido nella soluzione di acido malonico e solfato di manganese(II). Portare la miscela al volume di 1.0 l aggiungendo acqua distillata.
Campioni di cibo: per preparare campioni di cibo in soluzione acquosa o in sospensione, mettere 2.0 g in un beaker da 400 ml. Aggiungere 100 ml di acqua distillata e agitare con una bacchetta di vetro. Decantare, versarne una porzione in una provetta e centrifugare. Per le bevande, quali caffè o vino, prenderne 2.0 ml, aggiungere 100 ml di acqua distillata e agitare.
In un beaker da 100 ml contenente un agitatore magnetico (o ancoretta), introdurre, utilizzando delle pipette: 10 ml di soluzione acquosa di perossido di idrogeno 4 M, 10 ml della soluzione acquosa di iodato di potassio 0.20 M e acido solforico 0.077 M, e 10 ml della soluzione acquosa di acido malonico 0.15 M e solfato di manganese 0.20 M. Far partire l’agitazione magnetica. Quando la soluzione gialla diventa blu per la seconda volta, aggiungere 1 ml di cibo in soluzione o in sospensione. Un video dei cambiamenti di colore è disponibile onlinew2.

La reazione di Briggs-Rauscher è una reazione oscillante – cioè, una reazione in cui una miscela di sostanze chimiche effettua una serie di cambiamenti di colore che si ripete periodicamente. L’esatto meccanismo della reazione è ancora oggetto di studio, ma la natura delle oscillazioni è sufficientemente chiara. Per quelli che sono gli scopi di questo articolo, è sufficiente sapere che finché il processo radicalico mantiene la concentrazione dell’intermedio HIO superiore alla concentrazione dell’intermedio I–, la soluzione rimane gialla; quando ha luogo il processo non-radicalico, [I–] è maggiore di [HIO] e lo ione ioduro si combina con I2 per formare un complesso blu con l’amido. Una descrizione maggiormente dettagliata della reazione può essere scaricata dal sito web di Science in Schoolw1.
Poiché noi aggiungiamo la soluzione o sospensione di cibo dopo la seconda fase blu, quando la fase non-radicalica sta terminando e quella radicalica sta per partire, più lungo è l’intervallo di tempo tra la seconda e la terza fase blu, maggiore è il potere antiossidante del cibo. In altre parole, il cibo ha reagito con i radicali prodotti e la reazione impiega più tempo per produrre radicali in numero sufficiente da permettere alla reazione oscillante di continuare.
Abbiamo impiegato molto tempo per determinare le migliori concentrazioni di cibi o bevande da utilizzare, poiché soluzioni troppo diluite abbassavano la capacità antiossidante, e soluzioni troppo concentrate aumentavano i tempi di reazione così tanto che non era possibile effettuare un numero di prove statisticamente significativo nel corso della lezione.
Sia l’acido malonico che lo iodio (che si forma nel corso della reazione) possono irritare la pelle, gli occhi e le mucose: per questa ragione la reazione deve essere effettuata sotto cappa.
Poiché il perossido di idrogeno al 30% è un agente ossidante molto forte, bisogna indossare occhiali protettivi, camice e guanti. Bisogna evitare qualunque contatto tra perossido di idrogeno e materiali combustibili.
L’acido solforico è un forte disidratante; bisogna indossare occhiali protettivi, camice e guanti.
Per smaltire in modo sicuro la miscela di reazione alla fine dell’esperimento, aggiungere lentamente tiosolfato di sodio (Na2S2O3) ai prodotti di reazione, finché lo iodio in eccesso non si trasforma in ioni ioduro incolori (la reazione è piuttosto esotermica).
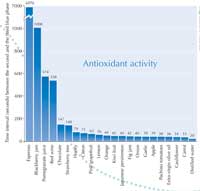
L’esperimento realizzato con i miei studenti ha rilevato la maggiore attività antiossidante nel caffè espresso: 6970 secondi. Vedere il grafico a destra.
Maggiori dettagli sui nostri risultati possono essere scaricati dal sito web di Science in Schoolw1. La Tabella 1 riporta gli alimenti che abbiamo testato, l’attività antiossidante (intervallo di tempo) e le principali sostanze che si presumono responsabili di questa attività.
Cosa possiamo quindi dedurre dai risultati? Chiaramente, una dieta costituita da solo espresso potrebbe presentare livelli elevati di antiossidanti, ma sarebbe tutt’altro che salutare. La realizzazione di questa attività con i miei studenti, ha portato ad una trattazione particolareggiata delle reazioni radicaliche. A seguire sono riportate alcune domande che potrebbero essere utilizzate per avviare una discussione.
Questo è un eccellente articolo che sottolinea l’importanza della chimica nel comportamento dei sistemi biologici. È importantissimo far comprendere ed apprezzare la multidisciplinarietà della conoscenza scientifica. Insegnanti e studenti potrebbero usare questo articolo per attività pratiche durante lezioni di chimica, biochimica, scienza degli alimenti o di scienza della salute. Potrebbe anche costituire la base di progetti per fiere della scienza.
Omettendo la parte sperimentale, l’introduzione, la discussione ed i risultati potrebbero costituire delle solide basi per un esercizio di comprensione. Delle domande appropriate, che potrebbero essere utilizzate per stimolare una discussione su cibo e salute, o sulla chimica nella vita quotidiana, potrebbero comprendere:
Marie Walsh, Irlanda
Download this article as a PDF