La lumière vivante : chimie de la bioluminescence Teach article
Traduit par Maurice Cosandey. Comment illuminer vos leçons de chimie à l’aide de la bioluminescence.

Photo Chris Favero. Source de
l’image : Flickr
Les spectacles de bioluminescence sont l’une des merveilles de la nature. Depuis des millénaires, les gens ont été fascinés par la danse des vers luisants, ou par les vagues bleues du plancton marin. Cette fascination est toujours pareille de nos jours, mais aujourd’hui la chimie permet d’expliquer ce qui se passe, et de l’utiliser dans nos laboratoires.
Il existe une grande variété d’organismes qui produisent de la lumière, que ce soit des insectes, des poissons, des mollusiques ou des bactéries. L’écrivain romain Pline l’Ancien avait déjà observé que la crevette Pholas dactylus émet de la lumière quand on la mange. Il avait aussi note que le lichen Omphalotus olearius est lumineux de nuit.
Mais les spectacles les plus fabuleux dus à la bioluminescence proviennent du plancton de dinoflagellés, qui rendent les vagues de l’océan lumineuses de nuit. On trouve des formes exotiques de bioluminescence dans les profondeurs obscures des fosses océaniques. Le poisson angler utilise un éperon lumineux pour attirer ses proies.

pyralis
Photo Terry Priest. Source de
l’image : Flickr
La bioluminescemnce, qui est donc la lumière produite par les êtres vivants, est assez répandue dans la nature. Mais dans quel but ? En fait, il y en a beaucoup :
- Produire un aspect repoussant ou toxique. Exemple : les vers luisants Photinus ignitus, et Lucidata atra
- Effrayer les prédateurs en émettant un bref éclair lumineux. Exemple : Poisson-lanterne.
- Attirer un partenaire sexuel. Exemple : les vers luisants.
- Attirer les proies dans l’obscurtié. Exemple : poisson angler.
- Disparaître à la vue. Vu de dessous, un poisson nageant à surface de l’eau paraît moins sombre s’il est lumineux, donc les prédateurs le voient moins bien. Exemple : le calmar Abralia verany.
Couleurs luisantes
La bioluminescence peut produire différentes couleurs, mais surtout le bleu, le vert et le jaune. La couleur dépend de l’environnement. Le bleu est favorisé par les animaux vivant dans les profondeurs de l’océan, le vert près des côtes: Sur terre ferme et en eau douce, c’est le jaune et le vert qui sont favorisés.
On peut se demander quelle est la réaction chimique qui conduit à l’émission de lumière. Et comment obtient-on des couleurs différentes?
Chimiquement parlant, la bioluminescence est due à l’oxydation de substances dites luciférines, qui dégagent de l’énergie sous forme de lumière. Ces réactions sont catalysées par des enzymes dites luciférases. Après oxidation, les luciférines forment des oxyluciférines. La table 1 présente les luciférines propres à certaines espèces et les oxyluciférines correspondantes.
|
Espèce bioluminescente |
Nom de la luciférine |
Nom de l’oxyluciférine |
|---|---|---|
|
Dinoflagellés |
Luciférine des dinoflagellés C33H3806N4Na2 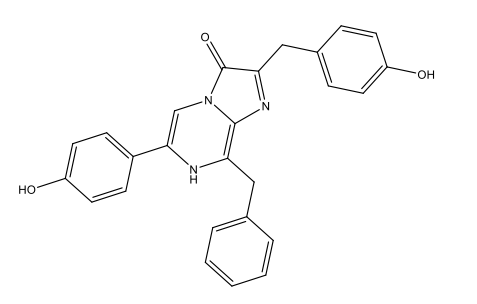 |
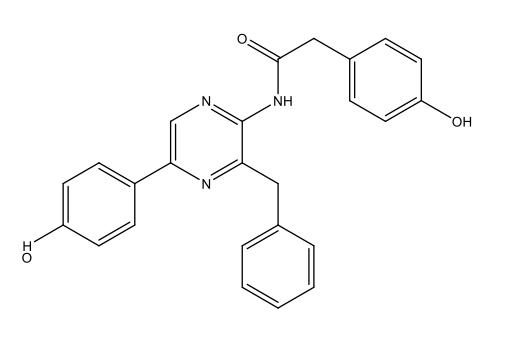 |
|
Calmar, crevettes |
Coelenterazine C26H2103N3 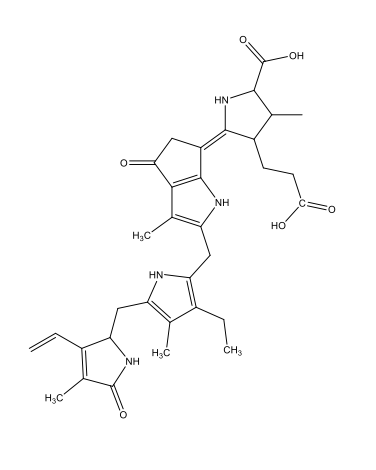 |
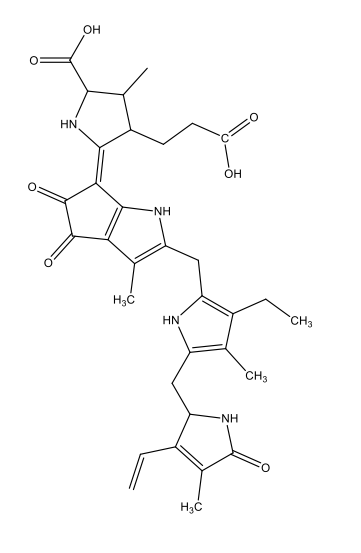 |
|
Vers luisants |
Luciférine des vers luisants C11H8N2O3S2 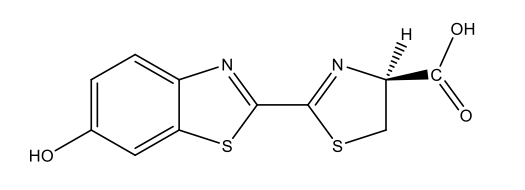 |
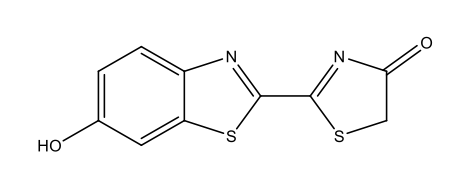 |
Ces réactions sont extrêmement efficaces, car 98% de l’énergie disponible est émise sous forme de lumière. C’est bien mieux que les lampes électriques à filament, dont le rendement énergétique n’est que de 2%, le reste étant perdu sous forme de chaleur.
Quelques luciférines peuvent produire de la lumière de plusieurs couleurs. Voir table 2. Et il existe des substances, dites fluorophores, qui changent la couleur de la luminescence. C’est le cas de la méduse Aequora Victoria, qui contient un fluorophore connu sous le nom de protéine fluorescente verte (GFP).Cette GFP absorbe la lumière bleue émise par la réaction initiale, et la réemet sous forme de lumière verte. Donc la dite méduse produit une bioluminescence verte.
|
Luciférine |
Maximum de luminescence |
Couleur approchéew1 |
|
|---|---|---|---|
| Ver luisant | 560 (at pH=7.1) | Vert |
 |
| 615 (at pH=5.4) | Orange |
 |
|
| Luciférine bactérielle | 490 | Turquoise |
 |
| Luciférine de flagellé | 474 | Bleu |
 |
| Coelenterazine | 450-480 as an anion | Bleu-vert |
 |
| 400 in the –COOH form | Violet |
 |
|
Ce système de bioluminescence a trouvé récemment un usage en biologie : le gène qui encode la GFP est maintenant utilisé comme “etiquette” génétique pour tracer une protéine spécifique et révèler les gènes qu’elle exprime. Comme la GFP émet dans le vert sous éclairage bleu ou UV, elle est très facile à détecter (voir Furtado, 2009). Ce travail a valu le Prix Nobel de chimie 2008 à son auteurw2.
Heureusement pour nous, il est facile d’effectuer en laboratoire les réactions chimiques qui causent la bioluminescence, comme on va le voir ci-dessous.
Une exérience d’étudiant : observer la bioluminescence
Dans cette activité, les étudiants peuvent observer une réaction qui émet de la lumière quand on mélange deux réactifs. L’ingrédient principal est le luminol, une substance synthétique qui produit de la lumière bleue, quand elle réagit chimiquement. La lucifèrine et le luminol sont différents, mais le résultat visible est le même. malgré que le catalyseur soit le ferricyanure plutôt qu’un enzyme. Pour plus de details, voir Welsh, 2011.
L’étape finale de cette expérience doit être effectuée dans l’obscurité, pour mieux observer l’émission de lumière.
Matériel
- 1 g luminol (5-amino-2,3-dihydrophthalazine-1,4-dione)
- 50 ml solution d’hydroxide de sodium (NaOH) 10% en poids
- 50 ml solution de ferricyanure de potassium (K3[Fe(CN)6]) 3% en poids
- Environ 0.5 g ferricyanure de potassium (K3[Fe(CN)6])
- 3 ml peroxyde d’hydrogène (H2O2) 30%
- Eau distillée
- Des béchers
- Un entonnoir
- Des cylindres gradués
- Un flacon
Mode opératoire
Note de sécurité
Les lunettes de protection, une blouse et des gants doivent être portés. Attention en manipulant H2O2 qui réagit violemment en présence de catalyseur. Fermer le flacon aussitôt après le prélèvement des 3 mL nécessaires.
Consultez aussi la notice générale de sécurité de Science in school.
- Dissoudre 1 g luminol dans un bécher contenant 450 mL eau distillée.
- Ajouter 50 mL de solution de NaOH à 10%, et mélanger.
- Verser 50 mL de la solution résultante dans un autre bécher et y ajouter 350 mL eau distillée. Cela donne la solution A.
- Verser 50 mL de ferricyanure de potassium à 3% dans un 3ème bécher contenant 350 mL eau distillée et 3 mL de peroxyde d’hydrogène 30%. Cela donne la solution B.
- Prélever des volumes égaux des solutions A et B dans 2 cylindres séparés.
- Mettre un peu de ferrocyanure de potassium dans le flacon équipé d’un entonnoir.
- Place le flacon dans l’obscurité.
- Verser les solutions A et B en même temps dans le flacon. Observer.
La solution se met aussitôt à émettre une vive lumière bleue.
- Elimination. Chauffer et évaporer la solution sous ventilation de manière à réduire son volume au 1/8 de sa valeur initiale. Jeter le résidu dans le bidon des résidus de solutions métalliques.
Que s’est-il passé?
L’oxydation du luminol se produit en plusieurs étapes
- Quand on prépare la solution A (étape 2), le luminol réagit avec la base OH–.
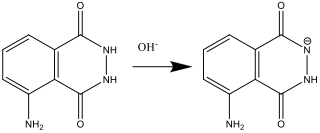
- Quand on prepare la solution B (étape 4), le peroxide d’hydrogène forme l’anion radicalaire superoxide O2–. Cette reaction est catalysée par l’ion hexacyanoferrate(III)
- Quand on mélange les solutions A et B (étape 8), le luminol est oxydé en anion radicalaire par l’ion hexacyanoferrate(III)
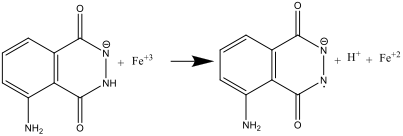
L’oion hexacyanoferrate(III) joue ici à la fois le rôle de catalyseur pour la formation de l’ion radicalaire superoxide O2– et celui d’oxydant du luminol. Le fer doit être present sous forme d’un complexe comme [Fe(CN)6]3-, afin de prévenir la formation d’un précipité Fe(OH)3 en milieu fortement basique.
- L’anion radicalaire luminol réagit alors avec l’anion radicalaire superoxyde O2–:
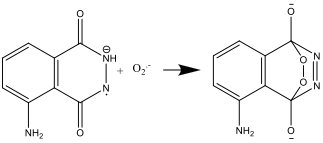
- Le composé résultant est instable et se décompose en azote et une forme excitée de l’ion aminophtalate:
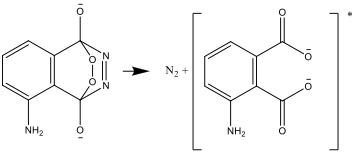
- La forme excitée se désexcite ensuite en une forme stable, et la différence d’énergie est émise sous forme de lumière.
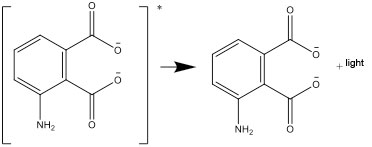
Questions pour une discussion
- D’où vient l’énergie émise sous forme de lumière dans la reaction du luminol?
- Quel est le rôle du ferricyanure de potassium ? Dans la bioluminescence, quelle substance joue ce role?
- Quelle substance joue le rôle d’oxydant dans la reaction du luminol ? Est-ce la meme que dans la nature?
Extensions possibles
Il existe beaucoup d’informations au sujet de la bioluminescence. Voir la section des ressources par exemple. Les élèves peuvent effectuer leurs propres recherches dans les domaines suivants:
- Emploi de la bnioluminescence dans la nature. Identifier quelques espèces pour qui l’adaptation à la bioluminescence est bénéfique, voire essentielle.
- Chimie de la bioluminescence. Découvrir quelques réactions naturelles de chimiluminsexence. En quoi ressemblent-elles à celle du luminol?
- Couleurs de la biuoluminescence. Comment ces couleurs sont-elles produites?
- Evolution de la bioluminescence. Ce phénomène s’est-il produit souvent?
- Investigations criminelles. Illustrer comment le luminol est utilisé en police scientifique, et à l’aide de quelles réactions chimiques. Voir Welsh, 2011.
Etudier la chimie selon Pline l’Ancien
Cette activité fait partie d’un vaste projet interdisciplinaire, développé avec des élèves de 14 et 15 ans, pour explorer les techniques scientifiques de l’Antiquité. Pline l’Ancien (23 – 79 ap. J.-C.) est l’auteur de l’encyclopédie Naturalis Historia, qui rassemblait l’ensemble des connaissances scientifiques de l’époque. L’analyse de ce texte en classe est toujours suivie d’une tentative de recréer l’expérience décrite ou quelque chose de similaire.
En fait, les élèves sont presque dans le même état d’esprit scientifique que Pline. Mais la discussion et l’expérience leur donnent une meilleure connaissance de la réalité. Cette approche a motivé même les élèves non scientifiques.
D’autres activités ont été inclues dans ce projet, comme la synthèse de l’indigo (Farusi, 2012), celle des anciens parfums (Farusi, 2011), ou celle de l’encre à base de galle (Farusi, 2007). L’ensemble du projet a été présenté au festival de Science on Stagew3 qui s’est tenu à Copenhague, Danemark, en 2011.
References
- Farusi G (2007) Monastic ink: linking chemistry and history. Science in School 6: 36-40
- Farusi G (2011) Smell like Julius Caesar: recreating ancient perfumes in the laboratory. Science in School 21: 40-46
- Farusi G (2012) Indigo: Comment recréer le colorant des pharaons. Science in School 24: 40-46
- Furtado S (2009) Painting life green: GFP. Science in School 12: 19-23
- Welsh E (2011) What is chemiluminescence? Science in School 19: 62-68
Web References
- w1 – La référence convert a wavelength in nanometres to an RGB or hexadecimal colour est disponible sur le site gratuit Academo, avec d’autres ressources éducatives.
- w2 – L’attribution du Prix Nobel à Osamu Shimomura, Martin Chalfie et Roger Tsien se trouve sur le site 2008 Nobel Prize for Chemistry.
- w3 – Science on Stage est un réseau d’événements locaux, nationaux et internationaux à l’intention des maîtres. Il a été lancé en 1999 par EIROforum, qui est l’éditeur de Science in School. Chaque pays sélectionne les maîtres qui ont le mieux innové leur enseignement de science et les envoie au prochain festival international de Science on Stage. 25 pays y sont représentés avec en tout 350 maîtres de science de niveau primaire et secondaire, qui présentent chacun leurs innovations.
Le prochain festival international se tiendra du 29 juin au 2 juillet 2017 à Debrecen, en Hongrie. On attend des participants de 25 pays. Les maîtres des science qui seraient intéressés d’y participer voudront bien contacter leur comité national.
Resources
- Voici deux articles accessibles au sujet de la bioluminescence :
- Douglas P, Garley M (2010) Chimie et Lumière. Science in School 14: 63-68
- Judson O (2015) Luminous life. National Geographic
- Et voici une charmante animation informative: animation about bioluminescence
- Une vidéo musicale: the extraordinary beauty of ocean bioluminescence
- Une vidéo courte sur la synthèse: how to make luminol
- Une vidéo plus longue: how to make luminol
Institutions
Science on StageReview
La bioluminescence a fasciné les gens pendant des milliers d’années. Elle continue à faire l’objet de recherches, en particulier dans l’exploration sous-marine. Les réactions chimiques qui conduisent à l’émission de lumière sont biochimiques. L’activité pratique décrite dans cet article permet au maître de parler de sciences d’une manière qui plait aux élèves.
Marie Walsh, Limerick Institute of Technology, Irlande





