Supporting materials
Download
Download this article as a PDF

Traducido por César Díez Factor. Las actividades industriales e incluso los cambios geológicos pueden afectar a la calidad del agua, causando una contaminación que represente riesgos para la salud humana y el medio ambiente. Aprende cómo convertirte en un analista independiente para…

Las actividades industriales e incluso los cambios geológicos pueden ser muy perjudiciales para la calidad del agua, contaminándola con fertilizantes, pesticidas, iones metálicos o compuestos orgánicos que pueden representar riesgos para la salud humana y el medio ambiente. Es por tanto crucial controlar constantemente la calidad de las fuentes de agua dulce, tales como los ríos.
Los analistas de calidad son una parte clave del proceso para mantenernos a salvo del agua contaminada. Ellos comprueban regularmente la calidad del agua realizando análisis cuantitativos (como la determinación de la cantidad de un ion en una disolución) en muestras reunidas de varios lugares antes, durante y después del tratamiento del agua.
En la siguiente actividad, los estudiantes se ponen en el lugar de un analista de calidad de agua que trabaja al lado de una planta de manufacturación similar a la Tata Steel de Scunthorpe, UK. Tendrán que reaccionar ante un escenario específico, realizar los análisis apropiados, y determinar si la planta está eliminando el tiocianato de su agua residual eficientemente.

Los iones tiocianato (SCN–) son tóxicos para los organismos acuáticos y se sabe que afectan a la glándula tiroides de los humanos, reduciendo la capacidad de la glándula de producir las hormonas necesarias para el normal funcionamiento del cuerpo.
Los tiocianatos pueden tener muchos orígenes diferentes. La gasificación del carbón y la fabricación de productos químicos útiles a partir del carbón, por ejemplo, producen grandes cantidades de iones tiocianato, junto con un gran número de otros compuestos tóxicos tales como fenoles y amonio. Estos subproductos son por tanto constituyentes del agua residual de la planta.
Los tiocianatos se pueden encontrar también cuando se usa cianuro en la minería de metales preciosos. El cianuro se convierte en tiocianato por reacción con azufre, que se encuentra naturalmente en las menas:
8CN– + S8 → 8SCN–
Algunos pesticidas también pueden contener iones tiocianato como su compuesto activo venenoso. Se encuentran trazas de tiocianato de forma natural en el cuerpo humano como producto derivado del metabolismo de la cisteína y la desintoxicación del cianuro –luego se excreta en la orina. Puede entrar en el cuerpo humano por el tabaco y es un producto derivado del metabolismo de algunos medicamentos usados para tratar la hipertensión.
El proceso de eliminar los iones tiocianato del agua residual se lleva a cabo en unos grandes tanques de hormigón abiertos al aire que contienen lodos activos, un material biológicamente activo formado por una gama de microorganismos que pueden descomponer los iones tiocianato y otros contaminantes en otros compuestos menos peligrosos. La reacción química que tiene lugar para neutralizar el tiocianato es:
SCN– + 3H2O + 2O2 → HCO3– + NH4+ SO42- + H+
Esta reacción es un ejemplo de biorremediaciónw1, un proceso en el cual se usan microbios para limpiar suelos y aguas subterráneas contaminadas. Las plantas pueden también usarse para limpiar tierra contaminada, en un proceso llamado fitorremediaciónw2.
Antes y después del tratamiento, el agua puede ser analizada fácilmente para detectar la presencia de iones tiocianato. Si la disolución se vuelve de color rojo sangre tras añadir cloruro de hierro (III), entonces hay presentes iones tiocianato, como se ve en esta ecuación:

Fe3+(aq) + SCN–(aq) → [FeSCN]2+(aq)
or, more fully,
[Fe(H2O)6]3+(aq) + SCN–(aq) → [Fe(H2O)5SCN]2+(aq) + H2O(l)
Esta reacción puede ser usada para el análisis cuantitativo de iones tiocianato en baja concentración. Usando un colorímetro, puedes medir la absorbancia a 480 nm del complejo [Fe(H2O)5SCN]2+ y deducir la concentración exacta de iones tiocianato, siempre y cuando no sea demasiado alta. También puedes usar una simple asociación de colores, aunque los resultados serán menos precisos y sólo cualitativos.
Como se explica en la hoja de trabajo 1w3, los alumnos deben ponerse en el papel de un analista de calidad de una pequeña agencia independiente de control de calidad que comprueba los resultados para asegurar que cumplen los requisitos de la Agencia del Medio ambiente del Reino Unido.

Se sabe que el vertido de una planta industrial como la Tata Steel situada en Scunthorpe contiene alrededor de 250 mg/dm3 (250ppm) de iones tiocianato. Sin embargo, el nivel seguro que da la Agencia del Medio ambiente del Reino Unido es 10 mg/dm3, así que el vertido es tratado y la concentración de tiocianato se reduce a 1mg/dm3, muy por debajo de los límites de seguridad. Los iones tiocianato se extraen del vertido antes de que éste se eche al río Trent.
Ha habido un período de tiempo intensamente frío recientemente, que puede afectar a la actividad de los microorganismos. A la compañía le preocupa que esto haya afectado a su planta de tratamiento de aguas y haya reducido la efectividad en la eliminación de los iones tiocianato del agua a tratar.
Normalmente se analizan los tiocianatos en la planta tres veces al día usando un simple test: se añade a la muestra de agua una disolución ácida de cloruro de hierro (III) y la concentración de tiocianato se mide fotométricamente por la absorbancia debida al complejo tiocianato de hierro (III). Cada semana se realizan un total de 16 pruebas distintas. Las muestras del vertido entrante y el agua listo para descargarse al río también son llevadas para hacerles un análisis preciso.
Los analistas de la compañía han hecho la revisión, pero la compañía busca un analista independiente: tú!
Debes usar una adecuada protección en ojos y manos para manejar los ácidos y los tiocianatos. Puedes comprobar las normas de seguridad en la página de Science in School al final de esta edición impresa.
La siguiente actividad va dirigida a alumnos de 16 a 18 años y dura alrededor de 2 horas.

1 – Prepara las siguientes disoluciones antes de comenzar la actividad práctica:
a-Disolución de tiocianato de potasio (KSCN) de 250 mg/dm3 (250 ppm). Disuelve 4,5 g de tiocianato de potasio en 500 cm3 de agua destilada. Después diluye 50 cm3 de esta disolución hasta 1 dm3: ahora está a una concentración de 250 mg/dm3 en iones de tiocianato.
b-Disolución ácida de cloruro de hierro (III) (FeCl3(H2O)6) de 0,41 mol/dm3. Disuelve 50 g de FeCl3(H2O)6 en unos 250 cm3 de una disolución de ácido clorhídrico (HCl) de 1 mol/dm3.
c-Doce muestras etiquetadas de diferentes concentraciones de iones de tiocianato.
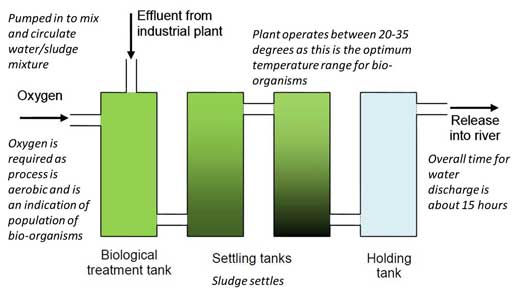
2- Proporciona a los alumnos un plano de la planta (figura 1), la hoja de trabajo 1w3 esquematiza la situación, y la hoja de trabajo 2w4 describe todos los detalles sobre el proceso de análisis.
3- Los alumnos deberían escribir una carta a la compañía que dirige la planta de tratamiento de aguas residuales solicitando muestras para el análisis. Deberían especificar en qué punto de la circulación del vertido que pasa por la planta quieren que se extraigan las muestras, cuántas muestras necesitan y cuándo deben ser tomadas. También deberían especificar la cantidad que se necesita de cada muestra, cómo deben ser tomadas y en qué tipo de recipiente deberían recogerse.
4- Los alumnos deberían trabajar en parejas para analizar sus muestras de acuerdo con el método descrito en la hoja de trabajo 2w4.

Cuidado: utiliza protección de ojos. El cloruro de hierro (III) es irritante.
1. Haz una gráfica de calibración
a- Llena tres buretas, una con la disolución de tiocianato de potasio de 250 ppm en tiocianato, otra con agua destilada y otra con la disolución de cloruro de hierro (III).
b- A seis de los matraces aforados de 100 cm3, añádeles 0,0; 2,0; 4,0; 6,0; 8,0 y 10,0 cm3 de la disolución de tiocianato de potasio 250 mg/dm3 y etiquétalas de A a F.
c- Añade agua destilada a cada matraz hasta que suba el volumen a unos 80 cm3.
d- A cada matraz, añade 10 cm3 de la disolución de cloruro de hierro (III) y después añade agua destilada hasta que el volumen alcance los 100 cm3. Mezcla bien las soluciones.
|
Matraz |
a |
b |
c |
d |
e |
f |
|---|---|---|---|---|---|---|
|
Volumen de disolución de tiocianato de potasio (cm3) |
0.0 | 2.0 | 4.0 | 6.0 | 8.0 | 10 |
|
Concentración de tiocianato (ppm) |
0 | 5 | 10 | 15 | 20 | 25 |
e- Mide la absorbancia de cada disolución usando un colorímetro.
f- Dibuja una gráfica de absorbancia (eje y) frente a concentración de tiocianato (en ppm de tiocianato) (eje x) para las seis disoluciones.
2- Analiza la muestra
a- Añade 10 cm3 de la disolución de concentración desconocida en tiocianato a un matraz aforado de 100 cm3 y añade agua destilada hasta que suba el volumen a unos 80 cm3.
b- Añade 10 cm3 de la disolución de cloruro de hierro (III) al matraz y después añade agua destilada hasta que el volumen alcance los 100 cm3. Mezcla bien la disolución.
c- Mide la absorbancia de la disolución usando el colorímetro.
d- Usa la gráfica para encontrar la concentración.
3- Escribe un informe para la compañía de tratamiento de aguas residuales resumiendo tus conclusiones e incluye una recomendación sobre si el vertido debe ser echado al río o no. Los alumnos deberían describir la evidencia sobre la cual basan su recomendación y comentar la seguridad que tienen de sus resultados, teniendo en cuenta el error porcentual que puede haber en sus procedimientos analíticos.
La investigación en educación ha demostrado el valor de llevar ideas teóricas a situaciones de proyectos `vivos´– o en contextos del mundo real. Esta actividad práctica es un buen ejemplo para situar la química analítica clásica en un contexto de la vida real. También ofrece la oportunidad de desarrollar habilidades transferibles en el procesamiento de datos y la comunicación.
Marie Walsh, Limerick Institute of Technology, Irlanda
Download this article as a PDF