Fomentando el interés hacia los combustibles: experimentos sobre el cambio climático Teach article
Traducido por Valeria Nones Magariño y Gabriel Pinto, Universidad Politécnica de Madrid. Dudley Shallcross, Tim Harrison, Steve Henshaw y Linda Sellou sugieren experimentos de química y física para el aprovechamiento de fuentes de energía alternativas, tales como los combustibles no…

iStockphoto; imagen de la
tierra cortesía de NASA
Las discusiones sobre el cambio climático en las clases de ciencias pueden ser muy amplias, pero probablemente tratarán sobre las diferentes fuentes de energía y sus consecuencias. Entre los temas más relevantes que se pueden incluir están: los diferentes combustibles que pueden utilizarse, su eficacia y producción, y alternativas a la combustión. Sugerimos un par de actividades de laboratorio como apoyo a las lecciones de física y química sobre el cambio climático.
1) Midiendo la eficiencia del combustible
Los combustibles no quemados que se evaporan a la atmósfera, durante su almacenamiento o combustión, son un contaminante del aire y también desempeñan un papel en la determinación de la duración de los gases que provocan el efecto invernadero. Una manera de limitar este daño es utilizar alcoholes en lugar de combustibles de hidrocarburos clásicos, tales como la gasolina y el gasóleo.
Los hidrocarburos en la atmósfera son oxidados por el radical hidroxilo (●OH) para formar principalmente alcoholes y carbonilos. Los niveles de ●OH en la atmosfera son importantes, porque estos radicales eliminan los gases de efecto invernadero que contienen el enlace C-H, como el CH4.Simulaciones por ordenador han demostrado que la liberación a la atmósfera de alcoholes tiene un efecto dañino menor que la liberación de hidrocarburos, porque se tienen menos pasos de oxidación y se eliminan menores cantidades de ●OH. Por lo tanto, el uso de alcoholes en lugar de hidrocarburos como combustibles tiene un efecto positivo en la calidad del aire y de la eliminación de gases de efecto invernadero. Por otra parte, los alcoholes de menor tamaño molecular que se liberan a la atmósfera pueden ser eliminados, en menor medida, por procesos físicos tales como el secado (absorbidos por una superficie) y por deposición húmeda (lluvia, nieblas, aerosoles), mientras que los hidrocarburos no.
Los alcoholes se utilizan en las pilas de combustible (ver ‘Pilas de combustible: energía de electrólisis’) que tienen una amplia gama de aplicaciones potenciales, por ejemplo en vehículos.
Por supuesto, un buen combustible no tiene que ser sólo inocuo a nivel ambiental – también debe ser una fuente eficiente de energía. El siguiente experimento permite a los alumnos determinar la energía liberada por la combustión de distintos tipos de alcoholes y comparar su efectividad con la de combustibles clásicos.
Los mecheros de alcohol son pequeños dispositivos de vidrio que normalmente vienen en los juegos de química para niños y son accesibles para colegios a través de empresas del material didáctico. Se pueden utilizar para determinar la energía liberada en la combustión de los alcoholes primarios más cortos, como el metanol, etanol, 1-propanol, 1-butanol y 1-pentanol.


al cual se ha añadido un volumen de agua conocido.
Imagen cortesía de Bristol ChemLabS
Los estudiantes pueden preparar el experimento (ver imágenes arriba), en el que el mechero de alcohol se llena con un alcohol conocido. En primer lugar, pese el mechero y su contenido. Mida con precisión 150 ml de agua y colóquela en un vaso de precipitados de vidrio de 250 ml. Asuminos que 1,0 ml de agua pesa 1.0 g. Mida la temperatura del agua al inicio del experimento y sujete con una abrazadera el vaso de precipitados por encima del mechero, dejando un espacio de aproximadamente 5 cm entre la mecha y la base del vaso de precipitados. Encienda el mechero y colóquelo en el centro del vaso de precipitados con el agua hasta que la temperatura haya aumentado entre 30 y 40 ° C. Determine el aumento de temperatura midiendo la temperatura final del agua. Pese la masa final del mechero de alcohol y su contenido. Es aquí cuando los estudiantes no recordarán si pesaron, al principio el mechero de alcohol con la tapa o sin ella! Calcule la masa de alcohol quemado (MB).
La energía liberada en la combustión, utilizada para elevar la temperatura del agua, puede ser calculada usando la ecuación (1)
ΔHC = -c x Magua x TR (1)
donde:
ΔHC = calor de combustión [kJ]
c = calor específico del agua = 4.187 kJ kg-1 °C-1
Magua = masa del agua [kg]
TR = incremento de temperatura del agua [°C]
La energía de combustión puede ser expresada como la energía por gramo o la energía por mol del alcohol quemado, con el fin de comparar los resultados obtenidos por varios grupos con el mismo alcohol o con diferentes alcoholes.
Energía de combustión por gramo = ΔHC / MB (2)
Energía de combustión por mol = ΔHC x Mr / MB (3)
donde:
Mr es la masa molecular relativa del alcohol que se está quemando,
MB es la masa del alcohol quemado.
Investigaciones adicionales que pueden llevar a cabo los estudiantes son:
- Cambiar el alcohol que utiliza el mechero. En la práctica, es mejor tener varios mecheros de alcohol con diferentes alcoholes, ya que es muy difícil reemplazar el alcohol con una mecha mojada
- Una alternativa a comparar varios alcoholes diferentes es comparar solo alcohol con una vela (por ejemplo las que se venden con un soporte de metal)
- Cambiar el material con el que está hecho el vaso utilizando, por ejemplo, un vaso de cobre o una lata de acero galvanizado
- Cambiar el espesor del material que contiene el agua
- Comparar un recipiente aislante (hecho de un material refractario) con el vaso de vidrio
- Comparar el vaso de vidrio abierto en la parte superior con uno al que se ha colocado una tapa a través de la cual se introduce el termómetro.
- ¿Hay diferencias si el agua en el recipiente ha sido agitada o no?
- ¿Hay diferencia en el calor absorbido por el agua si se cambia la altura del vaso por encima de la llama?
- ¿Hay diferencia si se colocan placas / mantas refractarias alrededor del mechero para reducir las corrientes de aire?
- ¿La longitud de la mecha provoca alguna diferencia?
Tenga en cuenta que es demasiado peligroso usar gasolina o gasóleo en estos mecheros. Aún sin ensayar con diferentes combustibles convencionales o diferentes alcoholes para comparar las energías liberadas por combustibles ‘verdes’, estos experimentos se pueden utilizar para discutir sobre el error experimental y la exactitud de las medidas en general. Será obvio que existen errores significativos al comparar los resultados experimentales de aula con los datos recogidos enlibros de texto, o los que están disponibles en Wikipediaw1 (ver tabla).
| Nombre de alcohol / combustible | Calor estándar de combustión [MJ / kg] |
|---|---|
| Turba (húmeda) | 6.0 |
| Turba (seca) | 15.0 |
| Madera | 15.0 |
| Carbón (Lignito) | 15.0 |
| Metanol | 22.7 |
| Carbón (Antracita) | 27.0 |
| Ethanol | 29.7 |
| Carbono | 32.8 |
| 1-Propanol | 33.6 |
| 1-Butanol | 36.2 |
| 1-Pentanol | 37.7 |
| Gasóleo | 44.8 |
| Parafina | 46.0 |
| Queroseno | 46.2 |
| Gasolina | 47.3 |
| Butano | 49.5 |
| Propano | 50.4 |
| Etano | 51.9 |
| Gas natural (promedio, varía dependiendo del país de origen) | 54.0 |
| Metano | 55.5 |
| Hidrógeno | 141.8 |
2) Producción de biocombustibles a partir de aceite vegetal
Los biocombustibles son combustibles sólidos, líquidos o gaseosos procedentes de material biológico recientemente muerto, de forma relativa en contraposición a los combustibles fósiles, que proceden de material biológico muerto hace mucho tiempo.
Considerando que la quema de combustibles fósiles libera el CO2 que fue atrapado por un largo tiempo, la quema de biocombustibles sólo debe liberar CO2 que ha sido recientemente capturado de la atmósfera durante la fotosíntesis y convertido en combustible. En teoría, por lo tanto, el proceso debería ser neutro en cuanto a la emisión de carbono. La producción de biocombustibles, sin embargo, también genera CO2; la emisión durante el ciclo de vida (cantidad de CO2 generado durante la producción, uso y desecho de residuos) de algunos biocombustibles de primera generación incluso supera la de los combustibles fósiles tradicionales.
Hasta ahora, se han desarrollado tres generaciones de biocombustibles. Los de primera generación están hechos de almidón, azúcar, aceite vegetal o grasas animales. Además de tener niveles de emisión poco óptimos, tienen otras limitaciones importantes: existe un umbral por encima del cual su producción amenaza el suministro de alimentos y la biodiversidad. Además, son más caros que los combustibles fósiles existentes.

Esto condujo al desarrollo de los biocombustibles de segunda generación, que pueden proporcionar una mayor proporción de nuestro suministro de combustible de forma sostenible, asequible y con mayores beneficios ambientales. Utilizan una variedad de cultivos no alimentarios, incluidos los residuos de biomasa, la paja de trigo, maíz y madera.
Aún así, los biocombustibles basados en ocupación de terreno emplean tierras que, de lo contrario podrían ser utilizadas para cultivar alimentos. El combustible de algas (denominado en inglés oilgae), está siendo desarrollado como un biocombustible de tercera generación para evitar este problema. Estos combustibles pueden ser producidos en una modalidad de alto rendimiento, ya que las algas producen 30 veces más energía por acre que los cultivos de tierra como la soja.
Teóricamente, se pueden producir biocombustibles de cualquier fuente de carbono biológico, aunque las fuentes más comunes son las plantas fotosintéticas y los materiales de origen vegetal. Una ventaja de muchos de los biocombustibles sobre la mayoría de otros tipos de combustible es que son biodegradables y relativamente inofensivos para el medio ambiente si son derramados.
Hay varias maneras de hacer biocombustibles a partir de aceites vegetales, pero la reacción es esencialmente la misma. Un biocombustible se produce por hidrólisis alcalina de los triglicéridos de un aceite vegetal (véase la imagen de arriba) seguida de la re-esterification de los triglicéridos para formar éster metílico. En la práctica, ambos pasos pueden tener lugar en la misma preparación, si se utiliza una mezcla de metanol en medio alcalino, como se hace comercialmente. Esta mezcla contiene el ion metóxido. Durante la hidrólisis, se libera un ácido graso del triglicérido, después junto con el ion metóxido, se forma el éster metílico del ácido graso.
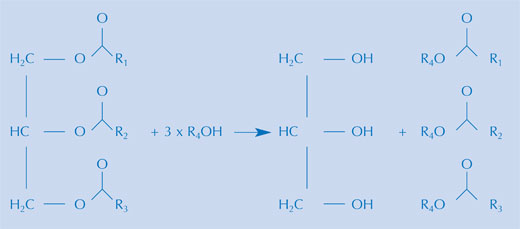
Imagen cortesía de Bristol ChemLabS
El Glicerol (1,2,3-propanoltriol) es un producto que se obtiene también en esta última reacción. El aprovechamiento o uso del glicerol es uno de los desafíos de esta creciente industria.
Para el experimento que se describe a continuación, se puede utilizar un matraz adecuado o un método de reflujo con material de vidrio de laboratorio QuickfitTM.
En la preparación más simple sin reflujo, se colocan 12-13 ml del aceite vegetal elegido en un matraz de fondo redondo con 2 ml de hidróxido de potasio en metanol (5% p/p). Los líquidos se mezclan sin agitar para evitar que el aire quede atrapado en la mezcla y se produzca formación de espuma. La mezcla se deja reposar en un baño de agua a 60ºC. La velocidad de reacción se puede monitorizar midiendo la viscosidad: se puede tomar el tiempo que tarda una pequeña bola de cojinete (simétrica, fácilmente disponible, suave y densa) en hundirse a una profundidad determinada de la mezcla en el matraz, cada 5 minutos a intervalos regulares, hasta 2 horas.
Los triglicéridos más grandes se rompen en pequeñas subunidades (véase imagen de arriba), que tendrán una masa menor que la del compuesto del que se forman. Ya que la viscosidad de un líquido es directamente proporcional a la masa molecular de sus componentes, la reacción dará lugar a una mezcla menos viscosa. Además, se puede dejar una muestra un día entero en estas condiciones para observar cualitativamente la magnitud de la hidrólisis.
Aunque el biocombustible producido en este experimento todavía contiene el glicerol que se formó en la reacción, se puede observar, no obstante, el cambio en la viscosidad. Si se utiliza un condensador de reflujo para la reacción, el biocombustible puede separarse del glicerol por extracción con disolvente.
El biocombustible producido por cualquiera de los métodos puede ser usado, por ejemplo, para propulsar un pequeño motor diésel.
Nota: Si utiliza aceite vegetal que ya ha sido utilizado para cocinar, por favor, ¡recuerde filtrar primero cualquier residuo de alimentos!
3) Pilas de combustible: energía de electrólisis
Los experimentos anteriores se basan en la liberación de energía a través de la combustión. Sin embargo, ésta no es la única manera de oxidar un combustible para liberar energía. Los combustibles también pueden ser oxidados por reacciones de oxidación y reducción (redox) como se demuestra en el siguiente experimento.
Las pilas o celdas de combustible producen electricidad a partir de una reacción entre un combustible como un alcohol o el hidrógeno en el ánodo y un agente oxidante, como el oxígeno o el cloro en el cátodo. El combustible y el agente oxidante reaccionan en presencia de un electrolito. Los reactivos fluyen hacia adentro de la celda, y los productos de la reacción hacia afuera, mientras que el electrolito permanece dentro de la misma. Una pila de combustible funciona mediante catálisis, separando los electrodos y forzando a los electrones a viajar a través de un circuito, convirtiéndolos así en energía eléctrica.
Una pila de combustible se diferencia de una pila química convencional porque sus reactivos pueden ser repuestos (lo que representa un sistema termodinámicamente abierto), mientras que los productos químicos que se consumen en una pila química no lo son, al estar sellada (termodinámicamente cerrado). Una pila de combustible seguirá funcionando siempre y cuando se sustituyan sus reactivos.
Una pila de combustible produce un voltaje de 0,6 V a 0,7 V a plena carga. Sin embargo, pueden combinarse en circuitos en serie y en paralelo; en serie para producir tensión más alta, mientras que en paralelo permiten que se establezca una corriente más fuerte. Estos diseños se denominan baterías de pilas de combustible. Adicionalmente, se puede aumentar la superficie de las pilas para generar una corriente más fuerte en cada pila.
Las pilas de combustible son muy útiles como fuentes de energía en ubicaciones remotas, tales como naves espaciales, estaciones meteorológicas, grandes parques y zonas rurales. En el futuro, también podrían propulsar vehículos.

de ginebra en una pila de
combustible
Imagen cortesía de ChemLabS
de Bristol
Hay varias pilas de combustible de demostración disponibles de forma comercialw2 (por unos 20 € cada una), para mostrar su principio a los estudiantes. La que utilizamos es una pila de combustible de alcohol/aire (ver la imagen a la izquierda), que consta de dos partes: un vaso de plástico adaptado con una almohadilla conductora conectada a un terminal (el ánodo) y un mecanismo de inserción que contiene el catalizador. Un volumen determinado de una fuente de alcohol (como, por ejemplo, un anticongelante), o de un alcohol en sí mismo (como, por ejemplo, 1-propanol) se mezcla con 55 ml de un base (por ejemplo hidróxido de sodio) como electrolito en el vaso de plástico. El mecanismo de inserción se coloca en el vaso de precipitados para completar la pila. El aire puede pasar a través del mecanismo de inserción a la mezcla alcalina de alcohol.
La reacción química que genera una corriente es la oxidación del alcohol por el oxígeno en el aire – a carbonilo o a ácido carboxílico, dependiendo del grado de oxidación. La reacción es catalizada por grafito platinado en la almohadilla de la base del vaso.
En el cátodo: 4e– + O2 + 2H2O → 4OH–
En al ánodo: CH3CH2OH + 2OH– → CH3CHO + 2H2O + 2e–
El aldehído CH3CHO también es capaz de ser oxidado a un ácido carboxílico, de tal forma que puede continuar liberando una corriente eléctrica. Por cierto, un combustible alternativo para este tipo particular de celda de combustible, que da un voltaje mayor que un alcohol, es el tetrahidroborato de sodio (III) (borohidruro de sodio, NaBH4). De acuerdo con el fabricante, sólo se requieren cantidades mínimas (alrededor de 20 mg de NaBH4) para que funcione la pila de combustible durante una hora. Téngase en cuenta que el NaBH4 es tóxico, nocivo e irritante.
El voltaje producido por la pila de combustible puede medirse fácilmente usando un multímetro barato.
Estas son algunas de las investigaciones que pueden llevarse a cabo por estudiantes utilizando celdas de combustible:
- Pueden utilizarse diferentes tipos de alcohol, siempre que sean solubles en agua: estos incluyen la serie de alcoholes del metanol al 1-pentanol, los isómeros secundarios o terciarios de estos alcoholes (si existiesen) y las diferentes fuentes de alcohol, como alcoholes metílicos, limpiadores de parabrisas de coches, anticongelantes o bebidas alcohólicas como vodka o ginebra. ¿Qué efecto tiene el tipo de alcohol en el voltaje producido?
- Los estudiantes pueden investigar el efecto de cambiar la concentración inicial de la base en el voltaje. También pueden analizar si el tipo de base que se utiliza, por ejemplo hidróxido de sodio frente a hidróxido de potasio, provoca alguna diferencia en el voltaje producido por la pila de combustible.
- También puede ser interesante investigar el cambio en la concentración de la base o del alcohol mientras funciona la pila.
- La instalación completa puede colocarse en un baño de agua fría o caliente para cambiar la temperatura a la que se lleva a cabo la reacción. Mediante la medición de la corriente de salida, se puede investigar el efecto de la temperatura sobre la velocidad de reacción.
Se pueden encontrar otras sugerencias para más experimentos en un par de libros o en Internetw3.
Reconocimiento
Los autores desean agradecer a Will Davey de la Universidad de Sheffield por las bases del experimento de producción de biocombustibles.
Web References
- w1 – Para las tablas de calor de combustión de distintos combustibles y compuestos orgánicos en Wikipedia, véase: http://en.wikipedia.org/wiki/Heat_of_combustion#Heat_of_combustion_tables
- w2 – Uno de los muchos proveedores especializados en tecnología de pilas de combustible para la industria y la educación es h-tec: www.h-tec.com
- w3 – h-tec también ha publicado un libro sobre el uso de las pilas de combustible en el aula:
- Voigt C, Hoeller S, Kueter U (2005) Fuel Cell Technology for Classroom Instruction (Basic Principles, Experiments, Work Sheets). Luebeck, Germany: h-tec
- Una colección de proyectos seguros, económicos, educativos y divertidos que se centran en la tecnología de pilas de combustible es:
- Harper G (2008) 101 Fuel Cell Projects for the Evil Genius. New York, USA: McGraw-Hill Professional
- Para más experimentos con pilas de combustible, consulte: www.ectechnic.co.uk/exps.html
Resources
- Harrison T, Shallcross D, Henshaw S (2006) Detecting CO2 – the hunt for greenhouse-gas emissions. Chemistry Review 15: 27-30
- Pacala S, Socolow R (2004) Stabilisation wedges: solving the climate problem for the next 50 years with current technologies. Science 305: 968-972. doi: 10.1126/science.1100103
- Shallcross D, Harrison T (2008) Modelizado del Cambio Climático en el aula. Science in School 9. www.scienceinschool.org/2008/issue9/climate/spanish
- Shallcross D, Harrison T (2008) Practical demonstrations to augment climate change lessons. Science in School 10: 46-50. http://scienceinschool.org/2008/issue10/climate
- Para una lista completa los artículos en Science in School sobre el cambio climático, consulte: www.scienceinschool.org/climatechange





