Supporting materials
Download
Download this article as a PDF

Traducido por Ignacio Tognaccini y Gabriel Pinto. Universidad Politécnica de Madrid. Todos hemos oído que una dieta rica en antioxidantes es saludable. Junto a sus alumnos, Gianluca Farusi ha comparado el nivel de antioxidantes en una variedad de alimentos y bebidas.
Muchos problemas de salud, como la arteriosclerosis, el ataque al corazón, la enfermedad del Alzheimer, algunos tumores y cataratas seniles, se asocian a moléculas muy reactivas denominadas radicales libres. Estas moléculas son producidas en la respiración aeróbica y empleadas por el cuerpo, por ejemplo para defenderse de microorganismos.
Sin embargo, el desequilibrio entre radicales (oxidantes) y antioxidantes puede provocar una enfermedad.
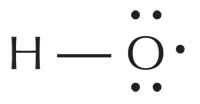
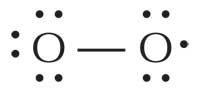
Los radicales libres son reactivos porque poseen uno o más pares de electrones desapareados. Son producidos y pueden hallarse en muchas células y orgánulos; el anión radical superóxido (O2–), por ejemplo, es el radical más común del cuerpo, empleado por los glóbulos blancos para atacar virus y bacterias. Sin embargo, el radical más reactivo con diferencia es el radical hidroxilo (HO·), que se halla en el peroxisoma (donde se descomponen los ácidos grasos) y el retículo endoplásmico. Los factores externos influyen también en la producción de radicales; por ejemplo, la exposición a la luz ultravioleta (UV) provoca la formación de radicales de oxígeno singlete (1ΔO2·).
En el cuerpo, los radicales libres pueden conducir a una variedad de problemas. Particularmente, pueden reaccionar con –y dañar- lípidos, proteínas y ácidos nucleicos, como el ADN (Arking, 2006). Nuestro cuerpo dispone de dos formas para protegerse del continuo ataque de los radicales: la encimática y la no encimática. Las encimas más importantes que se emplean para defender nuestro cuerpo del ataque de radicales libres son las encimas antioxidantes. Los principales antioxidantes no encimáticos son la melatonina, el a-tocoperol (vitamina E), el ácido ascórbico (vitamina C) y el b-caroteno (la vitamina A precursora).
Los cuatro antioxidantes no enzimáticos son esenciales en nuestra dieta diaria y se encuentran en gran variedad de alimentos. Particularmente, es menos habitual que las personas que comen mucha fruta y verdura tengan cáncer, y se ha comentado que son beneficiosos para la salud debido a los antioxidantes que contienen (Polidori et al., 2009; Swirsky Gold et al., 1997), de manera que contrarrestan los efectos perjudiciales de los radicales libres. Actualmente hay pocas pruebas de que los complementos antioxidantes (por ejemplo, pastillas) sean beneficiosos para la salud.
El siguiente experimento compara los niveles de antioxidantes en varios tipos de alimentos y bebidas, esto es, su efectividad como radicales oxidantes.
Para formar a mis estudiantes de 17 años con la necesidad una dieta responsable, en espera de reducir su riesgo de desarrollar las enfermedades mencionadas antes, he diseñado una actividad basada en la reacción de Briggs-Raucher: una reacción oscilante en la que se alternan la etapa del radical ámbar y la del radical azul.
Añadiendo muestras de distintos tipos de alimentos y bebidas a la reacción y midiendo los intervalos de tiempo entre colores, los alumnos podrían comparar la efectividad de las muestras como radicales oxidantes. Por supuesto, esto es una comparación y no una evaluación absoluta. Pero cada cosa a su tiempo…
Disolución de peróxido de hidrógeno 4M: vierte 400 ml de agua destilada en un matraz de 1 l. Ponte unos guantes y añade 410 ml de peróxido de hidrógeno al 30%. Empleando agua destilada, diluye la disolución a 1.0 l.
Una disolución de yodato potásico 0.20 M y ácido sulfúrico 0.077 M: toma 43 g de yodato potásico y aproximadamente 800 ml de agua destilada en un matraz de 1 L. Añade 4.3 ml de ácido sulfúrico concentrado. Calienta y remueve la mezcla hasta que el yodato potásico se disuelva. Diluye la disolución a 1.0 l con agua destilada.
Una disolución de ácido malónico 0.15 M y sulfato de magnesio 0.20 M: disuelve 16 g de ácido malónico y 3.4 g de sulfato de magnesio (II) en aproximadamente 500 ml de agua destilada en un matraz de 1 l. En un vaso de precipitado de 100 ml, calienta 50 ml de agua destilada hasta que hierva. En un vaso de precipitado de 50 ml, mezcla 0.30 g de almidón soluble y remueve la mezcla hasta formar una mezcla pastosa. Vierte esa mezcla en el agua hirviendo y continúa calentando y removiendo hasta que el barro se haya disuelto. Vierte la disolución obtenida en la de ácido malónico y sulfato de magnesio (II). Diluye la mezcla a 1.0 l con agua destilada.
Muestras de alimentos: para preparar las muestras de comida como disoluciones acuosas o suspensiones, introduce 2.0 g en un matraz de 400 ml. Añade 100 ml de agua destilada y remueve con una varilla de vidrio. Decanta, vierte la muestra en un tubo de ensayo y centrifuga. Para bebidas, como café o vino, toma 2.0 ml, añade 100 ml de agua destilada y remueve.
En un matraz de 100 ml que contenga un agitador magnético, introduce: 10 ml de disolución acuosa de peróxido de hidrógeno 4 M, 10 ml de disolución acuosa de yodato potásico 0.20 M y ácido sulfúrico 0.077 M, y 10 ml de disolución acuosa de ácido malónico 0.15 M y sulfato de manganesio 0.20 M. Inicia la agitación magnética. Cuando la disolución ámbar se vuelva azul por segundo vez, añade 1 ml de disolución o suspensión de alimentos. En la web hay disponible un video con los cambios de color.w2
La reacción de Briggs-Rauscher es una reacción oscilante- es decir, una mezcla de productos químicos sufre una secuencia de cambios de color que se repite periódicamente. El mecanismo exacto de la reacción está aun investigándose, pero la naturaleza de las oscilaciones es suficientemente clara. Para los propósitos de este artículo, es suficiente con saber que mientras el proceso radicalario mantenga la concentración del intermedio HOI más alta que la concentración del intermedio I–, la disolución permanece ámbar; cuando el proceso no radicalario tiene lugar, la concentración de I– es mayor que la de HIO y el ión yoduro se combina con I2 para formar un complejo azul con almidón. Puede descargarse una descripción más detallada de la reacción en la web de Science in Schoolw1.

Desde que añadimos la disolución o suspensión de comida después de la segunda fase azul, cuando la fase no radicalaria está acabando y la fase radicalaria está a punto de comenzar, cuanto mayor es el intervalo de tiempo entre la segunda y la tercera fase azul, mayor es la actividad del antioxidante en el alimento. En otras palabras, el alimento ha reaccionado con los radicales producidos y la reacción tiene lugar para producir suficientes radicales como para permitir que la reacción oscilante continúe.
Hemos dedicado mucho tiempo a elegir la mejor concentración de alimentos o bebidas para usar, desde que disoluciones demasiado diluidas disminuyeron la actividad de los antioxidantes y las demasiado concentradas aumentaron tanto el tiempo de reacción que no era práctico hacer un número de pruebas estadísticamente significativas durante el transcurso de la experiencia.
Tanto el ácido malónico como el yodo (producidos durante la reacción) pueden irritar la piel, los ojos y las membranas mucosas; por este motivo la reacción debe ser llevada a cabo en una campana extractora.
Debido a que el 30% del peróxido de hidrógeno es un agente oxidante muy fuerte, es necesario llevar gafas de protección, bata de laboratorio y guantes. Debe evitarse cualquier contacto entre peróxido de hidrógeno y materiales combustibles.
El ácido sulfúrico es un agente deshidratante fuerte; deben llevarse gafas de protección, bata de laboratorio y guantes.
Para disponer con seguridad de la mezcla al final del experimento, añade lentamente tiosulfato de sodio (Na2S2O3) a los productos de la reacción hasta que el exceso de yodo se convierta en iones incoloros de yodo (la reacción es bastante exotérmica).
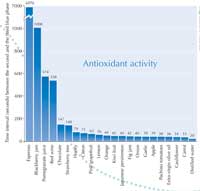
Cuando realicé la actividad con mis alumnos, encontré la mayor actividad antioxidante en el café expreso: 6970 segundos. Ver el gráfico de la derecha.
Pueden descargarse más detalles de nuestros resultados de la web de Science in Schoolw1. La tabla 1 muestra los alimentos ensayados, la actividad antioxidante (intervalos de tiempo) y la principal sustancia supuestamente responsable de la actividad.
Entonces, ¿qué deberíamos concluir a partir de los resultados? Claramente, una dieta basada puramente en el café expreso podría contener altos niveles de antioxidantes, pero no sería nada saludable. Cuando hice esta actividad con mis alumnos nos llevó a un minucioso debate sobre las reacciones radicalarias. Debajo hay algunas preguntas que podrían emplearse para iniciar una discusión.
Este es un artículo muy bueno que subraya la importancia de la química en el comportamiento de los sistemas biológicos. Es importante inculcar una apreciación de la forma en que el conocimiento científico es multidisciplinario. Profesores y alumnos podrían usar el artículo para una actividad práctica de química, bioquímica o para clases de ciencias de la salud. También podría constituir la base de proyectos en ferias de divulgación de la ciencia.
Si se suprimiese la parte experimental, la introducción, el debate y los resultados podrían ser la base más sólida para un ejercicio de comprensión. Posibles preguntas que podrían emplearse para abrir un debate sobre los alimentos y las bebidas, o la química en el día a día, son:
Marie Walsh, República de Irlanda
Download this article as a PDF