Supporting materials
Download
Download this article as a PDF

Aprende sobre la química de la precipitación e inicia a tus estudiantes en en las reacciones químicas que forman nuevos productos coloridos usando métodos de química a microescala que son baratos, rápidos y fáciles de realizar
A los estudiantes les parece magia cuando ven que se forman rápidamente los precipitados (y muchos piensan que realmente lo es).[1] Mezclamos dos sales disueltas y aparece de repente un sólido. A veces el precipitado es de diferente color que las disoluciones. Si mezclamos una disolución 1 M de sulfato de cobre con otra de hidróxido de sodio aparece un sólido azul: es el hidróxido de cobre, insoluble en agua. Si usamos disoluciones de nitrato de plata o de plomo, se forman sólidos amarillos repentinamente.
Los métodos tradicionales usan tubos de ensayo y requieren bastantes reactivos. Además se genera mucho desperdicio que va por el fregadero o se guarda en botellas para residuos. En un artículo anterior sobre indicadores pH se mostró cómo realizar reacciones sobre una hoja plastificada. Las instrucciones están impresas y plastificadas y sobre ellas se trabaja, así se evitan distracciones. Estas actividades se pueden realizar con alumnos de 11 a 18 años.
Cuando los estudiantes realizan reacciones de precipitación en ocasiones no llegan a comprender de dónde proceden los sólidos porque suelen partir de disoluciones preparadas y no ven el proceso de disolución de las sales. Si preparan ellos las disoluciones aumenta el número de sesiones necesarias. Estos experimentos a mi proporciona una manera simple y rápida de introducir el concepto de solubilidad.
Nota de seguridad: las disoluciones presentan poco peligro. Se recomienda el uso de gafas de laboratorio y lavar las manos con agua y jabón después de los experimentos con cloruro de cobre (II) que puede causar irritación cutánea.

Los resultados propician la discusión entre alumnos y profesores sobre de dónde proceden las sustancias químicas formadas y toma más sentido la ecuación química:
CuCl2 + Na2CO3 → CuCO3 + 2NaCl
La reacción funciona porque el carbonato de sodio y el cloruro de cobre son solubles en agua pero el carbonato de cobre no es muy soluble, por eso precipita. Se forma una disolución saturada de carbonato de cobre en agua.
Como los estudiantes saben que el cloruro de sodio es soluble en agua pueden completar esta tabla de resultados y observaciones.
| Sales solubles en agua | Sales insolubles en agua |
|---|---|
| Cloruro de cobre Carbonato de sodio Cloruro de sodio | Carbonato de cobre |
Prueba las siguientes reacciones entre sales:
La segunda reacción no producirá precipitado lo que implica que tanto el nitrato de sodio como el cloruro de potasio son solubles en agua. La quinta reacción es una reacción ‘verde’ con productos que se pueden comprar en las tiendas. El uso de tubos de ensayo exigiría un tiempo adicional de limpieza. Ahora, al usar una funda de plástico, el proceso es más rápido y permite obtener el ‘feedback’ de los alumnos sobre sus observaciones a la vez que genera muy pocos residuos.
Los iones metálicos pueden identificarse en sólidos o en disoluciones 0,1 M mediante precipitación. La técnica de añadir gotas a una superficie plástica que protege las instrucciones impresas debajo es también adecuada para el estudio de los metales de transición.
Nota de seguridad: las disoluciones presentan poco peligro. Se recomienda el uso de gafas de laboratorio y lavar las manos con agua y jabón después del experimento si ha habido contacto con disoluciones de iones de metales de transición que pueden causar irritación cutánea.

La actividad se puede extender al estudio de los metales de transición (hoja 2) con los que se obtienen una variedad interesante de colores de hidróxidos metálicos cuando mezclamos hidróxido de sodio 0,4 M con disoluciones 0,1 M de los iones de metales de transición.

Al añadir amoniaco en disolución 2 M se obtienen diferentes precipitados con gran variedad de colores (Hoja 3).

También podemos identificar los iones negativos con la técnicas de microescala añadiendo nitrato de plata.
Las disoluciones presentan poco peligro. Se recomienda el uso de gafas de laboratorio y lavar las manos con agua y jabón después de los experimentos en caso de contacto, las disoluciones de nitrato de plata pueden manchar la piel.

Estos resultados muestran una de las fortalezas de esta técnica. Sólo tres de las seis sales generan precipitados al añadir nitrato de plata. Los otros tres aniones no muestran cambios puesto que el nitrato de plata solo reacciona con haluros. Al añadir amoniaco 2 M el cloruro de plata se redisuelve, el bromuro de plata lo hace parcialmente mientras que el yoduro no cambia.
Para identificar los iones carbonato en una disolución de sal añadimos dos gotas que indicador pH que vira a alcalino. Añadimos dos gotas de ácido clorhídrico 0.4 M a la muestra. Comienza el desprendimiento de burbujas de dióxido de carbono. En la fila central de la hoja 4 hay una plantilla para esta reacción.
Para identificar los iones sulfato en la disolución añadimos a la disolución del sulfato metálico (0.1 M) dos gotas de ácido clorhídrico 0.4 M y dos gotas de cloruro de bario 0.1 M. Se forma un precipitado blanco de sulfato de plata. En la fila inferior de la hoja 4 hay una plantilla para esta reacción.
No es extraño escuchar a los alumnos frases como ésta: “El curso pasado ya hicimos reacciones de precipitación”. Es importante que los profesores propongan actividades nuevas que no sólo consoliden lo estudiado en cursos anteriores sino que añadan nuevos conocimientos sobre estas reacciones. Estas actividades combinan disolución, difusión y precipitación. Conviene trabajarlo después de haber estudiado la naturaleza iónica de las sales.
Nota de seguridad: la mayoría de los sólidos usados no son peligrosos. Algunas sales metálicas de plomo, cobalto y níquel pueden estar prohibidas en algunos países. Por eso cada profesor debe atenerse a la normativa local. Sin embargo, una de las ventajas de trabajar a microescala es que la cantidad utilizada es tan pequeña que no puede causar problemas de salud y genera pocos residuos que se pueden almacenar hasta su eliminación. Debemos usar gafas de laboratorio y lavarnos las manos con agua y jabón después de los experimentos en caso de contacto.



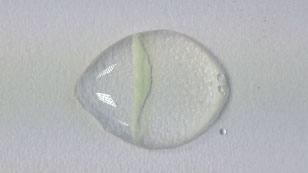
a. Sulfato de cobre (II) e hidrogeno carbonato de sodio
b. Sulfato de hierro (II) e hidrógeno carbonato
c. Nitrato de plomo y yoduro de potasio
d. Sulfato de hierro (II) y hexacianoferrato (III) de potasio que producen hexacianoferrato (III) de hierro (II), el pigmento azul de Prusia.

Cuestiones para discutir con los alumnos:
Si tomamos como ejemplo la reacción entre el nitrato de plata y el yoduro de potasio podemos ver que las dos sales son solubles en agua. Son compuestos iónicos con estructura en redes cristalinas. Cuando los iones abandonan la red cristalina comienza la difusión y los iones migran en sentidos contrarios hasta que se forma el precipitado, aproximadamente en el centro. Precipita el yoduro de plata y queda en disolución el nitrato de potasio.
Para realizar demostraciones de aula que se puedan ver fácilmente se puede usar un microscopio USB
[1] Worley B et al. (2019) Visualizing dissolution, ion mobility, and precipitation through a low-cost, rapid-reaction activity introducing microscale precipitation chemistry. Journal of Chemical Education 96: 951–954. doi: 10.1021/acs.jchemed.8b00563
Uno de los pilares de la química sostenible es minimizar la cantidad de reactivos. Otra es reducir el desperdicio de productos. Los experimentos con unas pocas gotas sobre una superficie plástica son una propuesta interesante que no impide realizar observaciones e investigaciones interesantes.
Ingo Eilks, Profesor de didáctica de la química en la Universidad de Bremen, Alemania.
Download this article as a PDF