Supporting materials
Weitere Einzelheiten zur SANS-Analyse (Word)
Weitere Einzelheiten zur SANS-Analyse (Pdf)
Download
Download this article as a PDF

Übersetzt von Anne Käfer. Mit der steigenden Nutzung von Detergenzien und anderen oberflächenaktiven Stoffen ist die daraus resultierende Verschmutzung besorgniserregend. Eine Antwort: Oberflächenaktive Stoffe, die einfach durch das Ein- und Ausknipsen eines magnetischen Feldes gesammelt und…


Es wird geschätzt, dass jede Person in der EU jährlich ungefähr 10 kg Detergenzien verbraucht. Dies umfasst nicht nur Seifen, Shampoos, Zahncremes, Waschmittel und Haushaltsreinigungsmitteln, die uns vertraut sind, sondern Detergenzienbestandteile, die sowohl in Brennstoffen, Medikamenten als auch im Essen oder Bier vorkommen. In der Industrie werden große Mengen von Lösungsmitteln z.B. in öffentlichen Wäschereien, zur Pflege von Kleidungsstücken und zum Färben von Leder, zum Autowaschen und zur Reinigung und Desinfizierung in Krankenhäusern benutzt.
Sobald sie ihre Reinigungsaufgabe erfüllt haben, werden die Rückstände einfach in die Kanäle gespült und schlussendlich in die Umwelt ausgeschieden. Stell dir vor, diese Abfälle könnten weiterverwendet werden. Dieser Artikel beschreibt einige der neuesten Forschungen zu wiederverwendbaren Detergenzien und wie sie unter Einsatz moderner Forschungsmethoden untersucht werden können.
Oberflächenaktive Stoffe sind Verbindungen, die die Oberflächenspannung einer Flüssigkeit erniedrigen; dadurch eignen sie sich für zahlreiche Anwendungen – z.B. als Emulgatoren, Schaummittel, Benetzungsmittel und Dispergiermittel. Oberflächenaktive Stoffe oder Mischungen von oberflächenaktiven Stoffen, die zum Reinigen benutzt werden, werden als Detergenzien bezeichnet. Das einfachste und älteste aller Detergenzien ist Seife, die schon in Babylon vor beinahe 5000 Jahren benutzt wurde. Tatsächlich ist die Herstellung von Seife einer der ältesten chemischen Industriezweige.
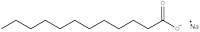
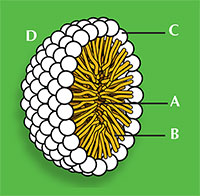
Natriumdodecanoat (Abb. 1) weist die allgemeine Struktur aller oberflächenaktiven Stoffe auf: Ein Teil des Moleküls ist hydrophil, das heißt es ist wasserlöslich, da es einen geladenen „Kopf“ hat, und der Rest des Moleküls ist ein öliger hydrophober „Schwanz“. Die Eigenschaft des Detergens, sich in Wasser zu lösen, liegt in dem Gleichgewicht von intermolekularen Kräften begründet. Der Kopf ist ein negativ beladenes Carboxylation, das fähig ist Wasserstoffbindungen mit Wasser einzugehen, während der wasserlösliche Schwanz keine Wasserstoffbindungen eingehen kann, weil es eine lange Alkankette ist, die keine elektronegativen Elemente aufweist. Das erklärt, warum sich oberflächenaktive Stoffe zu Clustern, sogenannten Mizellen, zusammenschließen (Abb. 2), welche entscheidend für die Wirkung als Reinigungsmittel sind.

Die beiden Enden eines Detergens reagieren unterschiedlich mit nicht-polaren Verschmutzungen wie Fett. Der hydrophobe Schwanz tritt mit dem Fett in Wechselwirkung, während der hydrophile Kopf die Wassermoleküle durch Wasserstoffbindungen anzieht. Mit etwas Rühren verlässt das Fett das Material, an dem es haftete, und bildet fetthaltige Detergens-Tröpfchen; die Oberflächen der Tröpfchen bestehen aus wasserlöslichen hydrophilen Köpfen. Das Fett wird also vom Material entfernt und durch diese Mizellen im Wasser gehalten (Abb. 2).
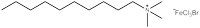
Eine Forschergruppe an der University of Bristol, UK, – einschließlich zwei der Autoren – arbeitet zur Zeit an einem neuen Typ von Surfactant (oberflächenaktiver Stoff): magnetische Surfactants, die auf Grund von Eisenatomen in ihrer Kopfgruppe auf ein magnetisches Feld ansprechen (Abb. 3 und 4). Diese Surfactants könnten für Umweltzwecke und in medizinischen Anwendungen eingesetzt werden.
Wie wurden die magnetischen Surfactants entwickelt? Und wie kann man beweisen, dass man wirklich einen magnetischen oberflächenaktiven Stoff hergestellt hat?
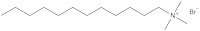
Zunächst einmal nahmen die Forscher in Bristol ein bekanntes Surfactant und ersetzten dessen Bromgruppe durch eine eisenhaltige Gruppe (Abb. 3). Dann zeigten sie, dass diese Verbindung noch als Surfactant wirkte: Sie war in der Lage, die Oberflächenspannung von Flüssigkeiten zu erniedrigen, und führte zur Schaumbildung. Als nächstes zeigte die Gruppe, dass das Eisen in der Kopfgruppe zur gewünschten magnetischen Aktivität führte.
Um jedoch wirklich zu verstehen, was sich abspielt, mussten die Forscher sich ihre Verbindung genauer ansehen. Wenn auch z.B. deren Fähigkeit, die Oberflächenspannung zu erniedrigen, ein deutlicher Hinweis zur Bildung von Mizellen war, so war das noch kein schlüssiger Beweis. Um dies zu testen, benötigten die Forscher eine super-sensitive, spezielle Technik, die als Kleinwinkelneutronenstreuung (SANS) bezeichnet wird.

SANS ist eine hervorragende Technik, um Strukturen zwischen 0,1 und 100 nm zu untersuchen; also genau richtig zur Untersuchung und Charakterisierung von Surfactant-Mizellen und Emulsions-Tröpfchen von einem typischen Durchmesser zwischen 2 und 10 nm. SANS wird genutzt, um weiche Materie (z.B. Polymere, Kolloide und Flüssigkristalle), biologische Moleküle (z.B. DNA und Proteine in Lösung) und harte kondensierte Materie (z.B. Cluster in Legierungen und Flussliniengitter in Supraleitern) zu untersuchen.
In SANS-Versuchen wird ein intensiver Neutronenstrahl auf die zu untersuchende Probe gelenkt (Abb. 5); dieser Strahl kann als ein Strom von freien Partikeln angesehen werden, der sich in die gleiche Richtung und mit gleicher Geschwindigkeit fortbewegt. Die freien Neutronen im Strahl treten in Wechselwirkung mit den im Kern gebundenen Neutronen der Atome in der Probe und führen zu einer Streuung des Strahls. Diese gestreuten Neutronen werden mit einem positions-sensitiven Detektor aufgezeichnet. Die resultierenden Werte – die Intensität der Neutronen, gestreut in verschiedenen Bereichen der Probe – werden in mathematische Modelle eingesetzt, um Größe, Form und Ladung der gestreuten Objekte in der Probe zu bestimmen. Für eine detailliertere Erklärung der SANS-Analyses das weiterführende Material der Science in School webseitew1.
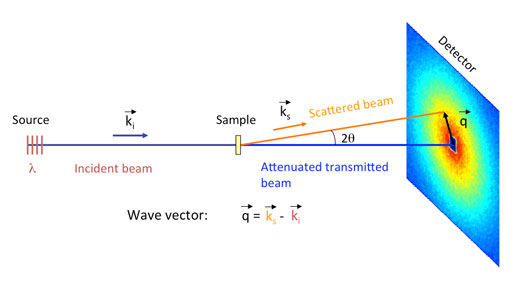
Für ihre SANS-Analyse arbeiteten die Forscher aus Bristol zusammen mit Wissenschaftlern am Institut Laue-Langevin (ILL; s. Kasten) in Grenoble, Frankreich. Obwohl man andere Surfactant-Eigenschaften wie die Reduzierung der Oberflächenspannung schon mit der neuen Verbindung beobachtet hatte, lieferten die SANS-Ergebnisse den ersten schlüssigen Beweis, dass wirklich Mizellen gebildet wurden.
Weiterhin konnten die Wissenschaftler zeigen, dass die durch das neue Surfactant gebildeten Mizellen klein, kugelförmig und ungeladen waren. Das war wichtig, weil das Verhalten eines Surfactants und damit dessen Anwendungen durch die Charakteristika von den Mizellen und Emulsions-Tröpfchen beeinflusst werden, die es mit verschiedenen Flüssigkeiten bildet. Mit dieser Information können die Wissenschaftler nun das Verhalten ihrer Surfactants unter verschiedenen Bedingungen besser vorhersagen und künftig besser erforschen.
Unter Verwendung der SANS konnte das Team auch untersuchen, ob die Eisen-Partikel in Lösung vom Surfactant dissoziierten, was zu einer Mischung von nicht-magnetischen Surfactants und gelösten magnetischen Partikeln geführt hätte, oder ob die beiden Elemente aneinander unter Bildung von wirklich magnetischen Mizellen gebunden blieben. Die Ergebnisse sagten aus, dass die Eisenverbindungen fest in den Mizellen integriert waren. Das eröffnete die Möglichkeit, magnetische Emulsionen mit potenzieller medizinischer Anwendung zu schaffen (s. unten).

Magnetische Surfactants hören sich vielleicht nach einer seltsamen Idee an, aber sie könnten einige praktische Anwendungen haben. Viele Surfactants sind z.B. nicht biologisch abbaubar. Wenn man stattdessen magnetische Surfactants verwenden würde, könnten sie aus dem Abwasser mit einem magnetischen Feld zurückgewonnen und rezyklisiert werden, was zu einer geringeren Umweltbelastung durch Detergenzien führen würde.

Weiterhin, wenn es Ölverschmutzungen auf dem Meer gibt, werden zur Zeit Surfactants verwendet, um die Ölteppiche in Emulsionströpfchen aufzubrechen, die so klein sind, dass sie in den Ozean diffundieren, wo das Öl eine Umweltgefährdung bleibt. Nutzt man dagegen magnetische Surfactants, könnte man die resultierenden Emulsionen aufnehmen, wobei man sowohl das Öl als auch das Surfactant vom Wasser entfernt.
Magnetische Surfactants könnten medizinische Anwendung finden. Gezielte Wirkstofffreisetzung hat zum Ziel, die Wirkstoffe nur in den Zellen freizusetzen, wo es nötig ist, um eine Verschwendung von wertvollen pharmazeutischen Verbindungen zu verhindern und um Nebenwirkungen zu minimieren. Abb. 6 zeigt, wie Emulsionströpfchen (blau eingefärbt), die mit magnetischen Surfactants gebildet werden, mit einem kleinen Magneten so gesteuert werden können, dass sie die typische Blutströmung überwinden. Diese Emulsionen könnten Wirkstoffe in gleicher Weise einkapseln, wie es zur Zeit mit Emulsionen in der Wirkstofffreisetzung geschieht, aber die magnetischen Emulsionen könnten mit einem Magneten an die richtige Stelle im Körper geleitet werden.

Magnetische Surfactants sind nicht der einzige Typ von Surfactants, die in Bristol entwickelt werden. Das Forschungsteam untersucht auch Surfactants, die durch Änderungen des Lichtes, des pH-Wertes, der Temperatur, des Druckes und der Kohlendioxid-Konzentration an- und ausgeschaltet werden können. Die gegenwärtige Herausforderung besteht darin herauszufinden, wie die Synthese dieser Surfactants in größerem Maßstab durchgeführt werden kann, um diese intelligenten Surfactants billig und wirksam zu machen.

SANS-Versuche erfordern intensive Neutronenstrahlen, wie sie nur in großen Einrichtungen erzeugt werden können. In Europa erfolgt dies in Laboratorien, die gemeinsam durch länderübergreifende Zusammenschlüsse wie ISISw2, in Großbritannien, und das Institut Laue-Langevin (ILL)w3, in Frankreich finanziert und betrieben werden.

ILL ist ein internationales Forschungszentrum mit der intensivsten Neutronenquelle weltweit. Jährlich werden mehr als 800 Versuche von über 2000 Wissenschaftlern aus der ganzen Welt durchgeführt. Die Forschung konzentriert sich auf Naturwissenschaften in zahlreichen Gebieten: Festkörperphysik, Chemie, Biologie, Kerphysik und Materialwissenschaften.
ILL ist Mitglied von EIROforumw4, Herausgeber von Science in School.
Brown P et al. (2012b) Magnetic control over liquid surface properties with responsive surfactants. Angewandte Chemie 51: 2414-2416. doi: 10.1002/anie.201108010
Kaiser A, Rau M (2010) LeSa21: primary-school science activities. Science in School 16: 45-49.
Weitere Einzelheiten zur SANS-Analyse (Word)
Weitere Einzelheiten zur SANS-Analyse (Pdf)
Download this article as a PDF