Violette Dämpfe: die Bedeutung von Jod Understand article
Übersetzt von Veronika Ebert, Höhere Bundeslehr- und versuchsanstalt für chemische Industrie, Wien. Das Element Iod, mit seinen charakteristischen violetten Dämpfen, wird auf vielfältige Art und Weise angewandt: vom allseits bekannten Desinfektionsmittel bis zu innovativen Solarzellen.

Mit freundlicher Genehmigung
von Eleanor A Merritt
Was macht Iod eigentlich so bedeutsam und interessant? Nicht nur seine Sublimation zu einem effektvollen violetten Gas, sondern auch sein Einfluss auf viele Aspekte des Lebens auf der Erde, und auf die menschliche Zivilisation. War ihnen bekannt, dass Iod Meeresalgen vor oxidativen Schäden, wie sie z.B. durch die Einwirkung des Sonnenlichts entstehen können, schützt? Dass die Zufuhr von Iod einige Geburtsfehler verhindern kann, und Iod in der Industrie für unterschiedliche Zwecke verwendet wird?
Die Entdeckung von Iod kann bis zu den napoleonischen Kriegen im 19. Jahrhundert zurückverfolgt werden. Durch die britische Blockade der europäischen Häfen litten die Franzosen unter einem Mangel an Salpeter (KNO3), das für die Herstellung von Schwarzpulver erforderlich ist. Der Chemiker Bernard Courtois untersuchte deshalb die Eignung von Seetang (Braunalge, Laminaria sp.) als Kaliumquelle für diesen äußerst wichtigen Grundstoff. Er versetzte die Asche von Seetang mit Schwefelsäure, und staunte dabei über die Entstehung wunderschöner violetter Dämpfe.

Gay-Lussac, einem
französischen Physiker und
Chemiker, von François
Séraphin Delpech (1778–
1825)
Public Domain Bild /
Wikimedia Commons
Obwohl Courtois vermutete, dass es sich bei dem violetten Dampf um ein neues chemisches Element handelte, verfügte er nicht über die notwendigen finanziellen Mittel zur Fortsetzung seiner Forschungsarbeiten. Es blieb seinen Kollegen, darunter Joseph Gay-Lussac überlassen, seine Ergebnisse zu bestätigen und das neue Element als „Iod“ zu bezeichnen. “Iod” kommt vom griechischen, Wort “iodes”, übersetzt „ lila“ oder „violett“.
Gay-Lussac setzte seine Forschungsarbeiten über die Chemie des Iods fort, und trotz des Kriegs gelang es den französischen Chemikern mit britischen Fachkollegen Kontakt aufzunehmen, namentlich mit Sir Humphry Davy. Zu Beginn vermutete Davy, dass es sich bei den Dämpfen um eine Chlorverbindung handelt, doch bald setzte sich die Erkenntnis durch, dass tatsächlich ein neues Element entdeckt worden ist.

akkumulieren Iod stärker als
alle andere Lebewesen. Foto
von der Küste von
Dunstaffnage, nahe Oban,
Schottland, UK
Mit freundlicher Genehmigung
von FCK
Aus Röntgenstrukturanalysedaten weiß man, dass Seegras (Abbildung 2) Iod in Form des Iodidions (I–) speichert. Iodid wirkt als Antioxidans und schützt das Seegras somit vor oxidativen Schäden durch atmosphärisches Ozon (O3). Das erklärt einerseits, warum Spuren von molekularem Iod in der küstennahen Atmosphäre detektiert werden können, und andererseits, warum die Aufnahme von Iod durch den Menschen in diesen Gegenden stärker von der Häufigkeit des Seegrases, als von der Entfernung zum Meer bestimmt wird.
Während des folgenden Jahrhunderts wurde Iod überwiegend aus Seegras extrahiert. Heutzutage wird Iod aus natürlichen Iod-hältigen Salzlaken in Gas- und Ölfeldern in Japan und in den USA isoliert, bzw. aus chilenischen Calichen (Nitraterze), die Calciumiodat (Ca(IO3)2) enthalten. Iod wird als schwarzvioletter Feststoff verkauft.
Chemische Eigenschaften von Iod
Da Iod zu den Halogenen gehört, besitzt es viele charakteristische Eigenschaften der Elemente dieser Gruppe. Iod bildet wegen seiner großen Elektronegativität mit den meisten Elementen Iodide, wobei es die Oxidationsstufe von (-1) annimmt. Viele Iod-hältige Verbindungen werden routinemäßig als Reagenzien für organische Synthesen eingesetzt, vor allem für Iodierungen, Oxidationen und zur Synthese von C-C-Bindungen.
Das atmosphärische Iod stammt vor allem aus biologischen und chemischen Prozessen in den Ozeanen, wie z.B. dem iodbasierten Antioxidationssystem des Seegrases. Der Großteil des atmosphärischen Iods wird letztlich durch Wolkenbildung entfernt. Im Meer kommt Iod vor allem in gelöster Form als Iodat (IO3–, oxidierte Form) und Iodid (I–, reduzierte Form) vor. In der Lithosphäre, der äußersten Schicht der Erde, findet man Jod vor allem in marinen und terrestrischen Sedimenten. Magma enthält nur geringe Iodmengen.
Die physiologische Bedeutung von Iod
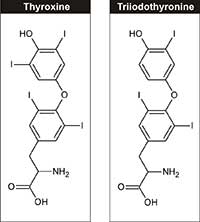
Thyroxin (T4) und
Triiodotyrosin (T3)
Mit freundlicher Genehmigung
von Michael Zimmermann
Aus physiologischer Sicht ist Jod ein essentielles Element, das für die Synthese der Schilddrüsenhormone (Triiodotyrosin und Thyroxin, siehe Abbildung 3) erforderlich ist. Diese Hormone steuern das Wachstum, die Entwicklung und den Zellstoffwechsel. Die empfohlene Tagesdosis, die 150 µg für Erwachsene beträgt, kann durch Milchprodukte, Seegras und iodiertes Salz aufgenommen werden.
Das klassische Symptom eines Iodmangels ist die Vergrößerung der Schilddrüse (Kropf). Um die Aufnahme des verfügbaren Iods zu maximieren, schüttet der Hypophysenvorderlappen bei verringerter Iod Zufuhr steigende Mengen an Thyreoidea-stimulierendem Hormon (TSH) aus. Dies ist die Ursache für die Vergrößerung der Schilddrüse.
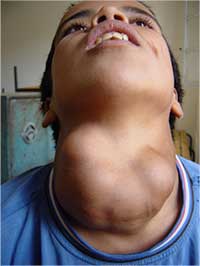
einem durch Iodmangel
verursachten Kropf
Mit freundlicher Genehmigung
von Michael Zimmermann
Am stärksten schädigt Iodmangel die Gehirnentwicklung von Babys, wodurch geistige Behinderungen verursacht werden können. Außerdem korreliert starker Iodmangel in der Schwangerschaft mit einer erhöhten Rate an Totgeburten, Fehlgeburten und Geburtsfehlern.
Die effizienteste Methode Iodmangel zu verhindern ist, Speisesalz Kaliumiodid (KI) oder Kaliumiodat (KIO3) zuzusetzen. In etwa 120 Ländern ist es gängige Praxis, Speisessalz zu iodieren, wodurch mehr als 70% der Weltbevölkerung mit jodiertem Salz versorgt werden können.
Industrielle Nutzung von Iod
Iod und seine Verbindungen werden in einer Vielzahl von Produkten verwendet, von Lebensmitteln über Pharmazeutika bis zu Futtermitteln und als industrielle Katalysatoren (Abbildung 4). Iod ist zum Beispiel ein starkes Desinfektionsmittel. Mehr als ein Jahrhundert lang wurde Iodtinktur (Mischung aus Ethanol, Wasser, Iod und Kaliumiodid) als Desinfektionsmittel für Wunden eingesetzt. Diese Mischung wurde weitgehend durch wasserlösliche Ionophore (Komplexe von Iod mit Tensiden) ersetzt, weil diese hautfreundlicher sind. So ist Povidoniod, eine Mischung aus Polyvinylpyrrolidon und Iod, als chirurgisches Desinfektionsmittel weit verbreitet.
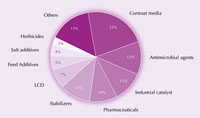
Einsatzgebiete von Iod. Zum
Vergrößern auf das Bild
klicken.
Mit freundlicher Genehmigung
von Tatsuo Kaiho
Für die industrielle Produktion von Essigsäure werden Iodverbindungen wie Rhodiumiodid (im Monsantoprozess) oder Iridiumiodid (für den Cativa-Prozess von BP) als Katalysatoren zur Carbonylierung von Methanol verwendet.
Silberiodid (AgI), das früher zur Herstellung fotographischer Platten verwendet worden ist, wird als Kondensationskeim zur Wolkenbildung eingesetzt, um Regen auszulösen und somit das Wetter zu kontrollieren. Das wurde zum Beispiel bei den olympischen Spielen in Peking 2008 gemacht, um Regenfälle während der Eröffnungs- und Abschlusszeremonien zu verhindern.

seitliche
Silberiodidgeneratoren zur
Auslösung der Wolkenbildung
Mit freundlicher Genehmigung
von Christian Jansky /
Wikimedia
Da Iod ein hohes Atomgewicht (126,9) und eine große Zahl an Elektronen besitzt, kann es hervorragend Röntgenstrahlen absorbieren, und wird daher als Röntgenkontrastmittel eingesetzt. Iod-hältige Röntgenkontrastmittel sind grundsätzlich für den Menschen ungefährlich, und ermöglichen die Visualisierung von Weichteilen bei Röntgenuntersuchungen.
Im Alltag wird Iod für Flüssigkeitskristallanzeigen von Fernsehgeräten, Computern und Mobiltelefonen, die polarisiertes Licht zur Filterung des Lichts verwenden, eingesetzt. Diese Schichten werden üblicherweise aus Polyvinylalkoholschichten hergestellt, die mit Iodatomen dotiert sind, wodurch die Schichten polarisierende Eigenschaften erhalten.
Iod in der Energiewirtschaft

Tricastin, Frankreich liegt in
der Nähe eines
dichtbesiedelten Landstrichs.
Etwa alle fünf Jahre werden
an die in der Region
lebenden Menschen
Kaliumiodidtabletten verteilt,
um die Schädigung der
Schilddrüse bei einem
atomaren Störfall zu
verhindern.
Mit freundlicher Genehmigung
von the AIEA /Wikimedia
Auch in den vielversprechendsten am Markt zur Herstellung preiswerter „grüner Energie“ befindlichen Solarzellen wird Iod verwendet. Es handelt sich um Solarzellen aus Titanoxid, die mit Farbstoffen lichtempfindlich gemacht worden sind. Sie werden nach einem ihrer Erfinder auch Grätzelzellen genannt und bestehen aus Polyiodidelelektrolyten als Ladungsträger zwischen Kathode und Anode (nähere Informationen bei Shallcross et al., 2009).
Von den 37 bekannten Isotopen des Jods ist nur eines, nämlich 127I, nicht radioaktiv. Der Großteil der radioaktiven Isotope, die bei Kernspaltungsreaktionen in Kernkraftwerken und bei Atomwaffen entstehen können, ist kurzlebig, und daher als Tracer und Therapeutikum für die Medizin geeignet. Da die Schilddrüse radioaktives Iodid nach Injektion in die Blutbahn absorbiert, können Iodisotope zur Darstellung dieses Organs verwendet werden.
Unglücklicherweise wird auch das radioaktive131I, das bei Atomunfällen wie der Katastrophe von Fukushima (Japan) 2011 freigesetzt wird, von der Schilddrüse aufgenommen. Es kann – als hoch energetischer ß-Strahler – Zellen schädigen und Krebs verursachen. Werden Kaliumiodid (KI)-Tabletten geschluckt, die eine weitere Aufnahme von Iod durch der Schilddrüse unterbinden, kann verhindert werden, dass die Schilddrüse radioaktives Iod aufnimmt.
Das waren nur einige Beispiele für die Anwendungsmöglichkeiten von Iod. Obwohl dieses Element erst seit 200 Jahren bekannt ist, hat es sich in der modernen Chemie, Physik und Medizin gut etabliert.
These are just a small sample of the many applications of iodine. Clearly, although the element has been known for only two hundred years, it is well established in modern chemistry, physics and medicine.
Iod im Klassenzimmer
Zweifellos kennen alle das farbenprächtige Ioduhrexperiment mit Wasserstoffperoxid, Kaliumiodid, Stärke und Natriumthiosulfat. Es gibt aber viele andere Möglichkeiten, Iod mit Experimenten in den Unterricht zu einzuführen. Beispiele:
- Unter Katalyse von Wasser reagieren Aluminium und Iod miteinander unter Bildung spektakulärer Wolken aus violetten Joddämpfen.
- Zinkpulver reagiert – in Form einer direkten Reaktion zwischen einem Metall und einem Nichtmetall- mit einer ethanolischen Iodlösung und bildet in einer exothermen Redoxreaktion Zinkiodid.
- Kaliumiodid eignet sich zum Nachweis von Stärke in verschiedenen Lebensmitteln.
- Verschiedene Lösungen, wie z.B. eine wässrige Natriumiodidlösung, können elektrolysiert werden, und die Produkte an den Elektroden nachgewiesen werden. Die Schüler/innen können mit Hilfe ihrer praktischen Erfahrungen und ihrem theoretischen Wissen einfache Ionengleichungen aufstellen.
Details dieser Experimente und viele weitere für den Unterricht geeignete Versuche können von der Learn Chemistry Webseitew1 herunter geladen werden.
Danksagungen
Bei diesem Artikel handelt es sich um die Kurzfassung einer längeren Veröffentlichung in Angewandte Chemie International Edition (Küpper et al., 2011).
References
- Küpper FC, Feiters MC, Olofsson B, Kaiho T, Yanagida S, Zimmermann MB, Carpenter LJ, Luther GW, Lu Z, Jonsson M, Kloo L (2011) Commemorating two centuries of iodine research: an interdisciplinary overview of current research. Angewandte Chemie International Edition 50: 11598-11620. doi: 10.1002/anie.201100028
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Looking to the heavens: climate change experiments. Science in School 12: 34-39.
Web References
-
w1 – Die „Learn Chemistry Webseite“ der UK’s Royal Society of Chemistry stellt einen breite Auswahl an herunterladbaren Lern- und Unterrichtsunterlagen für den Chemieunterricht zur Verfügung.
Review
In dieser kurzen Zusammenfassung über das Element Iod führen die Autoren/innen durch die Geschichte und zahlreiche Anwendungsbereiche dieses wichtigen Elements, von der Medizin, über die Industrie bis zur Energieerzeugung. Vorschläge für Schulexperimente lenken das Interesse auf dieses Thema und bieten Anreize, sich weiter damit auseinanderzusetzen.
Durch den einfachen und klaren Stil eignet sich der Artikel nicht nur für Naturwissenschaftslehrkräfte aus Europa, sondern auch für ihre Schüler/innen im Alter von 13-18. Er kann in Chemie (Periodensystem, Halogene), Biologie (endokrine Drüsen, Schilddrüse und Schilddrüsenerkrankungen) und Physik (Isotope, Radioaktivität und Solarzellen) eingesetzt werden. Es bietet sich auch die Möglichkeit, sich interdisziplinär mit Wissenschaftsgeschichte (der Entdeckung der Elemente), der Rolle der Wissenschaft bei der Entwicklung von Waffen, oder den Beziehungen zwischen Wissenschafter/innen verfeindeter Staaten während des Krieges zu beschäftigen.
Zusammenfassende Fragestellungen wären:
- Aus dem Artikel lässt sich ableiten, dass Seetang Iod akkumuliert,
- um das atmosphärische Ozon zu oxidieren
- um das atmosphärische Ozon zu absorbieren
- um atmosphärisches Ozon zu produzieren
- um sich selbst vor atmosphärischem Ozon zu schützen.
- Wenn wir nicht genug Iod erhalten,
- vergrößert/verkleinert sich unsere Schilddrüse
- schüttet unser Hypophysenvorderlappen weniger/mehr Thyreoidea-stimulierendes Hormon aus.
Giulia Realdon, Italien





