Proteinkristalle züchten Teach article
Übersetzt von Veronika Ebert Höhere Bundeslehr- und versuchsanstalt für chemische Industrie, Wien. Beat Blattmann und Patrick Sticher von der Universität Zürich erläutern den wissenschaftlichen Hintergrund der Proteinkristallographie und liefern eine Arbeitsanleitung für die Generierung…

und zerbrechliche Objekte,
mit weniger als einem
Millimeter Durchmesser, und
schwer zu züchten. Dennoch
sind sie unverzichtbar für
strukturbiologische Studien
mit Röntgenstrahlung.
Mit freundlicher Genehmigung
von Gaby Sennhauser,
Universität Zürich
1959 veröffentlichten Max Perutz und John Kendrew einen Artikel über die dreidimensionale Struktur des Wal-Myoglobins, eines kleinen Proteins, das in den Zellen des Wals für den Transport von Sauerstoff verantwortlich ist. Durch die Untersuchung der Struktur wollten die beiden Wissenschaftler ein Verständnis für den Mechanismus des Sauerstofftransports auf molekularer Ebene gewinnen. Sie züchteten Proteinkristalle, und konnten anschließend die Struktur des Proteins im Kristall durch die Analyse des Beugungsmusters von Röntgenstrahlen ermitteln.
Bevor Perutz und Kendrew brauchbare Beugungsmuster von Walmyoglobin erzeugen konnten, sind schon mehrere Myoglobine anderer Arten ohne nennenswerten Erfolg untersucht worden. Diese Pionierleistung wurde 1962 mit dem Nobelpreis für Chemie ausgezeichnetw1. Aber auch fünfzig Jahre später ist es noch schwierig, Kristalle, die sich für die Strukturuntersuchung eignen, herzustellen.
Was sind Proteine?
Proteine sind die größte Gruppe nicht-wässriger Inhaltsstoffe lebender Zellen. Fast jede biochemische Reaktion erfordert ein spezifisches Protein, „Enzym“ genannt. Andere Proteine haben mechanische und strukturelle Funktionen (z.B. Kollagen im Bindegewebe), vermitteln zelluläre Signalprozesse (z.B. Hormonrezeptoren) oder Immunreaktionen (z.B. Antikörper). Andere sind für den Transport kleiner Moleküle verantwortlich (z.B. Ionenkanäle). Die Vielfalt ist enorm: allein vom Menschen sind mehr als 20 000 unterschiedliche Proteine bekannt.
Trotz dieser Vielfalt folgen alle Proteine dem gleichen Bauprinzip. Sie bestehen aus 20 verschiedenen Bausteinen, den Aminosäuren. Aus diesen wird eine lineare Kette gebildet, in der die benachbarten Aminosäuren durch kovalente Bindungen verknüpft sind (siehe Abbildung unten). Die Länge der Kette variiert von einigen Duzend bis zu tausenden miteinander verknüpften Aminosäuren. Jedes Protein wird in den Zellen nach Anleitung des korrespondierenden Gens zusammen gebaut. Dieser Zusammenbau erfolgt an den Ribosomen, einer komplexen molekularen Maschine aus Proteinen und RNA.
Proteine werden in definierte dreidimensionale Strukturen gefaltet
Unter natürlichen Bedingungen falten sich linearen Aminosäureketten spontan in definierte dreidimensionale Strukturen. Kürzere Abschnitte der Aminosäurekette bilden typische Sekundärstrukturen aus, am bekanntesten sind α-Helices und β-Faltblätter (siehe Abbildung unten). Diese Sekundärstrukturen werden üblicherweise durch Wasserstoffbrücken zwischen einzelnen Aminosäuren stabilisiert. Das gesamte Protein bildet eine sogenannte Tertiärstruktur, die aus unterschiedlichen derartigen Strukturelementen besteht.
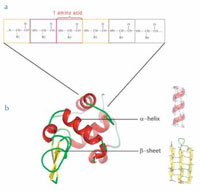
b. Proteine sind in dreidimensionale Strukturen gefaltet, die ihre Funktion bestimmen. Kurze Abschnitte der Aminosäurekette zeigen charakteristische Faltungsmuster. Zwei bedeutende Strukturelemente sind die α-helices und die β-Faltblätter.
Zur Vergrößerung anklicken.
Mit freundlicher Genehmigung von Marc Leibundgut, ETH Zürich, und www.pdb.org
Struktur bedingt Funktion: Was kann aus der dreidimensionalen Struktur eines Proteins abgeleitet werden?
Die Funktion eines bestimmten Proteins hängt von seiner dreidimensionalen Struktur ab. Nur wenn das Protein gefaltet ist, liegen die spezifischen Aminosäuren nahe genug um ein „aktives Zentrum“ auszubilden. Diese Zentren können, wie bei den Enzymen, biochemische Reaktionen katalysieren, oder spezifische Bindungsstellen ausbilden, wie bei den Antikörpern. Um zu verstehen, wie fundamentale Prozesse des Lebens auf molekularer Ebene ablaufen, ist es wichtig, die strukturellen Details eines Proteins zu untersuchen: Das ist das Forschungsgebiet der Strukturbiologen/innen. Die Aufklärung der Struktur, Funktion und der Interaktionen großer makromolekularer Komplexe und Membranproteine gehört zu den größten Herausforderungen der Strukturbiologiew2. Diese Proteine sind wegen ihrer Komplexizität extrem schwer zu untersuchen, und jede einzelne Bestimmung der Struktur eines Proteins ein Meilenstein. Trotzdem besteht nach wie vor großes Interesse, die Struktur und Funktion von Proteinen besser zu verstehen, da diese an fundamentalen biologischen Prozessen beteiligt sind. Die Wissenschafter/innen versuchen daher weiter, sie zu kristallisieren.
Mit freundlicher Genehmigung von Beat Blattmann und Patrick Sticher
Proteins sind zu klein zur direkten Beobachtung
Proteine sind sehr kleine Strukturen in der Größenordnung von wenigen Nanometern (1 nm = 1 Millionstel Teil eines mm). Partikel dieser Größe können nicht einmal mit dem stärksten Lichtmikroskop visualisiert werden, da die maximale Auflösung eines Lichtmikroskops 1 Mikrometer beträgt (1 µm = 1 Tausendstel eines mm). Es gibt drei wichtige Technologien, Proteinstrukturen “sichtbar” zu machen:
- Röntgenstrukturanalyse von Proteinkristallen
- Kernresonanzspektroskopie (nuclear magnetic resonance, NMR)
- Elektronenkristallographie
Da mehr als 90% aller Proteinstrukturen, die in öffentlich zugänglichen Proteindatenbankenw3 abgelegt worden sind, mittels Röntgenstrukturanalyse aufgeklärt werden konnten, werden wir uns auf diese Methode konzentrieren. Weitere Information über die Geschichte der Kristallographie und die Reise eines Proteins von Labor zu Labor bis zur Aufklärung seiner Struktur, finden sich im Artikel von Dominique Cornuéjols in dieser Ausgabe.
Die Kristallisation von Protein ist kniffelig, weil es schwierig ist, die richtigen Bedingungen zur Kristallisation des jeweiligen Proteins zu finden, manchmal scheint dies völlig unmöglich zu sein. Die Wissenschaftler/innen verwenden kontrollierte experimentelle Bedingungen zur Kristallisation ihrer Proteine, um eine reproduzierbare Kristallqualität zu garantieren (d.h. um gleich gute Kristalle erneut herstellen zu können). Die am häufigsten angewandte Methode zur Proteinkristallisation ist die Dampfdiffusionsmethode (siehe Abbildung): Dabei wird ein kleines Volumen der Kristallisationslösung in das Reservoir einer Kristallisationskammer eingefüllt. Dann wird ein Tropfen Proteinlösung und ein Tropfen der Kristallisationslösung als „sitzender Tropfen“ („sitting drop“) in der Mitte der Kammer pipettiert.
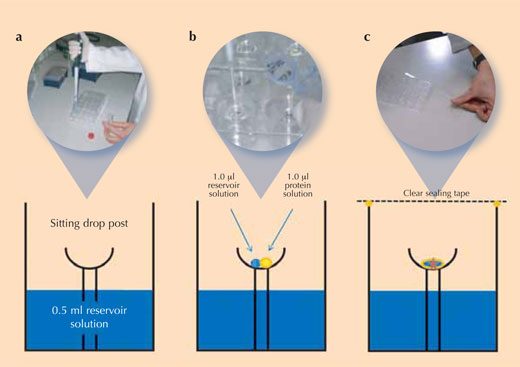
Mit freundlicher Genehmigung von Beat Blattmann and Patrick Sticher
Unmittelbar nach Zugabe aller Lösungen wird die Kammer verschlossen, um Verdunstung zu verhindern. Da die Salzkonzentration in der Kristallisationslösung größer ist als im sitzenden Tropfen, werden sich Lösungsmittelmoleküle vom Proteintropfen durch Dampfdiffusion in das Reservoir bewegen. Während dieses Prozesses sinkt die Löslichkeit des Proteins im Tropfen. Die Proteinlösung im Tropfen wird irgendwann übersättigt sein, das ist ein thermodynamisch instabiler Zustand. Dadurch wird ein Teil des Proteins im Tropfen entweder Kristallisatonskeime bilden, die zu größeren Proteinkristallen heranwachsen können (siehe Abbildung), oder als amorphes Protein ausfallen, das für die Röntgenstrukturanalyse nicht geeignet ist .Da Kristallisation und Präzipitation miteinander konkurrieren, ist es extrem wichtig, optimale Kristallisationsbedingungen zu finden.
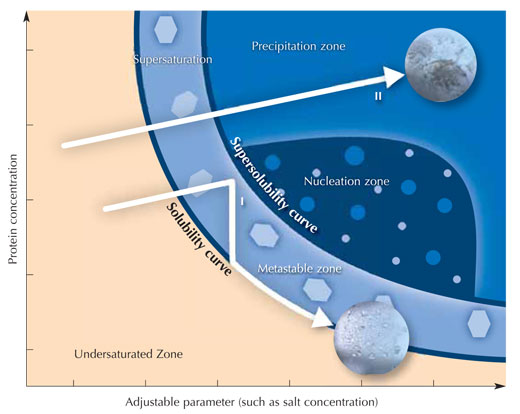
Mit freundlicher Genehmigung von Nicola Graf
Lysozymkristalle im Klassenzimmer
Bei diesem Experiment lernen die Schüler/innen mehr über die Röntgenstrukturanalyse, indem sie die optimalen Kristallisationsbedingungen für ein Protein ausprobieren. Sie untersuchen die Bildung von Lysozymkristallen in Abhängigkeit vom pH-Wert und der Salzkonzentration.
Lysozym
Lysozym ist ein Protein, das zu einer Familie von antibakteriellen Enzymen, die bakterielle Zellwände zerstören, gehört. Beim Menschen kommt es häufig in Sekreten, wie der Tränenflüssigkeit, im Speichel, und im Schleim, vor. Große Mengen Lysozym finden sich auch in Hühnereiweiß.
Materialien und Geräte
- Ein oder zwei Cryschem™ Kristallisationsplatten (Hampton Research) pro Klasse
- Transparentes Klebeband (5 cm) (Hampton Research)
- 1 mL und 1 µL Mikroliterpipetten
- Mikroskop zur Beobachtung der Kristalle
- Möglichkeit zur Temperierung bei 20 °C
Chemikalien
- Lysozym (SigmaAldrich Produkt #62971, BioChemika grade –Lysozym aus anderer Quelle ist vermutlich auch geeignet, da das Sigmaprodukt mit der nachfolgenden Arbeitsanleitung sehr genau getestet worden ist, wird – um auf der sicheren Seite zu sein – empfohlen, dieses zu verwenden.
- Natriumchlorid (NaCl) – Tafelsalz aus dem Supermarkt ist ausreichend
- Zitronensäure
- Natriumacetat
- Natriumdihydrogenphosphat
- Natriumhydroxid
- Eisessig
- entionisiertes Wasser
Stammlösungen
Die folgenden Lösungen sollten im voraus von der Lehrkraft vorbereitet werden:
- 50 mg/mL Lysozym-Stammlösung in Wasser
- 3 mol/L Natriumchlorid
17,53 g NaCl in 100 mL entionisiertem Wasser auflösen. - 1 mol/L Natriumcitrat, pH 3,5
19,24 g Zitronensäure in 100 mL entionisiertem Wasser auflösen, mit Natronlauge auf pH 3,5 einstellen. - 1 mol/L Natriumacetat, pH 4,5
13,6 g Natriumacetat in 100 mL entionisiertem Wasser auflösen, mit Eisessig pH-Wert auf 4,5 einstellen. - 1 mol/L Natriumacetat, pH 5,5
13,6 g Natriumacetat in 100 mL entionisiertem Wasser auflösen, mit Eisessig auf pH 5,5 einstellen - 1 mol/L Natriumphosphat, pH 6,5
15,6 g Natriumphosphat in 100 mL entionisiertem Wasser auflösen, mit Natronlauge auf pH 6,5 einstellen.
Kristallisationsexperiment
- 24 Reservoirlösungen laut Tabelle aus den Stammlösungen herstellen. Die Schüler/innen können kleine Gruppen bilden, wobei jede einen Teil der 24 unterschiedlichen Lösungen herstellt. Alle Gruppen können die gleichen Stammlösungen verwenden.
- Mit Hilfe der Tabelle, 0,5 mL der jeweiligen Reservoirlösung in je eines der 24 Reservoirs einer Cryschem™ Platte pipettieren („a“ in der Abbildung oben). Die Tabelle fasst die Bedingungen in jedem einzelnen Näpfchen zusammen und zeigt die jeweilige Position auf der Platte.
- In jedes Näpfchen 1µL der Reservoirlösung als sitzender Tropfen in die Kristallisationsschale pipettieren („b“ in der Abbildung oben)
- 1 µL Lysozym-Stammlösung zu jedem 1µL Reservoirlösungs-Tropfen zufügen („b“ in der Abbildung oben).
- Zur Vermeidung von Verdunstung Kristallisationsgefäß unmittelbar nach Zugabe der Proteinlösung mit einem transparenten Klebeband verschließen („c“ in der Abbildung oben)
- Platte bei 20 °C inkubieren. In einigen Näpfchen werden sofort Kristalle wachsen, das Wachstum kann in 1-2 stündigen Intervallen direkt unter dem Mikroskop verfolgt werden. Lagerung der Platten bis zur nächsten Stunde für die finale Analyse. Nach 1-2 Wochen sind die Kristalle zu ihrer endgültigen Größe herangewachsen. Eine verschlossene Platte ist bis zu einem Jahr haltbar, manchmal sogar länger.
- Größe, Zahl und Verteilung der Lysozymkristalle untersuchen. Da manche Kristalle zu klein sind, um mit freiem Auge sichtbar zu sein, ist eine starke Lupe, oder besser, ein Mikroskop sehr nützlich.
- Nach 24 Stunden optimale Kristallisationsbedingungen feststellen.
| 1 | 2 | 3 | 4 | 5 | 6 | ||
|---|---|---|---|---|---|---|---|
|
|
2,0 ml einer 3mol/L NaCl Stammlösung (Endkonzentration 0,6 mol/L) 7,0 ml entionisiertes Wasser |
3,0 ml einer 3mol/L NaCl Stammlösung (Endkonzentration 0,9 mol/L) 6,0 ml entionisiertes Wasser |
4,0 ml einer 3mol/L NaCl Stammlösung (Endkonzentration 1,2 mol/L) 5,0 ml entionisiertes Wasser |
5,0 ml einer 3mol/L NaCl Stammlösung (Endkonzentration 1,5 mol/L) 4,0 ml entionisiertes Wasser |
6,0 ml einer 3mol/L NaCl Stammlösung (Endkonzentration 1,8 mol/L) 3,0 ml entionisiertes Wasser |
6,0 ml einer 3mol/L NaCl Stammlösung (Endkonzentration 1,8 mol/L) 3,0 ml entionisiertes Wasser |
|
| a | 1,0 ml Natriumcitrat (Endkonzentration 0,1 mol/L), pH 3,5 |
A1 |
A2 | A3 | A4 | A5 |
A6 |
| b | 1,0 ml Natriumacetat (Endkonzentration 0,1 mol/L), pH 4,5 | B1 | B2 | B3 | B4 | B5 | B6 |
| c | 1,0 ml Natriumacetat (Endkonzentration 0,1 mol/L), pH 5,5 | C1 | C2 | C3 | C4 | C5 | C6 |
| d | 1,0 ml Natriumphosphat (Endkonzentration 0,1 mol/L), pH 6,5 | D1 | D2 | D3 | D4 | D5 | D6 |
Untersuchung der selbst gezüchteten Kristalle mit Röntgenstrahlung
Wenn die Klasse erfolgreich Proteinkristalle gezüchtet hat, Dr Patrick Sticher sticher@bioc.uzh.ch kontaktieren. kontaktieren. Das Schweizer NCCR (Schweizer Nationales Kompetenzzentrum für Strukturbiologie)w2 bietet den ersten zehn Schulklassen, die mit dieser Arbeitsanleitung erfolgreich Proteinkristalle gezüchtet haben, die Erstellung eines Röntgenbeugungsdiagramms an. Die Röntgenstrukturanalyse kann entweder direkt mit den Kristallen aus der Schule, oder – wenn der Versand zu aufwändig ist – durch Untersuchung von Kristallen, die mit den jeweiligen Klasse festgestellten optimalen Kristallisationsbedingungen gezüchtet worden sind, durchgeführt werden. Gemeinsam mit den Beugungsbildern werden weiterführende Informationen zur Analyse der erhaltenen Daten übermittelt, um die jeweilige Proteinstruktur zu bestimmen, Wenn gewünscht, wird ein Zertifikat mitgeliefert.
Chat mit Wissenschafter/innen
Die Schüler/inne können nach Abschluss ihrer Experimente online via Skypew4 mit den Wissenschaftler/innen kommunizieren. Zur Terminvereinbarung für den Chat via Skype Patrick Sticher per E-Mail (sticher@bioc.uzh.ch) kontaktieren, Konto „proteincrystallography“).
Herunterladen weiterer Unterrichtsmaterialien
Ein Satz Powerpointfolien, Abbildungen und weitere Experimentalanleitungen sind online verfügbarw5.
Bezugsquellen
Die nachfolgend angeführten Bezugsquellen liefern die benötigten Materialien und Chemikalien:w6
Hampton Research:
- Cryschem™ 24-1 SBS plate, Kat. Nr. HR1-002 (Wir empfehlen die Verwendung dieser Platte. Eine Platte kostet etwa 3US$).
- Transparentes Klebeband (5 cm), Kat. Nr. HR4-511
Gilson Inc:
- 1 mL und 1µL Mikroliterpipetten
Sigma Aldrich:
- Lysozym, Produktcode #62971
- Natriumchlorid, Produktcode #71380
- Zitronensäure, Produktcode #27488
- Natriumacetat, Produktcode #71190
- Natriumdihydrogenphosphat, Produktcode #71502
References
- Cornuéjols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76. www.scienceinschool.org/2009/issue11/crystallography
Web References
- w1 – Zusatzinformationen zu den Nobelpreisträgern für Chemie 1962 und ihre Pionierarbeit findet sich auf der Webseite des Nobelpreisträgerkommitees: http://nobelprize.org/nobel_prizes/chemistry/laureates/1962
- w2 – Das Swiss National Center of Excellence in Research (NCCR) Structural Biology ist ein Konsortium von Wissenschafter/innen, die sich mit der Aufklärung von Struktur-Funktionsbeziehungen von Membranproteinen und supramolekularen Komplexen beschäftigen: www.structuralbiology.uzh.ch
-
Ausgewählte Forschungshighlights findet man unter: www.structuralbiology.uzh.ch/research004.asp
-
- w3 – Neue Strukturen von biologischen Makromolekülen (Proteine und Nukleinsäuren) werden in der Protein Data Bank (PDB) abgelegt. Die Webseite bietet eine Vielzahl interessanter Ressourcen für den Unterricht: www.pdb.org
-
Weitere interessante Ressourcen für Inormationen über Proteine: www.proteopedia.org
-
- w4 – Download und zur Installation von Skype unter www.skype.com
- w5 – Weitere Ressourcen für den Unterricht findet man unter: www.structuralbiology.uzh.ch/teacher
-
Login: crystallization
-
Password: xraybeam2008
-
Die Seite wird regelmäßig aktualisiert.
-
- w6 – Webseiten der Bezugsquellen:
-
Hampton Research: www.Hamptonresearch.com
-
Gilson Inc.: www.gilson.com
-
Sigma-Aldrich: www.sigmaaldrich.com
-
Resources
- Abad-Zapatero C (2002) Crystals and Life: A Personal Journey. La Jolla, CA, USA: International University Line. ISBN: 978-0972077408
- Hier findet man einige empfehlenswerte Arbeitsanleitung zur Kristallisation von proteinfreien Kristallen für jüngere Schüler/innen:
Review
Der Artikel bietet eine gute Einführung im die Untersuchung von Proteinkristallen mit Röntgenstrukturanalyse. Er stellt ein fachübergreifendes Experiment für Biologie, Physik und Chemie vor, das viele Querverbindungen zwischen den drei Fächern aufzeigt. Er eignet sich als Anregung zur Diskussion, wie man sehr kleine Objekte untersuchen kann, und warum es notwendig ist, das zu machen. Der Artikel liefert auch gute Hintergrundinformationen für Lehrkräfte, denen die Analyse von Beugungsbildern als analytisches Verfahren bisher unbekannt war.
Es dürfte nur wenig Zeit erfordern, das Experiment anzusetzen und Ergebnisse zu erzielen, und das Angebot, die Kristalle an der Universität analysieren zu lassen, eröffnet ganz neue Möglichkeiten für die Praxis.
Mark Robertson, Großbritannien





