Brennstoffe im Blickpunkt: Experimente zum Klimawandel Teach article
Übersetzt von: Anne Käfer. Dudley Shallcross, Tim Harrison, Steve Henshaw und Linda Sellou bieten chemische und physikalische Experimente unter Nutzung von alternativen Energiequellen, z.B. nicht-fossilen Brennstoffen, an.

iStockphoto; earth image
courtesy of NASA
Diskussionen über Klimawandel in der Klasse können ein weites Feld umfassen, sie werden aber wahrscheinlich verschiedene Energiequellen und deren Folgen einbeziehen. Relevante Themen beinhalten wahrscheinlich verschiedene Brennstoffe, die benutzt werden können, wie effektiv sie sind und wie sie produziert werden, sowie Alternativen zur Verbrennung. Wir schlagen einige Laboraktivitäten vor, um den Physik- und Chemieunterricht zum Klimawandel zu unterstützen.
1) Messung der Brennstoffeffizienz
Unverbrannter Treibstoff, der in die Atmosphäre verdampft, entweder während der Lagerung oder der Verbrennung, ist ein Luftverschmutzer und spielt auch eine Rolle bei der Bestimmung der Lebensdauer von Treibhausgasen. Ein Weg den Schaden zu begrenzen, besteht darin, Alkohole an Stelle von üblichen Kohlenwasserstoffen wie z.B. Benzin oder Diesel zu benutzen.
Kohlenwasserstoffe in der Atmosphäre werden durch Hydroxylradikale (●OH) oxidiert und bilden vorwiegend Alkohole und Carbonyle. Der Gehalt an atmosphärischem ●OH ist wichtig, da diese Radikale Treibhausgase, die C-H-Bindungen wie in CH4. enthalten, abbauen. Computersimulationen haben gezeigt, dass das Freisetzen von Alkoholen weniger Schaden verursacht als das Freisetzen von Kohlenwasserstoffen, weil weniger Oxidationsschritte unter Entfernen von geringeren Anteilen an ●OH stattfinden. Deshalb hat die Verwendung von Alkoholen anstelle von Kohlenwasserstoffen als Brennstoff einen positiven Effekt sowohl auf die Luftqualität als auch auf die Beseitigung von Treibhausgasen. Darüber hinaus können die kleineren Alkohole, die in die Atmosphäre freigesetzt werden, in geringem Maße durch physikalische Prozesse wie z.B. trockene (durch die Oberfläche aufgenommen) und nasse (Regen, Nebel, Aerosole) Ablagerungen entfernt werden, im Gegensatz zu den entsprechenden Kohlenwasserstoffen.
Alkohole werden in Brennstoffzellen (siehe ‘Treibstoffzellen: Energie aus der Elektrolyse’) benutzt, welche ein breites Spektrum von potenziellen Anwendungen aufweisen, z.B. in Kurzstreckenfahrzeugen.
Natürlich ist ein guter Brennstoff nicht nur umweltfreundlich, sondern er muss auch eine effiziente Energiequelle sein. Das folgende Experiment erlaubt es Schülern, die erzeugte Energie durch das Verbrennen verschiedener Alkohole zu bestimmen und ihre Wirksamkeit mit Standardbrennstoffen zu vergleichen.
Alkoholbrenner sind kleine Brenner, die aus Glas gemacht sind, ausgestattet mit einem Zündsystem. Sie sind normalerweise Bestandteile von Chemiebaukästen für Kinder und können direkt von Ausstattern für Schulen bezogen werden können. Sie können benutzt werden, um die freigewordene Energie bei der Verbrennung von kürzeren primären Alkoholen wie z.B. Methanol, Ethanol, Propan-1-ol, Butan-1-ol und Pentan-1-ol zu bestimmen.


Die Schüler können das Experiment (siehe Zeichnungen oben) aufbauen, wobei der Alkoholbrenner mit einem bekannten Alkohol gefüllt ist. Wiege zuerst den Brenner und dessen Inhalt. Miss genau 150 ml Wasser ab und gieße es in ein 250 ml Becherglas. Wir nehmen an, dass 1 ml Wasser 1 Gramm wiegt. Miss die Wassertemperatur zu Beginn des Experiments und befestige den Becher oberhalb des Brenners, wobei ungefähr 5 cm Platz zwischen dem Docht und der Basis des Bechers bleibt. Zünde den Brenner an und platziere ihn zentral unter den Wasserbehälter, bis die Temperatur um 30 bis 40 °C gestiegen ist. Bestimme den Temperaturanstieg durch Aufnahme der Endtemperatur des Wassers. Wiege die Endmasse des Alkoholbrenners und seinen Inhalt. Bei diesem Vorgang können sich die Schüler nicht mehr erinnern, ob sie den Alkoholbrenner mit oder ohne Deckel gewogen haben! Berechne die Masse des verbrannten Alkohols (MB).
Die Energie, die bei der Verbrennung freigesetzt wird und den Anstieg der Wassertemperatur bewirkt, kann nach Gleichung (1) berechnet werden.
ΔHC = -c x Mwater x TR (1)
Wobei bedeuten:
ΔHC = Verbrennungswärme [kJ]
c = die spezifische Wärmekapazität des Wassers = 4.187 kJ kg-1 °C-1
Mwater = Masse des Wassers (kg) [kg]
TR = Temperaturanstieg des Wassers [°C]
Die Verbrennungsenergie kann dann als Energie pro Gramm oder Energie pro Mol des verbrannten Alkohols ausgedrückt werden. Die Ergebnisse, die verschiedene Gruppen mit demselben Alkohol oder unterschiedlichen Alkoholen erhalten haben, werden verglichen.
Verbrennungsenergie pro Gramm = ΔHC / MB (2)
Verbrennungsenergie pro Mol = ΔHC x Mr / MB (3)
Wobei bedeuten:
Mr ist die relative Molekularmasse des verbrannten Alkohols,
MB ist die Masse des verbrannten Alkohols.
Weitere Untersuchungen, die von den Schülern durchgeführt werden können, umfassen:
- Wechsele den Alkohol für den Brenner. Normalerweise ist es besser, Sets von Alkoholbrennern zu haben, die verschiedene Alkohole benutzen, da es sehr schwierig ist, den Alkohol in einem feuchten Zündsystem zu ersetzen.
- Eine Alternative, um verschiedene Alkohole zu vergleichen, ist es einen Alkohol genau mit einem Nachtlicht (einer kleinen Wachskerze in einem Metallhalter) zu vergleichen.
- Wechsele das Material, aus dem der Becher gemacht ist, z.B. zu Kupfer oder einer Lebensmitteldose aus galvanisiertem Stahl.
- Ändere die Dicke des Materials, aus dem der Wasserbehälter gemacht ist.
- Vergleiche einen isolierten Behälter, der aus einem hitzebeständigen Material ist, mit einem Glasbecher.
- Vergleiche den offenen Glasbecher, der erhitzt wird, mit einem geschlossenen Glasbecher, durch dessen Deckel ein Thermometer geführt wird.
- Macht es einen Unterschied, ob das Wasser im Behälter gerührt wird oder nicht?
- Macht die Höhe, in der der Becher über der Flamme angebracht ist, einen Unterschied bezüglich der Hitze, die vom Wasser absorbiert wird?
- Macht es einen Unterschied, Bretter/hitzebeständige Matten um den Brenner zu platzieren, um Luftströmungen zu reduzieren?
- Macht die Länge des Zündsystems einen Unterschied?
Beachte, dass es zu gefährlich ist in diesen Brennern Diesel oder Benzin zu benutzen. Auch ohne herkömmliche Brennstoffe oder verschiedene Alkohole zu testen und die durch “grüne” Brennstoffe freigesetzten Energien zu vergleichen, können die Experimente benutzt werden, um im Allgemeinen über experimentelle Fehler und Messgenauigkeit zu diskutieren. Durch Vergleich von Ergebnissen, die in der Klasse erhalten wurden, mit den Lehrbuchangaben oder jenen, die bei Wikipediaw1 (siehe Tabelle) erhältlich sind, werden die signifikantesten Fehler offensichtlich.
| Name des Alkohols/Brennstoffs | Standardisierte Verbrennungswärme [MJ / kg] |
|---|---|
| Torf (feucht) | 6.0 |
| Torf (trocken) | 15.0 |
| Holz | 15.0 |
| Kohle (Lignit) | 15.0 |
| Methanol | 22.7 |
| Kohle (Anthrazit) | 27.0 |
| Ethanol | 29.7 |
| Kohlenstoff | 32.8 |
| Propan-1-ol | 33.6 |
| Butan-1-ol | 36.2 |
| Pentan-1-ol | 37.7 |
| Diesel | 44.8 |
| Paraffin | 46.0 |
| Kerosene | 46.2 |
| Benzin | 47.3 |
| Butane | 49.5 |
| Propan | 50.4 |
| Ethan | 51.9 |
| Naturgas (Durchschnitt, variiert abhängig vom Herkunftsland) | 54.0 |
| Methan | 55.5 |
| Wasserstoff | 141.8 |
2) Herstellung von Biobrennstoffen aus Pflanzenöl
Biobrennstoffe sind fest, flüssig oder gasförmig. Sie stammen aus erst vor kurzem abgestorbenem, biologischem Material im Gegensatz zu den fossilen Brennstoffen, die aus längst abgestorbenem, biologischem Material stammen.
Während brennende fossile Brennstoffe CO2 freisetzen, das für lange Zeit gebunden war, sollten brennende Biobrennstoffe nur CO2freisetzen, das erst kürzlich von der Atmosphäre während der Photosynthese aufgenommen und zu Öl umgewandelt wurde. In der Theorie sollte der Vorgang kohlenstoffneutral sein. Die Herstellung von Biobrennstoffen erzeugt jedoch zusätzlich CO2; die Emission während eines Lebenszykluses (Menge CO2 die während der Herstellung, Nutzung und Abfallbeseitigung gebildet wird) von einigen Biobrennstoffen der 1. Generation übersteigt sogar die der traditionellen fossilen Brennstoffe.
Bis jetzt wurden drei Generationen von Biobrennstoffen entwickelt: Biobrennstoffe der 1. Generation werden aus Zucker, Stärke, pflanzlichem Öl und Tierfetten gemacht. Zusätzlich zu ungünstigen Emissionswerten haben Biobrennstoffe der 1. Generation andere wichtige Einschränkungen: Es gibt eine Schwelle oberhalb derer ihre Herstellung den Artenreichtum und die Lebensmittelproduktion bedroht. Außerdem sind sie teurer als bestehende fossile Brennstoffe.

Dies führte zur Entwicklung von Biobrennstoffen der 2. Generation, die einen höheren Anteil unserer Brennstoffversorgung auf nachhaltige, erschwingliche und umweltfreundliche Art und Weise liefern können. Sie nutzen eine große Anzahl von Agrargütern, die nicht für den Verzehr angebaut werden, inklusive Abfallbiomasse aus Weizen, Getreide und Holz.
Dennoch nehmen diese Biobrennstoffe Land in Anspruch, das ansonsten genutzt werden könnte, um Lebensmittel anzubauen. Brennstoff aus Algen, auch Ölalgen genannt, wurde als Biobrennstoff der 3. Generation entwickelt, um dieses Problem zu vermeiden. Diese Brennstoffe können mit niedrigem Input mit effizienten Methoden hergestellt werden, wobei die Algen 30mal mehr Energie als Ackerfrüchte und Sojabohnen pro Fläche produzieren.
Theoretisch können Biotreibstoffe von jeder Art biologischer Kohlenstoffquelle produziert werden, aber die gängigsten Quellen sind photosynthetische Pflanzen und Materialien, die von Pflanzen abstammen. Ein Vorteil vieler Biotreibstoffe gegenüber anderen Brennstoffen ist, dass sie biologisch abbaubar sind und so relativ harmlos für die Umwelt, wenn sie auslaufen.
Es gibt eine Reihe von Möglichkeiten, Biotreibstoffe aus einer Vielzahl an Pflanzenölen herzustellen, aber die Reaktion ist im Wesentlichen dieselbe. Ein Biotreibstoff wird durch alkalische Hydrolyse der Triglyceride in Pflanzenölen (siehe Bild oben) und durch nachfolgende, erneute Veresterung des Triglycerids zum Methylester hergestellt. In der Praxis können beide Schritte im gleichen Ansatz stattfinden, vorausgesetzt man nutzt eine Mischung aus Methanol in Alkali, wie es kommerziell durchgeführt wird. Diese Mischung enthält das Methoxid-Ion. Während der Hydrolyse wird eine Fettsäure aus dem Triglycerid freigesetzt. Zusammen mit dem Methoxid-Ion wird der Methylester der Fettsäure gebildet.
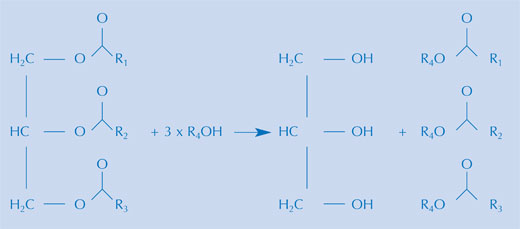
Mit freundlicher Genehmigung von Bristol ChemLabS
Glycerin (Propan-1,2,3-triol) ist ein Abfallprodukt dieser letzten Reaktion. Die Verfügbarkeit oder die Nutzung von Glycerin ist eine der Herausforderungen für diese wachsende Industrie.
Für das unten beschriebene Experiment kann man ein Siederohr oder eine Rückflussmethode unter Verwendung von QuickfitTM Laborglasgeräten einsetzen.
In der einfacheren Herstellung ohne Rückfluss werden 12-13 ml eines pflanzlichen Öls nach Wahl in ein Siederohr mit 2 ml Kaliumhydroxid in Methanol gegeben (5% w/w). Die Flüssigkeiten werden ohne Schütteln gemischt, um das Einschließen von Luft und ein Schäumen zu verhindern. Die Mischung wird in ein Wasserbad von 60°C gestellt. Die Reaktionsgeschwindigkeit kann durch Messung der Viskosität verfolgt werden: Man kann bestimmen, wie lange ein kleiner Ball (leicht erhältlich, symmetrische Form, weich und dicht) braucht, um auf eine bestimmte Tiefe der Mischung im Rohr (alle 5 Minuten in gleichen Intervallen bis zu 2 Stunden) zu fallen.
Das größere Triglycerid wird in kleinere Untereinheiten gespalten (siehe Zeichnung oben), welche dann eine kleinere Masse haben als die Verbindung, aus der sie hergestellt wurden. Da die Viskosität einer Flüssigkeit direkt proportional zu der Molekülmasse ist, wird die Reaktion zu einer weniger viskosen Mischung führen. Darüber hinaus kann man eine Probe für einen ganzen Tag unter diesen Bedingungen belassen, um qualitativ das Ausmaß der Hydrolyse zu beobachten.
Obwohl der Biotreibstoff, der in diesem Experiment hergestellt wurde, noch Glycerin enthält, das als Abfallprodukt der Reaktion gebildet wird, kann die Veränderung der Viskosität dennoch beobachtet werden. Wenn ein Rückflusskühler für die Reaktion benutzt wird, kann der Biotreibstoff vom Glycerin durch Lösungsmittel-Extraktion getrennt werden.
Der Biotreibstoff, der auf eine dieser Methoden hergestellt wird, kann dann z.B. benutzt werden, um eine kleine Dieselmaschine ans Laufen zu bringen.
Beachte Wenn pflanzliche Öle schon fürs Kochen verwendet wurden, bitte denke daran, Essensreste herauszufiltern
3) Treibstoffzellen: Energie aus der Elektrolyse
Die zwei vorherigen Experimente basieren auf der Energieabgabe durch Verbrennen. Dies ist zwar ein Weg zur Oxidation eines Treibstoffes, um Energie abzugeben, aber es ist nicht der einzige. Treibstoffe können auch durch Elektrolyse oxidiert werden, wie das folgende Experiment zeigt.
Brennstoffzellen erzeugen Elektrizität durch Reaktion zwischen einem Brennstoff wie z.B. einem Alkohol oder Wasserstoff an der Anode und einem Oxidationsmittel wie z.B. Sauerstoff oder Chlor an der Kathode. Der Brennstoff und das Oxidationsmittel reagieren in Gegenwart eines Elektrolyten. Die Reaktionspartner fließen in die Zelle und die Reaktionsprodukte verlassen die Zelle, während die Elektrolyte in ihr verbleiben. Eine Brennstoffzelle arbeitet katalytisch; die beiden Komponenten (Elektronen und Protonen) des Brennstoffs werden getrennt und die Elektronen werden gezwungen, einen Kreis zu durchlaufen und dabei elektrischen Strom zu erzeugen.
Eine Brennstoffzelle unterscheidet sich von einer chemischen Batterie, da ihre Reaktionspartner wieder aufgeladen werden können (da sie ein thermodynamisch offenes System darstellen), während die Chemikalien, die in der Batterie verbraucht werden, dies nicht können, da sie versiegelt sind (thermodynamisch geschlossen). Eine Brennstoffzelle kann solange weiterarbeiten, bis ihre Reaktionspartner erneuert werden.
Eine typische Brennstoffzelle produziert bei voller Leistung eine Spannung von 0,6 bis 0,7 Volt. Nichtsdestotrotz können Brennstoffzellen in Serie und Parallelkreisen kombiniert werden, Serienschaltungen ergeben höhere Spannungen, während Parallelschaltungen es erlauben, eine höhere Stromstärke erzeugen. Eine solche Anordnung nennt man einen Brennstoffzellenstapel. Darüber hinaus kann die Oberfläche der Zelle vergrößert werden, um höhere Stromstärken aus jeder Zelle zu erhalten.
Brennstoffzellen sind sehr nützlich als Energiequellen an entlegenen Orten, wie z.B. im Weltraum, an entfernten Wetterstationen, in großen Parks und ländlichen Gegenden. In Zukunft können sie auch den Strom für Kraftfahrzeuge liefern.

in einer Mini-Brennstoffzelle
Mit freundlicher Genehmigung
von Bristol ChemLabS
Es gibt verschiedene Demonstrationen von Brennstoffzellen zu kaufenw2 (jeweils für etwa €20), um den Schülern das Prinzip zu veranschaulichen. Wir nutzen eine Alkohol/Luft-Brennstoffzelle (s. Abbildung links), die aus zwei Teilen besteht: einem Kunststoffbehälter mit einem leitfähigen Plättchen, das mit einem Anschluss (Anode) verbunden ist, und einem Einsatz mit dem Katalysator. Ein definiertes Volumen einer Alkoholquelle (z.B. Frostschutzmittel) oder des Alkohols selbst (Propanol-1) wird mit 55 ml Alkali (z.B. Natriumhydroxid) als Elektrolyt gemischt und in den Kunststoffbehälter gefüllt. Der Einsatz wird in den Becher gestellt, um die Zelle zu vervollständigen. Durch den Einsatz kann Luft in die alkalische Alkohol-Mischung zugeführt werden.
Die chemische Reaktion, die einen Strom erzeugt, ist die Oxidation des Alkohols durch den Sauerstoff der Luft – in Abhängigkeit vom Ausmaß der Oxidation zur Carbonylgruppe oder zur Carbonsäure. Die Reaktion wird das platinisierte Graphit-Plättchen im Kunststoffbehälter katalysiert.
An der Kathode: 4e– + O2 + 2H2O → 4OH–
An der Anode: CH3CH2OH + 2OH– → CH3CHO + 2H2O + 2e–
Der Aldehyd CH3CHO kann weiter zur Carbonsäure oxidiert werden, so dass weiterer elektrischer Strom erzeugt werden kann. Übrigens ist Natriumtetrahydroborat (III) (Natriumborhydrid, NaBH4). ein alternativer Treibstoff für diese Art von Zelle, die eine größere Spannung als Alkohol erzeugt. Nach Herstellerangaben werden nur geringe Mengen NaBH4)benötigt, um die Brennstoffzelle eine Stunde lang zu betreiben. Beachte jedoch, dass NaBH4 giftig und reizauslösend ist.
Die Spannung, die von der Brennstoffzelle erzeugt wird, kann leicht mit einem preiswerten Multimeter bestimmt werden.
Diese Untersuchungen können von den Schülern unter Verwendung der Brennstoffzellen durchgeführt werden:
- Man kann verschiedene Arten von Alkoholen einsetzen, vorausgesetzt, dass sie wasserlöslich sind: Dazu gehören Alkohol-Reihen von Methanol bis Pentanol-1, die sekundären oder tertiären Isomeren dieser Alkohole (soweit es sie gibt) und verschiedene Alkohol-Quellen, z,B. Methylspiritus, Scheibenwischer-Flüssigkeit, Frostschutzmittel oder sogar alkoholische Getränke wie Wodka oder Gin. Welchen Einfluss hat die Art des Alkohols auf die erzeugte Spannung?
- Die Schüler können den Einfluss unterschiedlicher Alkali-Anfangskonzentrationen auf die erzeugte Spannung untersuchen. Man kann auch analysieren, ob der eingesetzte Alkali-Typ (z.B. Natriumhydroxid im Vergleich zu Kaliumhydroxid) einen Unterschied bei der Spannung der Brennstoffzelle macht.
- Die Bestimmung der Konzentrationsänderungen von Alkali oder Alkohol beim Betrieb der Brennstoffzelle kann auch interessant sein.
- Die ganze Anordnung kann in ein gekühltes/erwärmtes Wasserbad gestellt werden, um die Temperatur, bei der die Reaktion stattfindet, zu verändern. Durch Messung des erzeugten Stroms kann der Einfluss der Temperatur auf die Reaktionsgeschwindigkeit ermittelt werden.
Vorschläge für weitere Versuche können in zahlreichen Büchern oder onlinew3 gefunden werden.
Danksagung
Die Autoren danken Will Davey von der Sheffield University für die Grundlagen zu den Versuchen zur Biotreibstoff-Herstellung.
Web References
- w1 – – Tabellen zu Verbrennungswärmen verschiedener Treibstoffe und organischer Verbindungen auf Wikipedia, siehe: http://en.wikipedia.org/wiki/Heat_of_combustion#Heat_of_combustion_tables
- w2 – Einer von vielen Lieferern, die sich auf die Brennstoff-Technologie für die Industrie und den Lehrbereich spezialisiert haben, ist h-tec: www.h-tec.com
- w3 – h-tec hat auch ein Buch zum Einsatz von Brennstoffzellen in der Klasse veröffentlicht:
- Voigt C, Hoeller S, Kueter U (2005) Fuel Cell Technology for Classroom Instruction (Basic Principles, Experiments, Work Sheets). Luebeck, Germany: h-tec
- Eine Sammlung von sicheren, preiswerten Projekten für die Ausbildung und zum Spaß auf dem Gebiet der Brennstoffzellen-Technologie ist:
- Harper G (2008) 101 Fuel Cell Projects for the Evil Genius. New York, USA: McGraw-Hill Professional
- Weitere Versuche zum Einsatz von Brennstoffzellen, siehe: www.ectechnic.co.uk/exps.html
Resources
- Harrison T, Shallcross D, Henshaw S (2006) Detecting CO2 – the hunt for greenhouse-gas emissions. Chemistry Review 15: 27-30
- Pacala S, Socolow R (2004) Stabilisation wedges: solving the climate problem for the next 50 years with current technologies. Science 305: 968-972. doi: 10.1126/science.1100103
- Shallcross D, Harrison T (2008) Den Klimawandel im Klassenzimmer simulieren. Science in School 9: 28-33. www.scienceinschool.org/2008/issue9/climate/german
- Shallcross D, Harrison T (2008) Practical demonstrations to augment climate change lessons. Science in School 10: 46-50. www.scienceinschool.org/2008/issue10/climate
- Vollständige Liste der Artikel zum Klimawandel in Science in School, siehe www.scienceinschool.org/climatechange





