Supporting materials
Download
Download this article as a PDF

Übersetzt von Julia Heymann. Angelika Börsch-Haubold stellt die olfaktorischen Freuden der organischen Chemie vor.

“Chemie knallt und stinkt.” Nicht jeder Schüler fühlt sich von üblen Gerüchen und Explosionen im Labor angezogen. Zum Glück gibt es aber auch einige organische Moleküle, die sogar gut riechen. Wir begegnen diesen Substanzen täglich: wenn wir parfümiertes Duschgel benutzen, unser Essen mit Kräutern würzen oder an einer Rose schnuppern. Selbst wer die giftige, gefährliche Seite der Chemie verabscheut, dürfte durch den Unterricht über die organische Chemie natürlicher Düfte zum Betrachten von Strukturformeln und Funktionsweisen motiviert werden.
Um von unserer Nase wahrgenommen zu werden, müssen Chemikalien lipophil, klein (unter 300 Da Molekulargewicht) und flüchtig sein. Duftende Moleküle entweichen aus ihrem flüssigen oder gar festen Zustand in die Luft. Das sensorische Gewebe namens Geruchsepithel ist eine im Dach der Nasenhöhle gelegene Schleimhaut. Gerüche erreichen sie (in ca. 7 cm Entfernung von den Nasenlöchern) mit der Atemluft. Wenn etwas nur schwach riecht, schnuppern wir erneut, um mehr Luft und somit Duftstoffe zur Sinnesmembran zu bewegen. Dort lösen sich die Moleküle im Schleim und binden dann an Geruchsrezeptoren, die sich auf der Plasmamembran sensorischer Zellen befinden. Diese senden Nervenimpulse zum Gehirn, welches den Geruch mit dessen Ursprung (etwa einer Rose) zu verbinden und wieder zu erkennen lernt, auch wenn dieser versteckt (wie ein Kuchen im Ofen eines Hauses) oder unbekannt ist (etwa beim ersten Betreten eines exotischen Restaurants).
Gerüche in eindeutige Kategorien einzuordnen, ist schwerer als zum Beispiel die Grundgeschmäcker (süß, sauer, salzig und bitter) zu benennen. Typische Attribute eines Geruchs sind blumig (Jasmin), würzig (Ingwer, Pfeffer), fruchtig (Ethylacetat), harzig (Harzrauch), faulig (faule Eier) und verbrannt (Teer). Moschusartig (Muscon), kampferartig, ranzig (Isovaleriansäure, Buttersäure) und stechend (Ameisensäure, Essigsäure) werden ebenfalls oft dazugezählt. Wenn man die chemischen Details und funktionellen Gruppen der Duftstoffe genauer betrachtet, kann man diese bestimmten Aromen zuordnen (Tabelle 1). Zum Beispiel riechen n-aliphatische Alkohole nach Kräutern, Holz oder Orange. Dagegen verströmen n-aliphatische Säuren ranzige, saure oder schweißige Gerüche. Fruchtnoten werden von Estern, bestehend aus kurzen aliphatischen organischen Säuren, erzeugt. Feine Unterschiede in der chemischen Zusammensetzung ergeben verschiedene Duftnoten, wie etwa das Ananasaroma von Ethylbutyrat und den Aprikosenduft von Pentylbutyrat. Gerüche von Gemüse beruhen dabei oft auf organischen Schwefelverbindungen. Eine Ringstruktur mit eingebautem Stickstoff kann nach gerösteter oder vergorener Nahrung riechen, während aromatische Alkohole (Phenole) Bestandteil geräucherter Speisen sind.
Die meisten der Beispiele in Tabelle 1 entstammen verschiedenen Lebensmitteln, um die Gerüche anschaulicher zu machen. Man könnte geeignete Pflanzen und Speisen zufällig über eine große Fläche verteilen und die Schüler bitten, sie dem Geruch nach zu ordnen (mit eventueller Hilfe durch Vorgabe der Attribute „blumig“, „ranzig“, „Obst“, „Gemüse“, „würzig“ und „Rauch“). Sind die Schüler fertig, lassen Sie sie die Ergebnisse mit den chemischen Verbindungen aus Tabelle 1 vergleichen.
Nach Berücksichtigung von Struktureigenschaften ergibt sich die nächste Frage: Wie unterscheiden wir mit Hilfe unseres Geruchssinns zwischen den verschiedenen funktionellen Gruppen, Größen und generellen Formen von Molekülen? Bei vielen physiologischen Prozessen, die an Zellmembranen stattfinden, wird ein Rezeptor durch die Bindung eines Liganden an seine extrazelluläre Domäne aktiviert. Dieses Prinzip wird oft mit einem Schlüssel verglichen, der in ein Schloss passt – nur der richtige Schlüssel öffnet das zugehörige Schloss – denn der Ligand besitzt eine hohe Spezifität für die entsprechende Bindestelle des Rezeptors.
|
Funktionelle Gruppe |
Herkunft |
Beispiel |
Geruch |
|---|---|---|---|
|
Alcohol |
Pflanzen |
Geraniol, Linalool |
frisch, blumig |
|
Aldehyde; Ketone |
Fett |
Diacetyl |
Butter |
|
Säure (C1-C12) |
Käse |
Ameisensäure |
stechend Ziegenmilch |
|
Ester, Lakton |
Lösungsmittel |
Ethylacetat |
Kleber |
|
Pyrazin |
geröstete, gekochte, vergorene Speisen |
2-Isobutyl-3-methoxypyrazin |
Erde, Gewürze, grüner Pfeffer |
|
S-Verbindungen: aliphatisch, aromatisch |
Gemüse |
Diallyldisulfid |
Knoblauch |
|
Phenole (mono-, poly-) |
geräucherte Speisen |
Guaiakol |
Holzrauch |

Einige der faszinierendsten Besonderheiten der Geruchsphysiologie wurden von Linda Buck und Richard Axel, den Nobelpreisträgern des Jahres 2004, entdeckt. Der Geruchssinn wird – im Gegensatz zum Geschmackssinn mit seinem einfachen aber spezifischen Schlüssel-Schloss-Prinzip – von einer ganzen Reihe sensorischer Zellen reguliert. Eine Duftmolekülart interagiert mit mehr als einem Rezeptortyp, so dass der gesamte Sinneseindruck aus einer Kombination von verschiedenen Rezeptoren entsteht. Bei einem Test von aliphatischen n-Alkoholen an einzelnen Mausneuronen stellten Buck und Kollegen fest, dass immer ganze Gruppen von olfaktorischen Neuronen angeregt wurden. Zum Beispiel stimulierte Pentanol einen Rezeptor namens S3 schwach, Hexanol sprach S3 und S25 dagegen stark an; Heptanol aktivierte S3, S19 und S25; Oktanol S18, S19, S41 und S51; und Nonanol S18, S19, S41, S51 und S83. Somit wird ein einzelner Duftstoff von mehreren Geruchsrezeptoren spezifisch erkannt, die ihn gemeinsam verarbeiten.
Ein solches Muster der Rezeptoraktivierung ergibt ein enormes Repertoire an wahrnehmbaren Gerüchen. Wir können uns tatsächlich rund eintausend davon merken und unterscheiden sogar noch eine Größenordnung mehr – je nach Alter, Erfahrung und angeborener Sensitivität. Unsere Vermögen, sie in Worte zu fassen, bleibt jedoch weit hinter der Wahrnehmungsfähigkeit unserer Nase zurück. In der Nahrungsmittelindustrie werden Experten darauf trainiert, feinste Duftnuancen zu erkennen. Es werden verdünnte ätherische Öle oder isolierte Verbindungen, die einem bestimmten Aroma entsprechen, auf einen Streifen geruchlosen Filterpapiers aufgetragen und in ein Glasröhrchen mit Schraubverschluss gegeben (siehe unten).

Sie können Ihren Schülern Oregano (1% Carvacrol in Propylenglykol), Rose (1% ätherisches Öl in Ethanol), Zitrone (10% ätherisches Öl in Ethanol), Zimt (5% Zimtaldehyd in Propylenglykol), Fruchtaroma (5% in Propylenglykol) oder Bittermandeln (1% Benzaldehyd in Propylenglykol) für ein solches Experiment zur Verfügung stellen. Es soll entweder aus einer Liste mit etwa 20 Gerüchen der richtige gewählt, oder der Duft ohne Hilfe gegebener Eigenschaften beschrieben werden (siehe Experiment 1 der Unterrichtseinheiten w1).
Als ungeübte Person kann man oft den Ursprung oder das Vorkommen eines Geruchs nennen, auch wenn man die Originalsubstanz nicht erkennt. In einem meiner Kurse zur sensorischen Beurteilung von Nahrungsmitteln erkannten kürzlich nur die Hälfte der Schüler das Aroma von Oregano. Ein Viertel verwechselte es mit Thymian oder Majoran, nahe verwandten Kräutern; andere hielten den Duft für Rosmarin, Basilikum oder Petersilie, die weniger ähnlich sind und auch anders riechen. Manche jedoch verbanden den Geruch korrekt mit Tomatensuppe, die mit Oregano gewürzt wird. Zwei Drittel der Klasse erkannten Rosenduft, einige assoziierten ihn richtig mit anderen Blumen wie Flieder, Melisse oder mit Parfum, doch andere schlugen fälschlicherweise Minze, Medizin und Gewürze vor.
Fast alle Schüler erkannten Bittermandeln, Minze und Zimt, kamen aber nicht auf Salbei oder Koriander. Als sie die Lösung erfuhren, erkannte plötzlich jeder die Düfte wieder, die ihm vorher nicht einfielen – was beweist, dass das olfaktorische Gedächtnis besser ist als unsere Fähigkeit, einen bestimmten Geruch zu benennen.
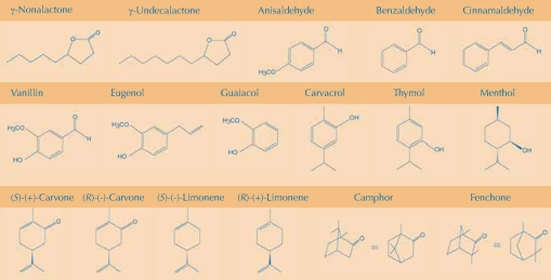
Die Feinabstimmung unseres rezeptorischen Apparates erlaubt es uns, zwischen ähnlichen Molekülen zu unterscheiden. Da viele Düfte von Pflanzen stammen, kann man mit pflanzlichen Produkten demonstrieren, wie minimale Veränderungen der chemischen Struktur entweder einen völlig neuen oder zumindest merklich anderen Geruch erzeugen (siehe Formelabbildung). Die Beispiele sind nach folgenden chemischen Grundlagen geordnet:
Verlängerung einer Kohlenstoffkette: zwei zusätzliche Methylgruppen (CH2‑CH2‑) im Kokosduftstoff, g-Nonalakton, verwandeln ihn in den von Pfirsich; Einbau eines Vinylrests (‑CH=CH‑), in Benzaldehyd (Bittermandeln) ergibt Zimtaldehyd (Zimt).
Austausch einer funktionellen Gruppe: ersetzt man die Aldehydgruppe des Vanillinmoleküls durch eine Allylgruppe (‑CH2‑CH=CH2), erhält man Eugenol, das nach Nelken duftet. Der Alkohol 1-Butanol riecht stechend, die entsprechende Carbonsäure (Buttersäure) dagegen wie ranzige Butter oder Erbrochenes.
Anhängen einer funktionellen Gruppe: hängt man eine Methoxylgruppe an Benzaldehyd, ändert sich sein Geruch von Bittermandeln nach Anis.
Position der funktionellen Gruppe: Carvacrol, bei dem eine –OH-Gruppe neben einem – CH3 steht, duftet nach Oregano. Im Thymol dagegen befindet sich die Hydroxylgruppe neben ‑CH(CH3)2 und es riecht wie Thymian. Der Geruch von 1-Propanol erinnert an Ethanol, der von 2-Propanol ist eher süßlich (die Zahl entspricht der Position der –OH-Gruppe).
Austausch von aliphatischen und aromatischen Ringen: ersetzt man den Benzenring des Thymol durch Cyclohexan, erhält man Methanol, das völlig anders riecht.
Stereochemische Unterschiede: üblicherweise besitzt ein Enantiomer eines chiralen Duftmoleküls einen starken Geruch, das andere dagegen einen schwachen. Ausnahmen sind (S)-(+)-Carvon (der Aromastoff des Kümmel) und (R)-(–)-Carvon (Minze). (S)-(–)-Limonen riecht wie Terpentin (Pinie) aber (R)-(+)-Limonen verströmt Orangenduft.
Es gibt jedoch Verbindungen, die strukturell nicht verwandt sind und trotzdem ähnlich riechen. Cyclooktan, Kampfer und 1,8-Cineol haben alle einen kampferartiges Aroma, obwohl Cyclooktan aus einer Kohlenstoff-Einzelringstruktur besteht, wogegen Kampfer und 1,8-Cineol bizyklische Moleküle sind, mit einer funktionellen Gruppe an einem Sauerstoffatom. Die so genannte „grüne Note“ unreifer Früchte, die Kosmetika für ihren „Frischeduft“ hinzugefügt wird, stammt von einer Gruppe verwandter C6-Aldehydverbindungen (cis-3-Hexenal: frische Tomaten; cis-2-Hexenal: grüner Apfel; trans-2-Hexenal: grüner und schwarzer Tee, frische Tomaten). Genauso besitzen der Alkohol cis-3-Hexenol (frisch gemähtes Gras), das-Aldehyd 2-trans-6-cis-Nonadienal (Gurkenschale), ein Aldehyd an einer Ringstruktur (das nach Gras duftende Ligustral) und sogar einige Pyrazine (2-Propyl-3-Methoxypyrazin: Paprika) diese „grüne Note“.

Mit Hilfe der Duftvielfalt von Pflanzen kann man organische Chemie mit Geruchsphysiologie verbinden und darstellen, wie gut wir unsere Umwelt verstehen, ohne dem wirklich bewusst zu sein. Wenn Sie sich auf den Geruchssinn konzentrieren möchten, könnten Sie Schüler mehrere Verdünnungen eines Duftes nach ihrer Intensität sortieren lassen (siehe Experiment 2 der Unterrichtseinheitenw2). Diese zwei Einheitenw1, w2 sollen dazu anregen, alltägliche Situationen mit Chemie in Beziehung zu setzen und neugierig machen auf die Rolle chemischer Verbindungen in unserer Umwelt.
Ich möchte den Studenten des Sinnestrainings (Fachhochschule Weihenstephan, Wintersemester 2006/07) für die Erstellung von Geruchsproben und anregende Diskussionen danken.
Schüler werden positiv überrascht sein von der Entdeckung, dass Chemikalien nicht nur für potenziell gefährliche und/oder unangenehme Effekte sorgen können, sondern auch für sehr angenehme Düfte und Geschmäcker. Die Arbeitseinheiten, die Angelika Börsch-Haubold präsentiert, dienen dazu vorzuführen, dass das Reich der Gerüche zur Chemie gehört und dass unsere Nase ein außerordentlich empfindlicher chemischer Sensor ist, der feine Variationen in molekularen Strukturen erkennt.
Dieser Artikel eignet sich für die organische Chemie generell, mit besonderer Sachdienlichkeit für die Lebensmitteltechnologie. Er könnte mit einer Diskussion zur Verwendung von (künstlichen) Lebensmittelzusätzen oder genetischer Veränderung von Kulturpflanzen verbunden werden. Des Weiteren dient er als Grundlage für den Unterricht über die Sinne.
Matthew Fletcher, Großbritannien
Download this article as a PDF