La tinta de los monasterios: unión entre química e historia Teach article
Traducido por I. Carrero, Univ. de Valladolid Uno de los principales objetivos de la ciencia es servir de apoyo a las disciplinas humanísticas. Con esta idea en mente, Gianluca Farusi y sus alumnos se propusieron investigar cómo preparar tinta ferrogálica, un material con gran importancia…
Aspectos históricos

Muchas miniaturas medievales de San Juan de Patmos nos muestran la importancia de la tinta pues representan al Diablo tratando de robar al santo este preciado tesoro. En la Edad Media se utilizaban dos tipos de tinta negra: la tinta de carbón (una suspensión de carbón, agua y goma) y la tinta ferrogálica (obtenida de agallas de roble). La tinta de carbón se utilizaba ya en el 2500 a. C. mientras que la ferrogálica se empezó a usar a partir del s. III d. C. y fue la que emplearon personajes como Leonardo da Vinci, Johann Sebastian Bach, Rembrandt van Rijn y Vincent van Gogh. Según recientes investigaciones, se han encontrado trazas de tinta ferrogálica en los manuscritos del Mar Muerto y en el Evangelio perdido de Judasw1.
La reacción que da lugar al pigmento de la tinta no era utilizada inicialmente en el mundo antiguo para producir tinta, pero sí se conocía: en su Naturalis Historia (Historia Natural), Plinio el Viejo (23-79 d. C.) describe cómo distinguir el verdete o cardenillo [Cu(CH3COO)2.2Cu(OH)2], usado para tratar el cuero, de la caparrosa verde (FeSO4.7H2O), más barata, con la que a menudo se adulteraba. Así escribió:
“…El fraude se puede detectar usando una hoja de papiro que haya estado a remojo en una infusión de nuez de agallas: se volverá inmediatamente negra cuando se añada verdete adulterado…”
Pero aunque él veía la transformación, no la entendía. Ahora sabemos que este antiguo texto hace referencia a la reacción entre el catión ferroso, con hierro(II), y el ácido gálico que es la base de la preparación de la tinta ferrogálica (ver más abajo).
Contexto didáctico
Uno de mis estudiantes de química me preguntó qué clase de tinta empleaban los monjes medievales y esto me llevó a desarrollar un proyecto sobre la tinta que se utilizaba en los monasterios (ver recuadro). Además de ofrecer un enfoque instructivo de la ciencia, el proyecto pone de relieve la relación entre ciencia y humanidades.
Decidimos usar las recetas recogidas por el veneciano Pietro Canepario en su obra De atramentis cuiuscumque generis (De todos los tipos de tinta; 1619). Ahí describe la composición en masa de la tinta en una rima en un dialecto italiano: “Una, due, tre e trenta a far la bona tenta” (“Una, dos, tres y treinta para hacer la tinta buena”). Ahora sabemos que estas proporciones de goma arábiga, sulfato ferroso, agallas y agua no son las mejores para la tinta ferrogálica; sale muy ácida y con el tiempo destruye el papel. Sin embargo, mi propósito no era preparar la mejor tinta posible sino más bien animar a mis estudiantes a investigar en la historia con la excusa de la química y comprender los papeles cultural y educacional de la química.
Lo siguiente fue que los estudiantes investigaran sobre las agallas y consiguieran los tipos más comunes –de roble (tanto las de sus bellotas como las globulares de las ramas, agallas canica) y de ciprés– para que pudiéramos comparar tres tintas diferentes.
Quisimos determinar el mejor tipo de tinta, pero ¿en función de qué criterio? Decidimos no alejarnos mucho de la época de Canepario y tomar como referencia las obras De subtilitate (Sobre la sutileza de las cosas) y De rerum varietate (Sobre la variedad de las cosas) de Gerolamo Cardano (1501-1576). Según Cardano, una buena tinta tiene que fluir bien y ser espesa, negra y brillante. Probamos nuestras tintas escribiendo tanto con pipetas Pasteur como con plumilla y encontramos que la tinta de agallas de bellota era la que mejor se ajustaba a estos criterios. Sin embargo, personalmente, mi favorita era la tinta de agallas de ciprés: aunque es menos oscura que la de bellota, huele maravillosamente a resina.
Por supuesto, acabamos con una discusión sobre química: consideramos las reacciones que tenían lugar en cada etapa de nuestra producción de tinta y también las reacciones posteriores entre la tinta y el papel, la importancia de estas reacciones para los documentos históricos y cómo se podían evitar los daños que producen.
Los estudiantes se entusiasmaron con el proyecto, particularmente por sus aspectos interdisciplinares e históricos. Un estudiante destacó que la química «parece ser clave para misterios tanto antiguos como modernos».
Componentes de la tinta ferrogálica

Imagen cortesía de Gianluca
Farusi

Imagen cortesía de Gianluca
Farusi

Imagen cortesía de Gianluca
Farusi
La primera referencia fiable sobre la tinta ferrogálica está en el libro de Marciano Mineo Félix Capela De Nuptiis Philologiae et Mercurii et de septem Artibus liberalibus libri novem (Las nupcias de Filología y Mercurio y las siete artes liberales en nueve libros, 420 d. C.) donde menciona una mezcla de agallas y goma. Aunque se han conservado otras recetas, todas están de acuerdo con los ingredientes básicos: agallas, sulfato ferroso (caparrosa verde), agua y goma arábiga.
Agallas
Las agallas, o cecidias, son crecimientos anormales e inducidos que se encuentran en las hojas, tallos, flores o raíces de las plantas. El agente que induce su formación, normalmente una mosca o una avispa, deposita sus huevos en el tejido vegetal y las agallas crecen alrededor de las larvas que se alimentarán y desarrollarán dentro de este entorno protector. Se cree que las secreciones de las larvas, incluyendo saliva y excrementos, controlan el crecimiento de las agallas.
La composición química de las agallas varía en función del agente inductor y de la planta en cuestión. Las agallas de Alepo son particularmente ricas en los ácidos tánico (65%) y gálico (2%); las de Basora (también conocidas como manzanas de Sodoma) contienen un 26% de ácido tánico y un 1,6% de ácido gálico; por su parte, las agallas de bellota, contienen 45-50% de ácido tánico. Estos tres tipos de agallas también contienen altas concentraciones de ácido galotánico. En el proyecto, nosotros usamos agallas de roble (de bellota y canica) así como agallas de ciprés (Figuras 1, 2 y 3).
Las tres clases de agallas se pueden encontrar por toda Europa pero para hacer tinta también se puede emplear cualquier otro producto con taninos; té, por ejemplo. Otra opción es utilizar directamente el ácido tánico.
Sulfato ferroso o caparrosa verde
Antiguamente, la caparrosa verde (FeSO4.7H2O) se extraía evaporando el agua de tierras ferrosas. Más tarde, a finales del s. XVI, se producía añadiendo ácido sulfúrico a clavos de hierro. Nosotros utilizamos el sulfato ferroso, un producto habitual en los laboratorios de química.
Agua
Como el agua corriente puede contener impurezas (como el cloro) que alteren la calidad de la tinta, utilizamos agua destilada. Históricamente se debió de utilizar agua de lluvia.
Goma arábiga
La goma arábiga, una goma natural extraída de las acacias y utilizada como estabilizante alimentario, mantiene la calidad de la tinta por tres razones:
Mantiene los complejos de hierro (el pigmento) en suspensión.
Hace más espesa la tinta evitando que fluya demasiado rápido de la pluma.
Reduce la velocidad con la que la tinta es absorbida por el papel y así se obtienen trazos más claros y duraderos.
Materiales y métodos
- Agallas, 3 partes en masa
- Agua, 30 partes en masa
- Sulfato ferroso, 2 partes en masa
- Goma arábiga, 1 parte en masa

Imagen cortesía de Gianluca Farusi

agallas trituradas
Imagen cortesía de Gianluca Farusi

Imagen cortesía de Gianluca Farusi

Imagen cortesía de Gianluca Farusi
- Desmenuzar las agallas y molerlas en un molinillo de café (Figura 4).
- Poner las agallas molidas en un vaso de precipitados y añadir el agua. Dejar que la mezcla fermente durante 3 días en un lugar soleado y a temperatura ambiente.
- Filtrar la mezcla (Figura 5) y añadir el sulfato ferroso a la solución. Remover bien y dejar en reposo durante 3 días.
- Añadir la goma arábiga, mezclar y ya estará la tinta (Figura 6). ¡Es hora de ponerse a escribir! (Figura 7).
Aclaraciones químicas
Aunque las reacciones son fáciles de llevar a cabo, los aspectos químicos son relativamente complejos. El experimento funciona mejor si los estudiantes más jóvenes (14-15 años) hacen el trabajo de laboratorio y los de más edad (17-18 años) les explican los procesos químicos y biológicos que tienen lugar.
Una vez trituradas las agallas, las reacciones se producen en dos fases: la fermentación del ácido galotánico a ácido gálico y, después, la formación del pigmento de la tinta.
Las agallas contienen gran cantidad de ácido galotánico (Figura 8) pero relativamente poco ácido gálico que es el necesario para obtener el pigmento de la tinta. En el proceso fermentativo se libera tanasa, enzima producida por los hongos Aspergillus niger y Penicillium glaucum que se encuentran en las agallas. Durante los tres días que se deja, la tanasa cataliza la hidrólisis del ácido galotánico a ácido gálico y glucosa (Figura 9).
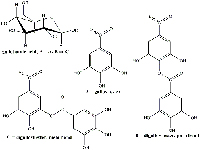
una glucosa cuyos grupos hidroxilo
están esterificados con una mezcla de
los ácidos gálico, digálico y poligálico.
Haga clic sobre la imagen para ampliarla.
Imagen cortesía de Gianluca Farusi
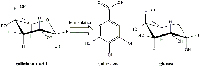
dar ácido gálico y glucosa.Haga clic sobre la
imagen para ampliarla.
Imagen cortesía de Gianluca Farusi
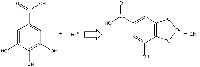
cationes ferrosos reaccionan para
dar galato ferroso. Haga clic sobre
la imagen para ampliarla.
Imagen cortesía de Gianluca Farusi
El pigmento de la tinta se forma en dos pasos sucesivos: una reacción ácido-base de Lewis y una reacción redox.
El ácido gálico y el sulfato ferroso forman el galato ferroso (compuesto hidrosoluble incoloro; Figura 10) además de H3O+ y SO42-.
Casi inmediatamente, el galato ferroso reacciona con el oxígeno para dar agua y pirogalato férrico, un complejo octaédrico negro e insoluble en el que los ligandos de cada catión férrico son dos moléculas de ácido gálico (Figura 11).
El pigmento de la tinta es el pirogalato férrico. Debido a la presencia de los iones H3O+, la solución es ácida.
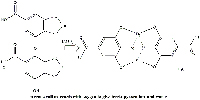
con el oxígeno para dar pirogalato
férrico y agua. Haga clic sobre la
imagen para ampliarla.
Imagen cortesía de Gianluca Farusi
Daños a largo plazo
La tinta ferrogálica se ha estado utilizando durante unos 1800 años pero no soporta bien el paso del tiempo. Con el transcurso de los siglos, la tinta se desvanece y decolora y también daña el papel. Esto se debe al exceso de ión ferroso: la relación 2/3 del sulfato ferroso respecto a las agallas es estequiométricamente incorrecta pues implica más sulfato ferroso del necesario para reaccionar con el ácido gálico.
Algunos de los cationes en exceso se oxidan para dar óxido férrico que, al ser más claro que el pirogalato férrico, difumina el color negro original de la tinta. Otros cationes en exceso dan reacciones en cadena que serán perjudiciales:
Fe2+ + O2 + H+ → Fe3+ + HOO•
Fe3+ + HOO• + H+ → Fe3+ + H2O2
Fe2+ + H2O2 → Fe3+ + HO• + OH– (reacción de Fenton)
RH + HO• → R• + H2O
R• + O2 → ROO•
ROO• + R1H → ROOH + R1•
R1• + …..
donde Fe2+ es el catión ferroso en exceso, O2 es el oxígeno atmosférico y R es una unidad de celulosa.
Además, cuando un radical HO• ataca la celulosa (RH) del papel rompe muchos enlaces y aparecen agujeros. Después, los radicales de celulosa resultantes (R•) reaccionan entre sí dando enlaces cruzados de manera que el papel dañado tendrá una trama más estrecha, menos hidrófila y, en consecuencia, más seca y quebradiza.
Conservación
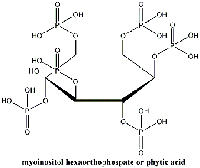
hexakisfosfato). Haga clic sobre la
imagen para ampliarla.
Imagen cortesía de Gianluca Farusi
Se ha pensado que una solución para evitar estos daños podría ser quelar el catión ferroso: rodear estos cationes con ligandos adecuados reduce sensiblemente su oxidación a catión férrico y esto previene daños posteriores. Sin embargo, encontrar un agente quelante adecuado fue un reto: por ejemplo, el EDTA no reduce la tasa de oxidación del Fe2+.
No obstante, hay investigaciones recientes muy esperanzadoras del “Netherlands Institute for Cultural Heritage”w2 (Instituto de los Países Bajos para el Patrimonio Cultural). Un tratamiento basado en el ácido fítico (mio-inositol hexakisfosfato; Figura 12), un antioxidante natural de las semillas, permite la formación de un complejo Fe2+-ácido fítico (Botti et al., 2005). Este complejo inhibe la reacción de Fenton, una de las reacciones en cadena descritas anteriormente, e impide el daño posterior del papel.
Conclusión
«Llegará un día en el que tanto el tiempo dedicado como el estudio concienzudo llevado a cabo por sucesivas generaciones revelará lo que ahora se desconoce; una vida no es suficiente para culminar investigaciones tan ingentes… así, estos fenómenos solo llegarán a estar claros tras generaciones de estudiosos… Llegará un día en el que nuestros descendientes se sorprenderán de que fuéramos tan ignorantes sobre cuestiones para ellos obvias. Muchos descubrimientos esperan a siglos venideros cuando incluso nuestro recuerdo se haya extinguido. El mundo sería absurdo si cada generación no encontrara aspectos sobre los que plantearse interrogantes… La naturaleza no revela sus secretos fácilmente».
Seneca, Quaestiones Naturales, Libro VII
Este interesante pasaje de Séneca (4 a. C.-65 d. C.) todavía está de actualidad. Me gusta pensar que Plinio estaría contento de ver cómo esta generación es capaz de descifrar lo que él no pudo comprender.
References
-
Botti L, Mantovani O, Ruggiero D (2005) Calciumphytat zur Behandlung von Tintenfraß: Wirkungen auf das Papier (Calcium phytate, a natural antioxidant to counter paper corrosion caused by iron-gall ink). Restaurator 26: 35-45
Web References
- w1 – Página web de National Geographic
- w2 – Página web de Netherlands Institute for Cultural Heritage (Instituto Holandés del Patrimonio Cultural)
Resources
-
Página web de Ink Corrosion (La corrosion por tinta)
Review
El artículo presenta un novedoso proyecto interdisciplinar que enlaza química e historia (con conexiones posibles con el arte, las ciencias forenses y la biología). La idea de hacer una tinta fiel a la tradición histórica es interesante y depende de una base química relativamente simple.
Este proyecto podría ser el punto de partida de una investigación que incluyera, por ejemplo, una comparación entre las tintas modernas y las tradicionales. La referencia a la prevención de la degradación de la tinta también podría ser la base de otras investigaciones. En suma, es un artículo interesante con varias ideas útiles para profundizar en una química más avanzada.
Mark Robertson, Reino Unido





