Kemilüminesan nedir? Understand article
Işık yayan denizanaları, titreyen ateş böcekleri, eğlenceli fosforlu çubuklar; Emma Welsh kemilüminesanın güzel ve gizemli dünyasını tanıtıyor

Resim Erik Solheim’ın izniyle; görüntü kaynağı: Wikimedia Commons
Ateşböcekleri, denizanaları ve fosforlu çubuklar – biri uçar, biri okyanusun derinliklerinde yaşar ve diğeri gece kulüplerinde eğlence sağlar. Bağlantı nedir? Cevap, ışık üreten bazı ilginç kimyasal reaksiyonlardır.
Kemilüminesan, kimyasal bir reaksiyondan ışık üretimidir. İki kimyasal, tepkimeye girerek uyarılmış (yüksek enerjili) bir ara madde oluşturur; bu ara madde, temel durumuna ulaşmak için enerjisinin bir kısmını ışık fotonları olarak salarak (tüm terimler için koyu harflerle yazılmış sözlüğe bakınız) parçalanır (aşağıdaki Şekil 1’e bakın).
A + B -> AB* -> Ürünler + Işık
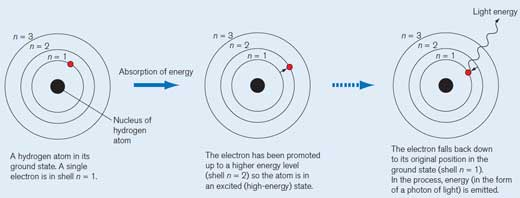
Hidrojen atomu bir kuantum (belirli miktarda) enerji emdiğinde, daha yüksek bir enerji düzeyine (kabuk n = 2) yükseltilir ve şimdi uyarılmış (yüksek enerjili) bir durumdadır. Bunu belirtmek için molekülün yanına yıldız işareti (*) koyuyoruz.
Elektron, eşik durumdaki orijinal konumuna geri düşer (kabuk n = 1). Bu süreçte, elektromanyetik radyasyon şeklinde bir enerji paketi (bir foton) serbest bırakılır. Dalga boyu enerji miktarına bağlıdır. Dalga boyu görünür ışık aralığındaysa, elektron geçişi belirli bir rengin ışığı olarak algılanacaktır. Dalga boyu rengi belirler (aşağıdaki Şekil 2‘ye bakınız)
Chemistry Review izniyle
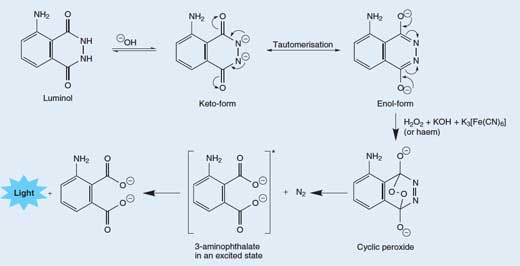
Kemilüminesan reaksiyonlar genellikle çok fazla ısı salmaz, çünkü bunun yerine enerji ışık olarak salınır. Luminol, oksitleyici bir madde ile reaksiyona girdiğinde bir ışık üretir; bu reaksiyonun kimyası Kutu 1’de gösterilmiştir.
Kutu 1: Karanlıkta parlayan bir kimyasal olan luminol
Bir luminol molekülünden bir ışık fotonunun salınması oldukça karmaşık, çok aşamalı bir süreçtir. Bazik (alkali) bir çözeltide, luminol, -2 yük taşıyan anyonu ile dengede bulunur. Anyon, oksijenler (enol-form) veya azotlar (ketol-form; bakınız aşağıdaki Şekil 3) üzerinde delokalize (yerinden edilme) olan iki negatif yük ile iki formda (veya tautomerlerde) bulunabilir.
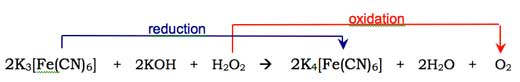
Moleküler oksijen (O2) luminol anyonunun enol formuyla birleşerek onu siklik (halkasal) bir perokside oksitler. Gerekli oksijen, hidrojen peroksit (H2O2), potasyum hidroksit ve (örneğin) potasyum hekzasiyanoferrat(III) (K3[Fe(CN)6] potasyum ferrisiyanür olarak bilinir) içeren bir redoks reaksiyonunda (yani hem indirgeme hem de oksidasyonun meydana geldiği) üretilir. Hekzasiyanoferrat(III) iyonu ([Fe(CN)6]3-) hekzasiyanoferrat(II) iyonuna indirgenir ([Fe(CN)6]4-, potasyum ferrosiyanür, K4[Fe(CN)6] verir), hidrojen peroksitten gelen iki oksijen atomu -1 ila 0 oksidasyon durumundan oksitlenirken:
Daha sonra siklik peroksit, bir azot molekülü (N2) ile birlikte uyarılmış bir halde 3-aminoftalat (3-amino-1,2-benzendikarboksilik asit) vermek üzere ayrışır (bkz. aşağıdaki Şekil 5). Bu ayrışma reaksiyonu tercih edilir çünkü siklik peroksit molekülü oldukça kararsızdır ve reaksiyon bazı zayıf bağların kırılmasını içerir. Bir gaz molekülünün serbest kalmasına bağlı olarak entropideki (düzensizlik) artış nedeniyle de tercih edilir. Uyarılmış 3-aminoftalat temel (eşik) durumuna düştüğünde, bir mavi ışık fotonu serbest bırakılır.
Tautomerler, aynı moleküler formüle sahip, ancak farklı atom veya bağ düzenlemelerine sahip moleküllerdir. İki tautomer birbirine dönüştürülebilir; kıvrık oklar, iki form arasındaki değişimi sağlayan elektronların hareketini gösterir. Resmi büyütmek için tıklayın
Chemistry Review izniyle
Adli tıpta kemilüminesanin
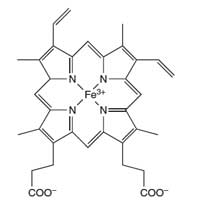
Porfirin halkasının merkezindeki demir atomu (Fe), luminolün reaksiyonunu katalize eder.
Chemistry Review izniyle
Adli tıpta çalışan bilim adamları, suç mahallerinde kanı tespit etmek için luminol reaksiyonunu kullanırlar. Seyreltik bir hidrojen peroksit çözeltisi içindeki bir luminol karışımı, adli bilim adamları tarafından kan olduğundan şüphelenilen alana püskürtülür. Kandaki hemoglobinin “hem” biriminde bulunan demir (bkz. Şekil 4) katalizör görevi görür (Kutu 1’de açıklanan reaksiyon). Oda karanlık olmalı ve kan varsa, yaklaşık 30 saniye süren mavi bir fosfor gözlemlenecektir. Adli müfettişler, olay yerinde kan varlığı için mahkemede kanıt olarak kullanılabilecek fotoğraf filmini kullanarak bu fosforlu parıltıyı kaydedebilirler. (Adli bilimlerle ilgili bir öğretim etkinliği için bkz. Wallace-Müller, 2011.
Demir bir katalizör görevi gördüğünden, yalnızca eser miktarlarda gereklidir, bu nedenle pozitif bir sonuç elde etmek için çok az miktarda kan gerekir. Bu, çıplak gözle görülmese bile kanın tespit edilebileceği anlamına gelir.

How Stuff Works’ün izniyle
Luminol kullanmanın dezavantajlarından biri, reaksiyonun olay yerinde bulunabilecek diğer kimyasallar, örneğin bakır içeren alaşımlar, ağartıcı gibi bazı temizleme sıvıları ve hatta yaban turpu tarafından katalize edilebilmesidir. Zeki suçlular kanı çamaşır suyuyla temizleyebilir, bu da kanın delillerini yok eder, ancak halıyı ağartmak insanları suça karşı daha erken uyarabilir. İdrar ayrıca luminolün reaksiyonunu katalize etmek için yeterli olabilen az miktarda kan içerir. Bölgeye bir kez luminol uygulandıktan sonra, orada başka testlerin yapılması mümkün olmayabilir. Ancak, bu dezavantajlara rağmen, luminol, adli bilim adamları tarafından suçu çözmek için bir araç olarak hala kullanılmaktadır.
Gece kulübünde
Chemistry Review izniyle
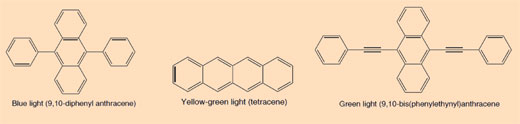
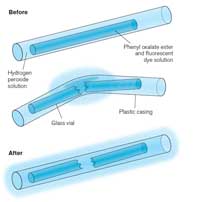
Bir fosforlu çubuğu salladığınızda parlamaya başlar. Üretilen ışık bir kemilüminesans örneğidir (bkz. Şekil 5). Fosforlu çubuk, difenil oksalat ve bir boya (parlama çubuğuna rengini veren) içeren bir karışım içeren bir plastik tüptür. Plastik tüpün içinde hidrojen peroksit içeren daha küçük bir cam tüp bulunur. Dış plastik tüp sallanarak büküldüğünde, iç cam tüp koparak hidrojen peroksiti serbest bırakır ve ışık üreten kimyasal bir reaksiyon başlatır (bkz. Kutu 2). Parlayan bir çubuğun ürettiği ışığın rengi, kullanılan boyaya göre belirlenir (bkz. Kutu 3).
Fosforlu çubuktaki gibi kemilüminesan reaksiyonları sıcaklığa bağlıdır. Sıcaklık yükseldikçe reaksiyon hızlanır (fosforlu çubuğu sıcak suya sokmak harika bir fosfor üretir, ancak oda sıcaklığında olduğu kadar uzun sürmez). Tersine, reaksiyon hızı düşük sıcaklıkta yavaşlar; Bu, fosforlu çubuğun birkaç saat dondurucuda tutulup çıkarılıp ısıtıldığında yeniden parlak bir şekilde parlamasına izin verebilir. Reaksiyon dondurucuda tamamen durmaz, ancak yavaşladığından parlama da zar zor algılanır.
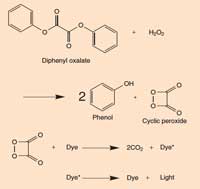
Kutu 2: Fosforlu çubuğun kimyası
Chemistry Review izniyle
Difenil oksalat, hidrojen peroksit (H2O2) ile reaksiyona girdiğinde, fenol ve bir siklik peroksit vermek üzere oksitlenir. Peroksit, iki molekül karbon dioksit (CO2) vermek üzere bir boya molekülü ile reaksiyona girer ve bu süreçte boya molekülündeki bir elektron uyarılmış bir duruma yükseltilir. Uyarılmış (yüksek enerjili) boya molekülü temel (eşik) durumuna döndüğünde, bir ışık fotonu serbest bırakılır. Reaksiyon pH’a bağlıdır. Çözelti hafif alkali olduğunda reaksiyon daha parlak bir ışık üretir.
Güvenlik notu
fenol zehirlidir, bu nedenle fosforlu (ışıldayan) çubuğunuz sızdırırsa sıvıyı elinize bulaştırmamaya dikkat edin; yaparsanız, hemen sabunlu suyla yıkayın. Ayrıca Science in School genel güvenlik notuna bakın.
Canlı fosforlu çubuklar

Resim Terry Priest’in izniyle; görüntü kaynağı: Flickr
Hiç gece sahilde yürüdüğünüzde ayaklarınızın etrafında ışık kıvılcımları gördünüz mü? Ya da gece kırsalda bulunduğunuzda ateşböceklerinin uçuştuğunu gördünüz mü? Bunlar biyolüminesans örnekleridir ve derin deniz yaşamının yaklaşık %90’ı da bu garip fenomeni sergiler. Bu organizmalar, birçok yararlı işlevi olduğu için ışık üretmek üzere evrimleşmişlerdir. Parlama, avı yakalamak, kamufle olmak veya potansiyel eşleri cezbetmek için bir yem olarak kullanılabilir.
Hatta bazı bakteriler iletişim kurmak için biyolüminesan kullanır. “Parlayan solucan” terimi, ateş böcekleri de dahil olmak üzere çeşitli böcek türlerinin larvalarını tanımlar; bazıları avcıları korkutmak için parlarken, diğer türler fosforlarını avlarını çekmek için kullanır. Mürekkep balığı ve kabuklu türlerinin, kaçarken yırtıcıları şaşırtmak için biyo-ışıldayan sıvı bulutları salabilen türleri vardır. Okyanusun derinliklerinde yaşayan canlılar, deniz suyu yoluyla iyi bir şekilde iletildiği için esas olarak mavi veya yeşil ışık üretecek şekilde evrimleşmişlerdir. Bunun nedeni mavi ışığın kırmızı ışıktan daha kısa bir dalga boyuna sahip olmasıdır, bu da sudaki parçacıklar tarafından daha gevşek emildiği anlamına gelir.
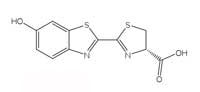
Chemistry Review izniyle (yapı)
Biyolüminesan reaksiyonlar, bir enerji kaynağı olarak ATP‘yi (adenosin trifosfat) kullanır. Işık üreten moleküllerin yapısı türden türe değişir, ancak hepsine lüsiferin genel adı verilir. Ateş böceği lüsiferinin yapısı, soldaki Şekil 6‘da gösterilmektedir. Ateşböcekleri parladığında, lüsiferin, tıpkı Kutu 1‘de açıklanan luminolün kemilüminesan reaksiyonu gibi, bir ışık fotonu bırakarak, temel (eşik) duruma geri düşen, uyarılmış bir kompleks üretmek üzere oksitlenir. Ancak, ateş böcekleri hidrojen peroksit kullanmazlar ve lüsiferini oksitlemek için potasyum hekzasiyanoferrat(III) yerine moleküler oksijen ve lüsiferaz adı verilen bir enzim kullanırlar (bu aynı zamanda genel bir isimdir – lüsiferazlar türden türe değişir).

Tipoform / İsveç Kraliyet Bilimler Akademisi’nin (RSAS) izniyle
Lusiferaz
Lusiferin + O2 → Oksilusiferin + Işık
Bazı denizanalarında bulunan ve kalsiyum varlığında mavi ışık üreten bir protein olan aequorin’i araştıran çok sayıda deney yapılmıştır (bkz. Shaw, 2002 ve Furtado, 2009) ve bu nedenle bu protein moleküler biyolojide hücrelerde kalsiyum seviyelerini ölçmek için kullanılabilir. Bazı bilim adamları, örneğin kendi kendi kendine parlayan Noel ağaçları gibi gelecekte biyolüminesandan yararlanmak için başka fikirler buldular. Bu şaşırtıcı doğal fenomen için başka heyecan verici potansiyel kullanımlar düşünebiliyor musunuz?
Sözlük
Anyon: Negatif yük taşıyan bir atom (veya atom grubu).
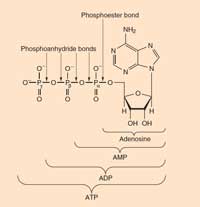
Chemistry Review izniyle
ATP:Adenozin trifosfat bilinen tüm yaşam formlarında bulunur. Hücrelerdeki birincil enerji birimidir. ATP, enerji oluşum reaksiyonları (glukozun oksidasyonu gibi) sırasında ADP (adenosin difosfat) ve fosfattan oluşur ve uygun olmayan reaksiyonları yönlendirmek için bu enerjiyi serbest bırakmak üzere parçalanır (ADP ve fosfata).
Biyolüminesan: Canlı organizmalar tarafından ışık üretimi. Biyolüminesans, ışığın absorpsiyonundan (floresanveya fosforesan, örneğin birçok derin deniz balığında) veya kimyasal bir reaksiyondan (örneğin ateşböceklerindekemilüminesan) kaynaklanabilir.
Katalizör:Bir reaksiyonun daha hızlı gerçekleşmesini sağlayan, ancak reaksiyon sırasında kalıcı bir kimyasal değişime uğramayan (yani reaksiyonda tüketilmeyen) bir madde. Katalizörler, daha düşük enerjili reaksiyon için alternatif bir yol sağlayarak çalışırlar.
Kemilüminesan:Elektronların kimyasal bir reaksiyonla uyarıldığı bir tür lüminesan, örneğin Kutu 1’de açıklanan luminolün reaksiyonu.
Konjuge: Konjuge sistemler, çoğunlukla kimyada yan yana çift bağlar olduğunda ortaya çıkar. Konjuge bir sistemdeki atomlar, kovalent bağlarla bir arada tutulur ve değişen tekli ve çoklu bağlara sahiptir (esas olarak çift bağlar, ancak üçlü bağlar da konjugasyon yapabilir). Alkenler düzdür; konjuge sistemler, sistem boyunca elektronların delokalizasyonuna izin vermek için her zaman düzlemsel olmalıdır. Kutu 3‘teki boya moleküllerinin tümü konjuge bileşiklerin örnekleridir.
Kovalent bağlar:Bir çift elektronun aralarında paylaşıldığı iki atom arasındaki bağlar.

Chemistry Review izniyle
Delokalize:Eğer moleküller konjuge bağlara sahipse, elektronlar tüm konjuge sistem boyunca hareket etmekte serbesttir. Bunlara delokalize elektronlar denir. Bir benzen halkasındaki elektronlar delokalizedir ve bu nedenle tüm karbon-karbon bağları aynı uzunluktadır.
Floresan: Elektronların ışıkla uyarıldığı bir tür lüminesan, örn. banknotların üzerindeki güvenlik işaretleri.
Lüminesan:Genellikle düşük sıcaklıklarda, örneğin kimyasal reaksiyonlar veya elektrik enerjisi ile ışık üretimi. Akkor, aksine, yüksek sıcaklıklar tarafından üretilen ışıktır
Fosforesan: Floresan olup, ancak ışıldaması daha uzun sürer (bazı tanımlara göre, 10 nanosaniyenin üzerinde), örneğin karanlıkta parlayan çıkartmalar.
Foton:Işık enerjisinin bir kuantumu (paket).
Teşekkür
Bu makalenin orijinal versiyonu Chemistry Review‘da yayınlanmıştır ve yayıncı Philip Allan’ın izniyle çoğaltılmıştır. 16-19 yaş arası okul kimya öğrencilerine yönelik bir dergi olan Chemistry Review‘a abone olmak için şu adresi ziyaret edin: www.philipallan.co.uk/chemistryreview
References
- Furtado S (2009) Painting life green: GFP. Science in School 12: 19-23.
- Shaw A (2002) Genetic chess by the light of a jellyfish. Chemistry Review 12(1): 2-5
- Wallace-Müller K (2011) The DNA detective game. Science in School 19: 30-35.
Resources
- Luminol ile ilgili bazı deneyler için, luminolün kemilüminesanı hakkında daha büyük okul öğrencileri için Declan Fleming’in web sitesine bakın: www.chm.bris.ac.uk/webprojects2002/fleming/experimental.htm
- Kimyadaki diğer ışık türleri hakkında bilgi edinmek için bakınız:
- Douglas P, Garley M (2010) Chemistry and light. Science in School 14: 63-68.
Review
Bu makale, öğrencileri kimyasal reaksiyonları anlamaları için motive etmenin bir yolunu sunar. Karanlıkta parlayan bir çubuğun neden parladığını merak etmeseler bile, ateşböceklerinin veya denizanalarının nasıl ışık ürettiğini veya suç mahallinde kanın nasıl tespit edildiğini keşfetmeye kesinlikle hevesli olacaklardır. Makale, kimyasal reaksiyonlara bir giriş olarak veya çekici redoks reaksiyonları örnekleri vermek ve ayrıca bir atomun kabuğundaki enerji seviyelerini göstermek için yardımcı olabilir.
Makale, farklı yaş aralıklarına ve farklı konu ve konulara göre uyarlanabilir. 14-15 yaş arası öğrenciler için kimya (atomik yapı ve elektronların kabuklar arasındaki hareketi, kimyasal reaksiyonlara giriş) veya biyoloji (biyolüminesan) öğretmek için kullanılabilir. Bu yaş grubu için öğretmenin makaledeki bilgileri basitleştirmesi ve tepkimelerin ayrıntılarını atlamaması gerekir. 16-18 yaş arası öğrenciler için makale, kimya (redoks reaksiyonları, katalizörler, sıcaklığın ve pH’ın reaksiyon üzerindeki etkisi ve kovalent bağlar), fizik (elektromanyetik spektrum ve fotonlar) veya genetik (genetik mühendisliği) öğretmek için kullanılabilir. Konunun kavranıp kavranmadığını anlamak şu sorular sorulabilir:
- Kemilüminesan nedir?
- Adli bilimciler kemilüminesanı ne için kullanır?
- Biyolüminesanın bazı biyolojik fonksiyonlarını açıklayınız.
- Fosforlu (ışıldayan) çubuğu kullanmadığınız zamanlarda neden dondurucuda tutmalısınız?
- Kendinden ışıklı bir Noel ağacını nasıl yaparsınız?
Ana Gil, İspanya