Supporting materials
Download
Download this article as a PDF

Traduzido por Artur Melo. Já todos ouvimos dizer que uma dieta rica em antioxidantes é saudável. Em conjunto com os seus alunos, Gianluca Farusi comparou os níveis de antioxidantes em vários alimentos e bebidas.
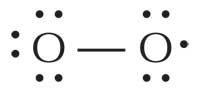
Muitos problemas de saúde, incluindo a aterosclerose, o ataque cardíaco, a doença de Alzheimer, alguns tumores e cataratas na velhice, estão associados a moléculas muito reactivas chamadas radicais livres. Estas moléculas são normalmente produzidas durante a respiração aeróbia e são usadas pelo organismo, por exemplo para o defender contra microrganismos.
Se, no entanto, houver um desequilíbrio entre os radicais (oxidantes) e os antioxidantes, essa situação pode conduzir à doença.
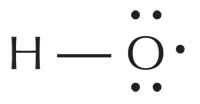
Os radicais livres são bastante reactivos porque possuem um ou mais electrões desemparelhados. São produzidos e localizam-se em muitas células e organitos celulares; o radical aniónico superóxido (O2–), por exemplo, é o radical mais comum no corpo, sendo usado pelos glóbulos brancos para atacar vírus e bactérias. Contudo, o radical mais reactivo é , de longe, o radical hidroxilo (HO·), que se encontra no peroxissoma (onde os ácidos gordos são degradados) e no retículo endoplasmático. Factores externos também influenciam a produção de radicais; por exemplo, a luz ultravioleta (UV) que incide na nossa pele provoca a formação de radicais oxigénio (1ΔO2·).
No interior do corpo, os radicais livres podem conduzir a diversos problemas. Em particular, eles reagem com – e danificam – lípidos, proteínas e ácidos nucleicos, incluindo o ADN (Arking, 2006). Para se auto-proteger do ataque contínuo dos radicais, o nosso organismo apresenta dois processos básicos de protecção: enzimático e não enzimático. As enzimas mais importantes utilizadas na defesa do nosso corpo contra os radicais livres, são as enzimas antioxidantes superóxido dismutase, catalase e glutationa peroxidase. Os principais antioxidantes não enzimáticos são a melatonina, o a-tocoferol (vitamina E), o ácido ascórbico (vitamina C) e o b-caroteno (percursor da vitamina A).
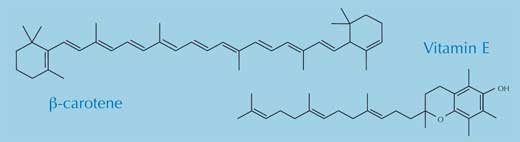
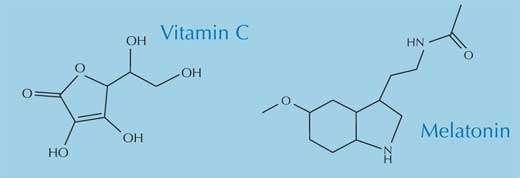
Todos os quatro antioxidantes não enzimáticos são essenciais na alimentação e encontram-se em vários alimentos. O cancro é particularmente menos frequente em pessoas que comem muita fruta e vegetais, e tem sido sugerido que os benefícios para a saúde se devem aos antioxidantes que eles contêm (Polidori et al., 2009; Swirsky Gold et al., 1997), os quais contrariam os efeitos prejudiciais dos radicais livres. Actualmente não há muitas evidências que indiquem que os suplementos antioxidantes (por exemplo, comprimidos) tenham quaisquer benefícios para a saúde.
A experiência seguinte compara os níveis de antioxidantes em vários tipos de alimentos e bebidas, isto é, a eficácia de diferentes tipos de alimentos e bebidas no combate aos radicais.
Para ensinar aos meus alunos de 17 anos o que é uma dieta responsável, na esperança que eles reduzam o risco de desenvolver as doenças mencionadas atrás, elaborei uma actividade baseada na reacção de Briggs-Rauscher: uma reacção oscilante na qual alternam uma etapa de cor âmbar com radicais e uma etapa de cor azul com não radicais.
BAdicionando amostras de diferentes tipos de alimentos e bebidas à reacção e medindo os intervalos de tempo entre as cores, os alunos puderam comparar a eficácia das amostras no combate aos radicais livres. É evidentemente uma avaliação comparativa e não absoluta. Mas uma coisa de cada vez…
Solução de peróxido de hidrogénio 4 M: verta 400 mL de água destilada num balão de 1 L. Usando luvas, adicione 410 mL de peróxido de hidrogénio 30%. Acrescente água destilada para diluir a solução até perfazer 1 L.
Solução de iodato de potássio 0.20 M e ácido sulfúrico 0.077 M: coloque 43 g de iodato de potássio e aproximadamente 800 mL de água destilada num balão de 1 L. Adicione 4,3 mL de ácido sulfúrico concentrado. Aqueça e agite a mistura até o iodato de potássio se dissolver. Dilua a solução até 1 L com água destilada.
Solução de ácido malónico 0.15 M e sulfato de manganésio 0.20M: dissolva 16 g de ácido malónico e 3.4 g de sulfato de manganésio (II) mono-hidratado em aproximadamente 500 mL de água destilada num balão de 1 L. Num copo graduado de 100 mL, aqueça 50 mL de água destilada até ferver. Num copo graduado de 50 mL, misture 0.30 g de amido solúvel com cerca de 5 mL de água destilada e agite a mistura até se formar uma pasta. Verta a pasta na água destilada a ferver e continue a aquecer e a mexer até o amido estar dissolvido. Verta a solução de amido na solução de ácido malónico e sulfato de manganésio (II). Dilua a mistura até 1 L com água destilada.
Amostras de alimentos: para preparar as amostras de alimentos na forma de soluções aquosas ou suspensões, coloque 2.0 g num copo graduado de 400 mL. Junte 100 mL de água destilada e agite com uma vareta de vidro. Decante, verta uma porção num tubo de ensaio e faça a centrifugação. Para bebidas, tais como café ou vinho, use 2. 0 mL, adicione 100 mL de água destilada e agite.
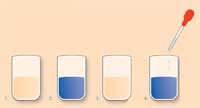
Para um copo graduado de 100 mL, com um agitador magnético no interior, pipete: 10 mL de solução aquosa de peróxido de hidrogénio 4M, 10 mL de solução aquosa de iodato de potássio 0.20 M e ácido sulfúrico 0.077 M, e 10 mL de solução aquosa de ácido malónico 0.15 M e sulfato de manganésio 0.20 M. Ligue o agitador magnético. Quando a solução âmbar ficar azul pela segunda vez, adicione 1 mL de solução ou suspensão do alimento. Um vídeo das alterações de cor está disponível online.w2
A reacção de Briggs-Rauscher é uma reacção oscilante – isto é, a mistura de substâncias passa por uma sequência de alteração de cores que se repete periodicamente. O mecanismo exacto da reacção ainda está a ser investigado, mas a natureza das oscilações é suficientemente clara. Para o objectivo deste artigo, basta saber que enquanto o processo com radicais mantém a concentração do intermediário HIO superior à concentração do intermediário I-, a solução permanece de cor âmbar; quando o processo com não radicais ocorre, [I–] é superior à [HIO] e os iões iodeto combinam-se com I2 para formar um complexo azul com o amido. Uma descrição mais detalhada da reacção pode ser descarregada do website Science in Schoolw1.

Assim que adicionamos a solução ou suspensão do alimento após a segunda fase azul, quando a fase com não radicais está a terminar e a fase com radicais quase a começar, quanto mais longo o intervalo de tempo entre a segunda e a terceira fase azul, maior a capacidade antioxidante do alimento. Por outras palavras, o alimento reagiu com os radicais produzidos e a reacção demora mais tempo a produzir radicais suficientes para permitir que a reacção oscilante continue.
Dedicámos muito tempo a definir a melhor concentração dos alimentos ou bebidas para usar, pois soluções muito diluídas diminuíam a capacidade antioxidante e soluções demasiado concentradas aumentavam tanto o tempo de reacção que não era prático, para realizar um número de tentativas estatisticamente significativo durante o tempo de aula.
Tanto o ácido malónico como o iodo (produzidos durante a reacção) podem irritar a pele, olhos e membranas mucosas; por isso, a reacção deve ser realizada numa hotte.
Como o peróxido de hidrogénio a 30% é um agente oxidante muito forte, devem ser usados óculos, batas e luvas. Deve ser evitado qualquer contacto entre o peróxido de hidrogénio e materiais combustíveis.
O ácido sulfúrico é um forte agente desidratante; devem ser usados óculos, batas e luvas.
Para eliminar, de forma segura, a mistura no final da experiência, adicione lentamente tiosulfato de sódio (Na2S2O3) aos produtos da reacção, até que o excesso de iodo se transforme em iões iodeto incolores (a reacção é bastante exotérmica).
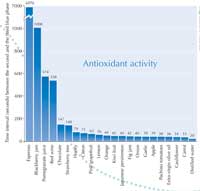
Quando realizei a actividade prática com os meus alunos, encontrámos a maior actividade antioxidante no café expresso: 6970 segundos. Ver o gráfico à direita.
Mais pormenores dos resultados que obtivemos podem ser descarregados no website Science in School w1. O quadro 1 apresenta os alimentos que testámos, a acção antioxidante (intervalo de tempo) e a principal substância que se supõe ser responsável por essa acção.
O que devemos, então, concluir a partir dos resultados? Claramente, uma dieta constituída apenas por café expresso pode conter níveis elevados de antioxidantes, mas estaria longe de ser saudável. Quando realizei esta actividade com os meus alunos, ela originou uma discussão detalhada das reacções com radicais. Em seguida apresentam-se algumas questões que poderiam ser usadas para iniciar uma discussão.
Este é um artigo soberbo que destaca a importância da química no comportamento dos sistemas biológicos. É bastante importante na percepção da forma como o conhecimento científico é multidisciplinar. Professores e alunos poderiam usar o artigo numa actividade prática em aulas de química, bioquímica, nutricionismo ou saúde. Poderia servir de base, também, para projectos inseridos em concursos de ciência.
Não utilizando a parte experimental, a introdução, a discussão e os resultados, poderiam ser uma base sólida para um exercício de compreensão. Questões adequadas, que poderiam ser usadas para despoletar uma discussão sobre alimentação e saúde, ou sobre química no dia-a-dia, poderiam incluir:
Marie Walsh, República da Irlanda
Download this article as a PDF