Neutronii şi antigelul: cercetări privind peştii arctici Understand article
Tradus de Mircea Băduţ. Matthew Blakeley de la ILL şi colegii săi (de la ESRF şi nu numai) au descoperit cum antigelul din sângele peştilor arctici îi ţine în viaţă în condiţii de îngheţ. El şi Eleanor Hayes ne explică.

(Myoxocephalus scorpius) are
proteine antigel
Imagine din domeniul public;
sursa imaginii: Wikimedia
Commons
Când ne gândim la Arctica, mulţi dintre noi ne imaginăm aisberguri, urşi polari şi foci. Temperaturi sub zero grade, vânturi îngheţate şi întinderi dezolante de zăpadă – o provoare pentru orice animal care trăieşte acolo.

au forţat animalele să
dezvolte adaptări remarcabile
Pentru imagine, multumim
ucumari; sursa imaginii: Flickr
Suntem obişnuiţi cu multe din modurile în care animalele arctice s-au adaptat la mediul lor: blana urşilor polari, stratul de grăsime al focilor, obiceiurile de migraţie ale multor păsări. Totuşi, aceste animale sunt toate endoterme – îşi menţin o temperatură constantă a corpului, temperatură mult superioară celei a mediului îngheţat.
Pentru peşti situaţia este foarte diferită – ei sunt în marea lor majoritate exotermi, adică temperatura corpului le este dată de temperatura mediului. Iar mediul este foarte rece: oceanul Arctic are deseori temperaturi sub -1°C, iar faptul că nu îngheaţă se datorează concentraţiei mari de sare din apă.
Sângele peştilor, care este mult mai puţin sărat, ar fi de aşteptat să îngheţe la -0.5 °C. Pentru a evita acest lucru, peştii arctici şi-au dezvoltat nişte proteine antigel specializate (AFP – AntiFreeze Proteins).

Willaert; sursa imaginii: Flickr
AFP-urile au o sarcină complexă. Pentru a preveni moartea peştelui prin îngheţare, ele trebuie să adere la nuclei de cristalizare-îngheţare ce tind să se formeze în sânge, împiedicându-i să crească şi să devină cristale de gheaţă. Totuşi, cum disting ele respectivii nuclei din apa lichidă?
Proteinele antigel au fost studiate intens folosind multe tehnici, inclusiv difracţia de raze X, revelându-se existenţa unei suprafeţe de aderenţă la gheaţă specializate.
Difracţia de raze X se bazează pe gradul în care razele X sunt dispersate la trecerea prin norul electronic al fiecărui atom. Multe molecule au modele distinctive de difracţie. Totuşi, atomii de hidrogen (şi deuteriu, un izotop al hidrogenului), care au un singur electron, dispersează foarte puţin razele X (Figura 1a, mai jos), astfel încât semnalul difracţiei razelor X pentru apă (H2O) este aproape identic cu cel pentru atomii de oxigen (O). Astfel, când cercetătorii au încercat să examineze acea suprafaţă de aderenţă la gheaţă, ei nu au putut să identifice toate moleculele de apă ale suprafeţei.
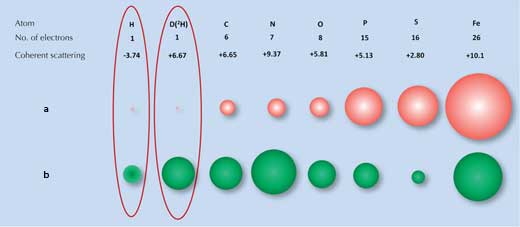
a) Razele X sunt dispersate de electroni, iar amplitudinea difracţiei (mărimea bilelor roşii) este proporţională cu numărul de electroni.
b) Neutronii sunt dispersaţi de către nucleu, deci amplitudinea difracţiei (mărimea bilelor verzi) depinde de forţele nucleare specifice
Pentru imagine, multumim Matthew Blakeley

proteinele antigel ale
mântuşilor de ocean, Zoarces
americanus
Pentru imagine, multumim
Derek Keats; sursa imaginii:
Flickr
Aici a intervenit o a doua tehnică, difracţia neutronică, recomandată deoarece neutronii sunt dispersaţi mai degrabă de nucleul atomului decât de electroni, iar amplitudinea difracţiei depinde de forţele nucleare specifice. Aceste forţe, la rândul lor, depind nu numai de elementele native dar şi de izotopii elementelor, la care diferă numărul de neutroni din nucelul atomic (Figura 1b, mai jos.) Din fericire, atomii de hidrogen pot fi uşor detectatţi prin difracţie neutronică, iar izotopul deuteriu (hidrogen greu, ce are un neutron în plus) poate fi detectat cu uşurinţă. Astfel, semnalul difracţiei pentru apă este semnificativ diferit de cel pentru oxigen.
Noi (Matthew Blakeley şi colegii săi cercetători) am decis să studiem un tip de proteină antigel (AFP) găsit în sângele peştilor arctici: AFP tip-III. Pentru a evita problemele întâlnite de alţi cercetători, am folosit o combinaţie a difracţiilor de raze X şi de neutroni pentru examinarea structurii proteinei şi a interacţiunilor sale cu moleculele de apă. Pentru experimentele noastre am folosit facilităţile de la Institutul Laue-Langevin (ILL)w1 şi de la European Synchrotron Radiation Facility (ESRFw2; vedeţi caseta, mai jos). Studierea neutronică cu volume atât de mici de cristale a fost posibilă datorită tehnologiilor avansate de preparare a mostrelor şi de instrumentaţie dezvoltate în anii recenţi la IIL.
După cum se uzitează la investigarea structurilor de proteine, am inserat gena sintetică de AFP tip-III într-o cultură bacteriană intensă de Escherichia coli, care ne-a permis să colectăm cantităţi suficiente de proteină. Bacteriei i s-a furnizat apă grea (conţinând deuteriu în locul atomilor normali de hidrogen) pentru a se garanta că proteina rezultată este pre-deuterizată: poziţiile tuturor atomilor de hidrogen au fost ocupaţi cu deuteriu. Apoi am cristalizat proteina pentru a-i putea determina structura, verificând ca forma pre-deuterizată să aibă aceeaşi structură ca forma normală. (Vedeţi Cornuéjols, 2009, şi Blattmann & Sticher, 2009, pentru a afla şi experimenta mai multe despre cristalografia proteinei.)
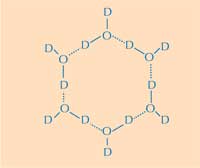
apei. D = deuteriu; O =
oxigen. Clicați pe imagine
pentru a o mări
Pentru imagine, multumim
Nicola Graf
O parte a răspunsului privind modul în care proteinele antigel tip-III disting cristalele de gheaţă ce se formează în apa lichidă constă în felul în care proteinele antigel diferă de o proteină tipică, ce are uzual amino-acizi hidrofobici în nucleu (departe de moleculele de apă din mediu) şi respectiv amino-acizi hidrofilici la suprafaţă. După cum s-a dovedit prin cercetări anterioare, AFP-urile sunt neobişnuite prin faptul că au mulţi amino-acizi hidrofobici la suprafaţă, ceea ce o împiedică să adere la apa lichidă prin legături cu hidrogenul. Aceşti amino-acizi hidrofobici formează o parte din suprafaţa de aderenţă la cristalele de gheaţă, suprafaţă ce astfel aderă la nucleele de îngheţare dar nu şi la apa lichidă. Cum are loc acest lucru?
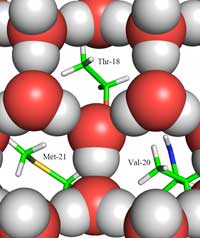
gheaţă (reprezentată prin
buline roşii şi gri) şi partea
de aderenţă la gheaţă,
evidenţiază grupările de
metil ale reziduurilor
hidrofobe Thr-18, Val-20 şi
Met-21, care întâlnesc
golurile din structura de
gehaţă. Clicați pe imagine
pentru a o mări
Copyright © 2011 John Wiley &
Sons, Ltd; sursa imaginii:
Howard et al. (2011)
Aici rezidă a doua parte a răspunsului: diferenţa dintre structurile gheţii şi a apei lichide. Folosind difracţie neutronică, am putut localiza poziţiile moleculelor de apă de pe suprafaţa de aderenţă la gheaţă. Am identificat un ciorchine tetraedral de molecule de apă aderate la acea suprafaţă. Acest ciorchine tetraedral se găseşte în apa lichidă (ca în experimentele noastre), dar el este specific şi gheţii; acest aspect ne-a dat un punct de pornire pentru a modela restul de cristal de gheaţă şi pentru a deduce cum aderă el la AFP. Modelul obţinut este compus din inele de apă sextuple, într-o configuraţie numită barcă: şase molecule de apă într-un aranjament hexagonal, lăsând la mijloc un gol (vedeţi Figura 2, mai jos). Acest gol permite proteinelor antigel tip-III să distingă structura nucleilor de gheaţă de apă: regiunile hidrofobe ale porţiunii de aderenţă la gheaţă se potriveşte în aceste goluri, aderând la gheaţa prin forţele Van der Waals (Figura 3). Spre deosebire de acestea, apa lichidă nu prezintă un gol în care regiunile hidrofobe (precum grupările de metil) să se potrivească. Acest fapt împiedică formarea unei suprafeţe de contact mari între apa lichidă şi porţiunea de aderare la gheaţă, suprafaţă necesară pentru o interacţiune strânsă.

arctici fără proteine antigel?
Pentru imagine, multumim
dwleindecker / iStockphoto
Deşi alţi cercetători au presupus că reziduurile hidrofobe joacă un rol important în modul în care proteinele antigel tip-III recunosc nucleii cristalelor de gheaţă, acesta este primul experiment care confirmă presupunerea.
Deşi per se este interesant să aflăm despre modul în care peştii arctici supravieţuiesc mediului dur, aceste cercetări au şi potenţial de aplicare industrială. Deja proteinele antigel tip-III se amestecă în anumite creme de îngheţată pentru a minimiza formarea de cristale de gheaţă mari şi deci pentru a îmbunătăţi consistenţa. În viitor, genele care codifică AFP-urile pot fi încorporate în recolte agricole pentru a le permite să crească în medii friguroase.
Despre ILL şi ESRF

Institut Laue-Langevin (ILL)w1 este un centru internaţional de cercetare avansată în ştiinţa şi tehnologia neutronilor. El gestionează una dintre cele mai intense surse de neutroni din lume, capabilă să genereze fascicule de neutroni către o suită de 40 de instrumente de înaltă performanţă.
Ca institut furnizor de servicii de cercetare, IIL îşi pune facilităţile şi experienţa tehnico-ştiinţifică în slujba cercetătorilor vizitatori/delegaţi. În fiecare an, aproximativ 1200 de cercetători din peste 30 de ţări vizitează IIL în Grenoble, Franţa. Anual sunt realizate peste 800 de experimente, focalizate în principal pe cercetare fundamentală într-o varietate de domenii: fizica materiei condensate, chimie, biologie, fizică nucleară, ştiinţa materialelor.
European Synchrotron Radiation Facility (ESRF)w2 este un centru internaţional de cerecetare, având aceeaşi locaţie cu ILL, în Grenoble, France. Centrul produce raze X de mare intensitate pentru uzul a mii de cercetători din toată lumea, în fiecare an.
Complementaritatea razelor X de sincrotron cu razele neutronice ne poate ajuta să înţelegem cum lucrează sistemele complexe, precum proteinele antigel descrise în acest articol. Pentru a beneficia complet de sinergia dintre ştiinţele sincrotronului şi neutronică, ESRF şi IIL au fost actori principali în crearea Parteneriatului pentru biologie structurală (PSB – Partnership for Structural Biology) şi a Parteneriatului pentru materie uşor condensată. De asemenea, în viitorul apropiat sunt prevăzute şi alte parteneriate.
ILL şi ESRF sunt membre ale EIROforumw3, instituţia care publică Science in School.
References
- Blattmann B, Sticher P (2009) Growing crystals from protein. Science in School 11: 30-36.
- Cornuéjols D (2009) Cristalele biologice: la interfaţa dintre fizică, chimie şi biologie. Science in School 11.
- Howard EI, Blakeley MP et al. (2011) Neutron structure of type-III antifreeze protein allows the reconstruction of AFP–ice interface. Journal of Molecular Recognition 24: 724-732. doi: 10.1002/jmr.1130
Web References
- w1 – Pentru a afla mai multe despre ILL, accesaţi: www.ill.eu
- w2 – Pentru a afla mai multe despre ESRF şi PSB, vedeţi www.esrf.eu şi www.psb-grenoble.eu
- w3 – Pentru mai multe informaţii despre EIROforum, accesaţi www.eiroforum.org
Institutions
Review
Dacă v-aţi întrebat vreodată cum de supravieţuiesc peştii în oceanele îngheţate, puteţi găsi răspunsul în acest foarte atractiv articol, care îşi conduce cititorul printr-o investigaţie ştiinţifică în structura proteinelor şi a interacţiunilor acestora.
Articolul poate fi folosit ca lectură de fond când se studiază bio-moleculele, sau ca bază pentru o discuţie despre rolul proteinelor în organismele vii. Câteva întrebări şi teme potrivite pentru înţelegerea aspectelor prezentate:
- Descrieţi cum sunt peştii arctici adaptaţi la traiul în apele reci.
- Cum acţionează AFP ca antigel în sângele peştilor?
- Care sunt limitările difracţiei cu raze X când se studiază proteinele antigel?
- Cum diferă difracţia neutronică faţă de difracţia cu raze X?
- Descrieţi paşii implicaţi în examinarea cu succes a structurii proteinelor antigel.
- Cum diferă AFP-urile de alte proteine?
- Cum disting AFP-urile cristalele de gheaţă dintre moleculele de apă lichidă?
Angela Charles, Malta





