Un agujero en el cielo Understand article
Traducido por William Medina-Jerez. Department of Teacher Education. University of Texas-El Paso. El Paso, TX. USA. Hace 25 años, el descubrimiento del agujero en la capa de ozono fue una gran noticia. ¿Cómo se han desarrollado las cosas desde ese entonces?Tim Harrison y Dudley…
El descubrimiento del agujero
Goddard Space Flight Center
cientific Visualization Studio
Fue un hallazgo fortuito, así lo recuerda Jonathan Shanklin, uno de los descubridores: quien al integrarse al equipo de Investigación Británica en la Antárticaw1 en 1977, se le había encomendado la digitalización de la acumulación de información sobre las mediciones de la capa de ozono—hasta ese entonces, escrita a mano en tablas de datos. Como después se supo, esta información incluyó la década crucial, los 70s, cuando los niveles de ozono comenzaron a elevarse.
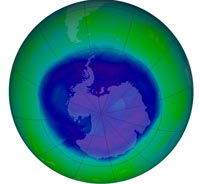
ozono en la Antártica, en su
nivel máximo el 12 de
Septiembre de 2008, midió
más de 27 millones de
kilómetros cuadrados. De
acuerdo con la NASA, este
agujero es moderamente
grande
Imagen cortesía de NASA
Ya se conocía, con preocupación, que los compuestos industrials fluoroclorocarbonados (CFCs)—compuestos orgánicos como el tricloruro de metano (CFCl3) y el diclorurodifluorometano (CF2Cl2), por ese entonces bien conocidos por su uso en refrigerantes, propeledores, (en latas de spray) y en solventes—podrían destruir la capa de ozono. Para el día de apertura en 1983, Shanklin preparó un gráfico—irónicamente para mostrar que la información sobre el ozono para ese año no era diferente de la información de hace 20 años. Aunque esto era cierto para los niveles generales del ozono, él observó que los valores para los niveles en la primavera no parecían más bajos al ir de un año al otro. Estudios subsiguientes corroboraron este hecho, y en 1985 Shaklin y sus colegas Joe Farman y Brian Gardiner publicaron su hallazgo: Cada primavera en el hemisferio sur, el agujero en la capa de ozono sobre la antártica, probablemente fue causado por CFCs, continúa creciendo (Farman et al., 1985).
¿Cuál es la química detrás de esto, y por qué es el agujero en la capa de ozono peligroso?
El Ozono en la estratosfera
El ozono (O3) es una forma triatómica de oxígeno (O2). muy inestable. Es un gas azul pálido presente en concentraciones bajas en la atmósfera—y un arma de doble filo: en la troposfera (ver abajo), el ozono es un gas contaminante el cual puede afectar el sistema respiratorio humano y el de otros animales y causar quemaduras a plantas. La capa de ozono en la estratosfera, sin embargo, es beneficiosa, evita que la mayor parte de la luz ultravioleta peligrosa (UV) emitida por el sol llegue a la superficie de la tierra.
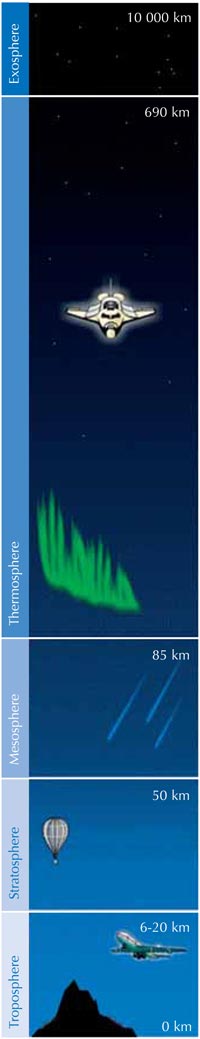
La taza de producción de ozono se maximiza en la estratosfera, la segunda capa más alta de la atmósfera terrestre (ubicada entre los 10-50 km de altitud; ver la imagen), mediante un mecanismo fotoquímico:
O2 + hν → O• + O• λ ~ 200 nm (1)
O• + O2 + M → O3 + M (2)
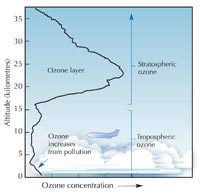
parte baja de la atmósfera. La
mayor parte se encuentra en
la capa estratosférica. Cerca
de la superficie terrestre, los
niveles de ozono ascienden a
causa de la contaminación
provocada por las
actividades humanas. Haga
click para agrandar la
imagen.
Imagen de dominio público;
fuente de la imagen: Wikimedia
Una molécula de oxígeno (O2) absorbe un fotón de luz ultraviolet (hν) con una longitude de onda (λ) aproximada de 200 nm disociándose en dos átomos de oxígeno (O•) (reacción 1). Después cada uno de ellos se combina con otra molécula de oxígeno para producir ozono, si la presión (M) es suficientemente alta (aproximadamente una milísema parte de una atmósfera) para estabilizar la recién formada molécula de ozono (reacción 2). Entre más alta sea la altitud, más alta será la velocidad de la reacción 1 (por debajo de 20 km de altitud no hay fotones a 200 nm, pues han sido absorbidos en la reacción 1). La velocidad de la reacción 2, sin embargo, es más rápida cerca a la sufercie terrestre, donde la presión atmosférica es más alta. Como resultado, la máxima cantidad de ozono se crea entre los 25 y los 30 km de altitud (ver el gráfico).
La estratósfera tiene dos consecuencias importantes para la vida en la tierra. Primero, el ozono absorbe radiación UV de alta energía a los 250 nm (reacción 3):
O3 + hν → O• + O2 λ ~ 250 nm ΔH = – 90 kJ mol-1 (3)
Entre ellos, el oxígeno (reacción 1) y el ozono (reacción 3) filtran de la atmósfera la mayor parte de la radiación de onda corta UV entre los 200 y los 300 nm, los cuales de otra manera serían bastante dañinos para la vida en la tierra.
Segundo, la reacción 3 produce una gran cantidad de calor, por lo cual la estratosfera es más caliente que la capa más exterior de la troposfera (ver imagen a la izquierda), haciendo que el clima en la troposfera sea menos extremo de lo que realmente podría ser.
Las reacciones 2 y 3 rápidamente interconvierten átomos de oxígeno y ozono. Sin embargo, hay otra reacción lenta, la cual destruye átomos de oxígeno y ozono. La reacción entre estas dos species:
O• + O3 → O2 + O2 (4)
Las reacciones 1-4 se resumen en el diagrama siguiente.
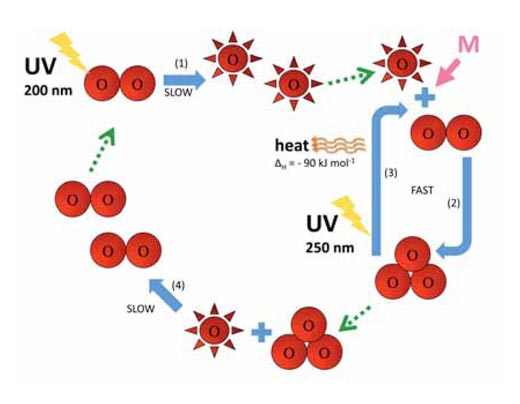
Imagen cortesía de Marlene Rau
Los ciclos naturales catalíticos reducen los niveles de ozono
En 1995, Paul Crutzen, Mario Molina y F. Sherwood Rowland fueron distinguidos con el Premio Nobel en Química por su trabajo en la formación y descomposición del ozono en la estratosfera. ¿De qué se trató todo esto? In los 70s, Crutzen y otros descubrieron la existencia de ciclos naturales catalíticos que aceleran la reacción 4 y reducen la cantidad de ozono en la estratosfera (Crutzen, 1970,1971): agua (H2O), metano (CH4), óxido nitroso (N2O) y clorometano (CH3Cl) son liberados en la atmósfera provenientes de procesos biológicos que ocurren en la superficie terrestre, y conducen a la formación de radicales tales como el hidroxil (OH•), óxido nítrico (NO•) y cloro (Cl•), los cuales catalizan la descomposición del ozono.
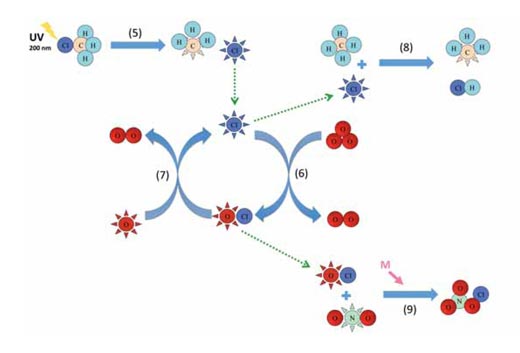
Imagen cortesía de Marlene Rau
La reacción 5 muestra el clorometano liberado por los radicales cloro en la estratósfera mediante fotólosis, y las reacciones 6 y 7 son un ejemplo del ciclo catalítico (ver diagrama abajo). Las reacciones de los otros agentes catalíticos son análogas de las reacciones 6 y 7. El clorometano es liberado en parte por los organismos marinos y terrestres, tales como las algas rojas, hongos blancos descompuestos y plantas superiores, para regular los niveles de los iones cloro en las células y—después de 30-40 años—poder alcanzar la estratósfera exterior (aproximadamente 40 km de altitud) donde se descompone por la luz solar (fotólosis):
CH3Cl + hν → •CH3 + Cl• l ~ 200 nm (5)
The resulting chlorine free radical (Cl•) can then participate in a catalytic cycle:
Cl• + O3 → ClO• + O2 (6)
ClO• + O• → Cl• + O2 (7)
Las reacciones 6 y 7 son en realidad equivalentes de la reacción 4, pero ocurren mucho más rápido—en el caso del ciclo radical cloro/monóxido de cloro (ClO•), cerca de 30 000 veces más rápido. Entonces, ¿por qué estos ciclos catalíticos no destruyen todo el ozono? La respuesta está en la terminación de estos ciclos vía fomación de moléculas estables:
Cl• + CH4 → •CH3 + HCl (8)
ClO• + •NO2 + M → ClONO2 + M (9)
Eventualmente, un radical cloro libre encontrará una molécula de metano y reaccionará para formar ácido hidroclórico (HCl, reacción 8). Similarmente, un radical monóxido de cloro se unirá a un radical de dióxido de nitrógeno, formando un cloro nitrato (ClONO2, reacción 9)—otra reacción dependiente de la presión que en consecuencia funciona mejor en altitudes bajas. Los dos, el ácido clorhídrico y el cloro nitrato son muy estables, y la remoción de cloro y radicales de monóxido de cloro eventualmente detienen el ciclo catalítico.
El rompecabezas del agujero en la capa de ozono en al Antártica
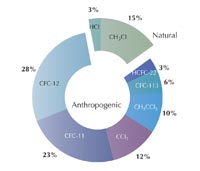
estratosférico de acuerdo con
WMO/UNEP Evaluación
Científica de la Reducción del
Ozono: 1998. Haga clic sobre
la imagen para ampliarla
Imagen cortesía de Andrew
Ryzhkov; image source:
Wikimedia Commons
No hace mucho tiempo que los científicos observaron que los CFCs podrían activar un ciclo catalítico similar al de la degradación del ozono: en 1974, Molina y Rowland no solo advirtieron que los niveles de CFCs se habían incrementado sin ninguna regulación, también predijeron que los CFCs causarían una pérdida adicional significativa de ozono al rededor de los 40 km de altitud (ver Molina & Rowland, 1974). Sin embargo, cuando el agujero en la capa de ozono fue finalmente descubierto en 1985, fue ubicado al rededor de los 20 km de altitud, sobre el Polo Sur en el hemisferio sur en la estación de primavera (ver Farman et al., 1985).
Pronto se supo que los radicales libres de cloro de los CFCs eran los responsables, pero muchas preguntas permanecieron sin respuesta. ¿Por qué el agujero se ubicaba en el Polo Sur? ¿Por qué no en el Polo Norte? ¿Por qué solamente en la estación de primavera? Y, ¿por qué el agujero en la capa de ozono estaba a los 20 km de altitud y no a los 40 km, como se había anticipado? Después de todo, los CFCs no podrían ser descompuestos por la luz solar a una altitud tan baja como a los 20 km, pues la densidad de fotones era insuficiente. Por la misma razón, no hay una suficiente cantidad de átomos de oxígeno producidos a esta altitud para que ocurra la reacción 7. Muchos años de investigación subsiguiente revelarón la historia completa.

Imagen cortesía de Dudley Shallcross, Tim Harrison, Marlene Rau y Nicola Graf
Primero, los radicales libres de cloro liberados de los CFCs, e.g.
CFCl3 + hν → •CFCl2 + Cl• l ~ 200 nm (10)
podrían reaccionar con el metano (reacción 8) formando ácido hidroclórico, o con ozono (reacción 6) formando radicales de monóxido de cloro, y mediante la reacción 9 podría subsecuentemente formar cloro nitrato. Esta secuencia de reacciones incrementaría las concentraciones de ácido hidroclórico y cloro nitrato al rededor de los 40 km de altitud.
dirección al espacio
Imagen de dominio público;
fuente de la imagen: Wikimedia
Commons
Cada invierno en el Hemisferio Sur, el polo sur se torna oscuro durante aproximandamente tres meses. El aire de la estratosfera sobre le Polo Sur se enfría; sin la radiación UV, la reacción 3 no ocurre, y en consecuencia no se libera calor. El aire desciende y la rotación de la tierra hace que se forme un vortex, como cuando el agua escapa a través de un orificio. Este vortex o remolino es tan fuerte que no hay aire del area exterior que pueda entrar, igualmente el aire de su interior no puede escapar. El aire rico en ácido hidroclórico y cloro nitrato a los 40 km de altitud es absorbido y conducido al interior del vortex frio y oscuro.
En el frio extremo del invierno polar, el aire del vortex se enfría tanto (por debajo de los -78°C / 195K) y a una altitud de 15-25 km, que las nubes estratosféricas polares forman agua y/o critales ácidos.
La peculiaridad química que ocurre aquí es que el ácido hidroclórico y el cloro nitrato al ser absorbidos por la nubes estratosféricas polares pasan rápidamente por una reacción heterogénea de gas a la fase sólida, produciendo ácido nítrico (HNO3) que llega a ser incorporado en los cristales de hielo, mientras que el cloro (Cl2) es liberado como gas.
HCl + ClONO2 → HNO3 + Cl2 nubes estratosféricas polares (11)
Esta reacción ocurre durante todo el invierno, siempre que las temperaturas sean suficientemente frías para formar nubes estratosféricas polares. Cuando las luz solar retorna en la primavera, hay suficientes moléculas de cloro al rededor de los 15-25 km de altitud, las cuales son fotolizadas para producir radicales de cloro:
Cl2 + hν → Cl• + Cl• l ~ 350 nm (12)
y subsecuentes radicales de monóxido de cloro via reacción 6.
Sin embargo, durante la primavera polar, la reacción 7 (la formación de radicales cloro y moléculas de oxígeno a partir de los radicales de monóxido de cloro y radicales oxígeno) es muy lenta debido a la baja cantidad de átomos de oxígeno presentes como consecuencia de la escacez de fotones a los 200 nm a esta altitud, y es aquí donde una segunda peculiaridad química ocurre. A temperaturas bajas, como en el vortex polar –el cual es muy frío inclusive en el primavera—los radicales de monóxido de cloro pueden formar un dímero, peróxido de cloro (ClOOCl):
ClO• + ClO• → ClOOCl (13)
Este dímero es inestable a temperatura ambiente pero se forma bastante rápido a temperaturas bajas (por debajo de -30 °C) y pueden ser fotolizadas:
ClOOCl + hν → Cl• + O2 + Cl• l ~ 300 nm (14)
Aunque la reacción 7 no puede ocurrir, la reacción 14 se da como una forma de regenerar radicales libres de cloro con la ayuda de la luz, y es de esta manera que el ciclo catalítico, el cual causa la destrucción del ozono, puede iniciar de manera intensa con el retorno de la luz solar.
¿De qué manera difiere esto con los ciclos catalíticos que consideramos anteriormente? — ¿Por qué hay una remoción total de ozono a ciertas altitudes en este vortex? Primero, la reacción 8 (la cual remueve radicales cloro y también puede terminar el ciclo) es muy lenta a las temperaturas bajas del vortex, y consecuentemente inefectiva. Segundo, todo el dióxido de nitrógeno requerido para la reacción 9 (la cual podría de la misma manera terminar el ciclo, mediante la formación de ClONO2) ha sido convertido en ácido nítrico durante el invierno (e.g., en las reacciones 9-11) y no está disponible para ser regenerado debido a que no hay un flujo ascendente en el vortex (en la base del vortex, el aire fluye desde el Polo Sur al Ecuador donde el flujo ascendete ocurre). Por consiguiente el ciclo transcurre de manera desapersivida y destruye todo el ozono a ese nivel. Finalmente, sin el ozono, reacción 3, el cual de otra manera calentaría esta región, se encuentra ausente, y de esta manera el vortex se mantiene en la primavera, agravando la destrucción del ozono.

polar en Asker, Norway
Imagen de dominio público;
fuente de la imagen: Wikimedia
Commons
La única razón por la cual el agujero en la capa de ozono es más severo en el Polo Sur que en el Polo Norte es debido a que las temperaturas de primavera en la estratósfera sobre el Polo Norte son un poco más altas que en el Polo Sur. La presencia de más cadenas montañosas de mediana y alta altitud en el Hemisferio Norte cambian la dinámica del flujo atmosférico, lo que conlleva a la poca cantidad de nubes estratosférica polares.
Al final de la primavera, el flujo de aire rico en ozono calienta el vortex mediante la reacción 3, lo que conlleva a su eventual destrucción. En virtud de los intercambios posibles con otras partes de la atmósfera, el agujero en la capa de ozono se recarga con ozono del aire circundante.
Durante algunos años, el agujero en la capa de ozono sobre la Antártica crece lo suficiente como para alcanzar a cubrir a Australia, Nueva Zelanda, Chile, y Argentina, un tamaño 1.5 veces superior al de los Estados Unidos; y cuando la magnitud del agujero en la capa de ozono se recrudece, el aire pobre en ozono se traslada hacia áreas pobladas, como por ejemplo Sur Africa. Para las personas en estos países, el agujero en la capa de ozono trae una amaneza directa para su salud. La preocupación principal es la continua exposición a los rayos ultravioleta, los cuales pueden causar cáncer en la piel y cataratas oculares. Además la radiación ultravioleta excesiva causa daños a plantas y a materiales de construcción.
Los CFCs y el ozono hoy
Actualmente contamos con una buena comprensión de los procesos físicos y químicos que gobiernan la capa de ozono.
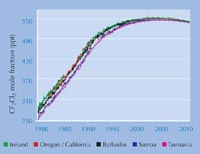
de CFCs crece rápidamente
pero ahora está
reduciéndose. Información
sobre los CF2Cl2, de las cinco
estaciones de monitoreo
AGAGE de 1978 al día de hoy,
tomadas de la página
electrónicaw2 del AGAGE en
Septiembre de 2010. Haga
clic sobre la imagen para
ampliarla
Imagen cortesía de the AGAGE
project
Una vez el verdadero impacto de los CFCs sobre el deterioro de la capa de ozono se hizo aparente, gobiernos del mundo aprobaron regulaciones con el objetivo de detener el uso de CFCs, reemplazándolos con especies alternativas, de corta vida (hidrofluorocarbonados e hidroclorofluorocarbonados), los cuales eventualmente también serían retirados: El Protocolo de Montreal de 1987 y en especial las enmiendas hechas en 1990 y en 1992, las cuales promovieron la eliminación rápida de estas species fueron exitosas.
La información más reciente de la AGAGE (Estudio Global Avanzado de Gases Atmosféricos)w2, el cual ha estado monitoreando los niveles de CFCs y sus sustitutos desde 1978, muestra que los niveles atmosféricos de diclorodifluorometano (CF2Cl2), el CFC más duradero, están reduciéndose: la legislación ha sido efectiva (izquierda). Un agujero en la capa de ozono continúa formándose durante la estación de primavera sobre el Polo Sur, pero se estima que para el año 2050 esto no seguirá sucediendo, y que para el año 2080 el ozono global retornará a los niveles de los años 1950s
The ozone hole is the result of an increased use of CFCs, which began in the 1930s – like any other gas, CFCs take 30-40 years to reach the upper stratosphere, which means that there is a corresponding lag in their effect on the ozone layer. We are currently experiencing the stratospheric chlorine peak resulting from the highest levels of CFC use in the 1980s – so the maximum size the ozone hole reaches each year should begin to decrease a few years from now.
Aunque la recuperación es lenta, se cree que definitivamente el desastre se ha prevenido: los científicos han calculado que si el uso de CFCs hubiese continuado al ritmo de crecimiento de los 1970s, de un 3% por año, esto hubiese conducido a la formación de un agujero global para el año 2060, con todos los problemas de salud que hubiese acarreado (ver a la derecha; Newman et al., 2009).
Quizá la lección más importante que se puede aprender del agujero en la capa de ozono es la manera rápida como nuestro planeta puede cambiar como resultado del impacto humano—especialmente hacia lo negativo, pero también en cuanto a mejoramientos—y que los cambios son posibles si tomamos medidas concertadas, efectivas y rápidas.
References
- Crutzen PJ (1970) Influence of nitrogen oxides on atmospheric ozone content. Quarterly Journal of the Royal Meteorological Society 96: 320-325. doi:10.1002/qj.49709640815
- Crutzen PJ (1971) Ozone production rates in an oxygen-hydrogen-nitrogen oxide atmosphere. Journal of Geophysical Research 76(30): 7311-7327. doi:10.1029/JC076i030p07311
- Farman JC, Gardner BG, Shanklin JD (1985) Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction. Nature 315: 207-210. doi:10.1038/315207a0
-
El artículo se puede accede gratis en la página electrónica Nature (www.nature.com) o directamente mediante este enlace:http://tinyurl.com/2wemxhn
-
- Molina MJ, Rowland FS (1974) Stratospheric sink for chlorofluoromethanes – chlorine atomic-catalysed destruction of ozone. Nature 249: 810-812. doi:10.1038/249810a0
- El artículo se puede accede gratis en la página electrónica Nature (www.nature.com) o directamente mediante este enlace:http://tinyurl.com/2u69cul
- Newman PA et al. (2009) What would have happened to the ozone layer if chlorofluorocarbons (CFCs) had not been regulated? Atmospheric Chemistry and Physics 9: 2113-2118. doi: 10.5194/acp-9-2113-2009
- Patterson L (2010) A chemical bond: Nick Barker, linking schools and universities in the UK. Science in School 15.
- Veneu-Lumb F, Costa M (2010) Usando la prensa en el aula de ciencias. Science in School 15: 30-33.
Web References
- w1 – El Sondeo Británico en la Antártica es la entidad reponsable por las actividades científicas del Reino Unido en esta región. Ver: www.antarctica.ac.uk
- w2 – El Estudio Global Avanzado de Gases (AGAGE, de su escritura en Inglés), es una iniciativa patrocinada por la NASA la cual ha estado monitoreando la composición de la atmósfera global de manera continua desde 1978, incluyendo CFCs y muchos de los gases de invernadero—aparte de CO2 –identificados en el protocol de Kyoto. Para mayor información sobre esta base de datos, ver:http://agage.eas.gatech.edu
Resources
- Sidney Chapman fue quien identificó por primera vez el mecanismo fotocatalítico por el cual el ozono se forma y degrada, ver:
-
Chapman S (1930) On ozone and atomic oxygen in the upper atmosphere.Philosophical Magazine Series 7 10(64): 369-383. doi: 10.1080/14786443009461588
-
- Jonathan Shanklin, uno de los científicos quien descubrió el agujero en la capa de ozono, publicó sus reflexiones 25 años después del descubrimiento:
-
Shanklin J (2010) Reflections on the ozone hole. Nature 465: 34-35. doi: 10.1038/465034a
-
Obtenga aquí, de manera gratuita, una copia del, o suscríbase hoy a Nature: www.nature.com/subscribe
-
- Nature también ha publicado una colección de artículos que nos han permitodo mejorar nuestro conocimiento sobre la estratosfera y la capa de ozono, o que han relatado la historia del descubrimiento, algunos de los cuales se pueden obtener gratis. Ver: www.nature.com/nature/focus/ozonehole
- La página de la NASA sobre el ozono ofrece mapas históricos y hechos sobrela capa de ozono, y una galería en multimedia relacionada con el ozono, igualmente una colección de módulos educativos relacionados con los temas del ozono, y mucho más. Ver: http://ozonewatch.gsfc.nasa.gov
- La Universidad de Cambridge, en le Reino Unido, ha diseñado un tur virtual de la capa de ozono, también de su historia y su ciencia. El tur se encuentra disponible en Inglés, Francés y Alemán. Ver: www.atm.ch.cam.ac.uk/tour
- El grupo de 74 científicos que participó en el panel de estudio sobre la evaluación del ozono en 2002, en Les Diablerets, Suiza, publicó 20 Preguntas y Respuestas sobre la Capa de Ozono, incluyendo las contribuciones hechas por los ciclos de actividad solar y erupciones volcánicas. Ver: www.gcrio.org o use el siguiente enalce: http://tinyurl.com/2wpvf9r
- Introduction to Atmospheric Chemistry (Introducción a la Química Atmosférica) Atmosférica por el profesor Daniel J. Jacob, de la Universidad de Harvard, este documento se encuentra disponible de manera gratuira como archivo PDF, contien una sección sobre le ozono, incluyendo el diagrama ‘Cronología del agujero en la capa de ozono.’ (capítulo 10.3.3). Ver: http://acmg.seas.harvard.edu/peopleo use el siguiente enalce: http://tinyurl.com/39vhy6a
- Ozzy Ozone es un programa de la página electrónica de las Naciones Unidas sobre el medio ambiente el cual ofrece tiras cómicas educativas, juegos, un glosario, y mucho más– también inluye paquetes educativos que se pueden acceder con los textos del profesor y del estudiante para ser utilziados en la escuela primaria y secundaria. Este material está disponible en Inglés, Francés, y Español. Ver: www.ozzyozone.org
- La página electrónica sobre el Deterioro de la Capa de Ozono diseñada por el científico y escritor Rod Jenkins contien amplia información: www.ozonedepletion.info
- La página electrónica de las Naciones Unidas sobre el Programa del Medio Ambiente ‘OzonoAction’ ofrece una amplia colección de bases de datos e información sobre el ozono y el Protocolo de Montreal. Ver: www.unep.fr/ozonaction
-
Visite también las páginas electrónicas de las Naciones Unidas sobre el Programa del Medio Ambiente ‘Ozone secretariat,’ en Inglés, Francés y Español: http://ozone.unep.org
-
- La NASA ofrece dos videos en la Internet sobre actividad atmosférica en el polo Ártico. Esta información ha resultado de los monitoreos hechos por el Satélite de Investigación en la Atmósfera Exterior (UARS, de su escritura en Inglés).
-
Observe el increment en la concentración de cloro nitrato en Febrero/Marzo de 1993 www.nasaimages.orgo use el siguiente enlace: http://tinyurl.com/2w6wgh4
-
Este video muestra la formación de nubes estratosféricas polares. Ver www.nasaimages.org o use el siguiente enlace: http://tinyurl.com/33dfn6e
-
- Adicionalmente, la NASA ha publicado imagenes, durante una estación, sobre la vida del agujero en la capa de ozono. Ver: www.nasa.gov/vision/earth/lookingatearth/25TOMSAGU.html
Review
El agujero en la capa de ozono es un problema global, usted encontrará este artículo bastante útil para aprender más sobre este tema. Los procesos químicos involucrados se describen en detalle. Este artículo puede ser utilizado en las clases de química cuando se aborden continidos como la estructura atómica y enlaces químicos, radicales libres, ciclos catalíticos, y la influencia de la luz y la temperatura en las reacciones químicas.
En las clases de ciencias de la tierra, el artículo puede encajar en el contexto de los siguientes tópicos:
- Influencia atmosférica en el clima
- Procesos biológicos que ocurren en la superficie terrestre y que afectan la vida marina
- La morfología terrestre y la distribución de cadenas montañosas en la superficie terrestre
- El cambio de estaciones, el eje axial de la tierra y su rotación.
Hay oportunidades para colaboración interdisciplinaria entre las clases de química y ciencias de la tierra. Algunos tópicos posibles son los siguientes:
- La distribución geográfica de organismos que producen sustancias químicas activas en ciclos naturales catalíticos. ¿Dónde viven esos organismos? ¿Qué tipo de sustancias químicas son producidas por estos organismos?
- La composición química de la atmósfera y su influencia en el clima. ¿Cuáles son los gases que componen la atmósfera? ¿En qué forma las propiedades de la atmósfera determinan las condiciones climáticas en la superficie terrestre, y cómo se diferencia este proceso con lo que ocurre en otros planetas?
Este artículo también podría ser la base de una clase sobre la manera como la ciencia es presentada en los medios de comunicación. Los estudiantes podrían comparar este artículo con otros publicados en diferentes medios: ¿Se presenta un punto de vista balanceado con respecto a la pregunta, al mencionar los componentes químicos y naturales que conducen a la formación del agujero en la capa de ozono? ¿Se minimiza o enfatiza el fenómeno? ¿Por qué? — ¿Es esto debido a la ignorancia de los periodistas, a las estrategias políticas, o a las dos? Para mayor información sobre ideas sobre la utilización de las noticias en el salón de clase consulte Veneu-Lumb & Costa (2010).
Finalmente, este texto puede ser base de un ejercicio de comprensión de lectura. Algunas preguntas son las siguientes:
- ¿Por qué actualmente este tema goza de tan amplio debate?
- ¿Cuál es el rol de los factores naturales en el crecimiento del agujero en la capa de ozono? y ¿Qué se puede decir de los factores humanos?
Teresa Celestino, Italia





