De wieg op slot doen Understand article
Vertaald door Carolien G.F. de Kovel. De onderzoeksgroep van Winfried Weissenhorn aan het European Molecular Biology Laboratory in Grenoble, Frankrijk, heeft een mogelijke manier ontdekt om een scala aan gevaarlijke virussen aan te pakken. Claire Ainsworth gaat op onderzoek uit.
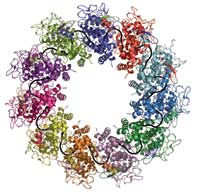
kleuren) binden aan één
RNA-molecuul (zwart) om een
complex te vormen
Figuur met dank aan Winfried
Weissenhorn
Het is misschien wel een van de meest gevreesde ziekten in de wereld. Als ze eenmaal verschijnen, voorzeggen de klassieke symptomen – struikelen, kwijlen, angst voor water, verlamming – vrijwel altijd de dood. Slechts vijf mensen hebben ooit rabiës overleefd, en op één na leden ze allemaal blijvende neurologische schade. Hoewel vaccinatie en preventieve maatregelen na blootstelling aan het virus de impact van de ziekte dramatisch hebben gereduceerd in Europa en Noord-Amerika, is er nog steeds geen genezing mogelijk. Rabiës blijft een serieuze dreiging in veel ontwikkelingslanden, waaraan tot wel 70.000 mensen per jaar sterven.
Het is verontrustend dat rabiës en dergelijke virussen nu opnieuw de kop opsteken in de ontwikkelde landen, waarbij het virus wordt overgebracht door vleermuizen. De ontdekking van Winfried Weissenhorn, Rob Ruigrok en hun collega’s van een mogelijke methode om het virus aan te pakken is hoog tijd. De teams, die gestationeerd zijn aan het European Molecular Biology Laboratory in Grenoble, Frankrijk en het aanpalende Centrum voor Virus-gastheercel-interacties Unit for Virus Host Cell Interactions (UVHCI) hebben de structuur ontrafeld van het eiwit dat het genetisch materiaal van het virus omhult en het onzichtbaar maakt voor het immuunsysteem van het lichaam tot het de kans krijgt zichzelf te kopiëren. Dit maakt het misschien mogelijk om medicijnen te gebruiken om het genetisch materiaal op te sluiten in zijn beschermende wieg en daardoor vermenigvuldiging van het virus te voorkomen.
Maar dit werk heeft nog implicaties buiten het rijk van de specifieke ziekte hondsdolheid. Het blijkt namelijk dat vele andere virussen, inclusief Ebola, ziekte van Borna en het mazelenvirus vergelijkbare kokons hebben om hun genoom, wat betekent dat dit resultaat ook licht zo kunnen werpen op de oorsprong van dit soort virussen en hoe ze evolueerden. Het genoom van het hondsdolheidvirus, net als dat van een aantal andere virussen, bestaat uit een enkele streng RNA, een molecuul dat lijkt op het DNA waar onze genen in geschreven staan. Maar anders dan bij DNA kan de informatie die gecodeerd staat in het RNA van het virus niet direct worden gebruikt om de eiwitten te bouwen die nodig zijn om het virus te maken. In plaats daarvan is er een kopie in spiegelbeeld, een soort chemisch negatief van de sequentie, nodig. Dus voor het virus de eiwitten kan maken die de schaal vormen die het genoom beschermt, moet het eerst deze ‘negatieve streng’ van RNA omzetten naar positieve strengen die dan weer vertaald kunnen worden in eiwitten. Het moet ook meer kopieën maken van zijn genoom om nieuwe virussen te vormen

Figuur met dank aan EMBL Photolab
Voor het virus zijn deze processen vol gevaar. Zoogdiercellen, inclusief menselijke cellen, bevatten afweersystemen die onbekend RNA aanvallen en vernietigen. Het virus verbergt dus zijn kwetsbare genoom door het stevig in te pakken in een nucleocapside, een schaal die is gemaakt van eiwit dat nucleoproteïne heet, om het te beschermen totdat het in de cel kan komen waar het de cellulaire machinerie van de gastheer kan kapen om te repliceren en de viruseiwitten te produceren. Het nucleoproteïne beschermt het genoom, maar helpt daarnaast bij het beheersen van het evenwicht tussen de productie van eiwitten die nodig zijn voor de vermenigvuldiging van het virus en het vermenigvuldigingsproces zelf, omdat die processen niet tegelijkertijd kunnen lopen. Het nucleocapside speelt op deze manier dus een sleutelrol in de levensgeschiedenis van het virus.
Tot nu toe echter kwamen de enige aanwijzingen die wetenschappers hadden over hoe nucleoproteïnes werken uit de wazige beelden van de elektronenmicroscoop waarop te zien was hoe de nucleoproteïne-moleculen polymeriseren op het genoom om nucleocapsiden te vormen. Deze beelden onthulden niet de structuur van het eiwit zelf. Om meer te ontdekken, werkten van het UVHCI en WW samen om kristallen te maken van nucleoproteïne en de structuur ervan te bepalen met behulp van Röntgenstraling met hoge intensiteit, die beschikbaar is bij de Europese Synchroton-Stralingsfaciliteit (European Synchrotron Radiation Facility), ook in Grenoble. Kristallen zijn symmetrische structuren, en als ze worden blootgesteld aan Röntgenstraling vormen ze een zeer geordend diffractiepatroon waaruit wetenschappers de precieze vorm van het molecuul kunnen opmaken. Door de structuur van het nucleoproteïne te bepalen, zouden de onderzoekers in staat zijn te beginnen met het ontwerpen van medicijnen die het virale genoom zouden kunnen opsluiten binnenin zijn beschermende schaal.
Het project begon in Robs lab, waar zijn team sinds het midden van de jaren negentig werkte aan de nucleoproteïnen van een aantal negatief-strengige RNA-virussen. Het hondsdolheidvirus was toevallig degene waarmee het gemakkelijkst te werken viel. Aurélie Albertini, een promovenda in het lab, slaagde erin insektencellen in celkweek het nucleoproteïne van rabiës te laten produceren. Het proteïne wikkelde zichzelf om de RNA-moleculen van de gastheercel, waarbij het ringen vormde die 9-13 eiwitmoleculen bevatten. Rob Ruigroks groep had zich al gerealiseerd dat die ringen zich gedroegen als miniatuur-nucleocapsiden en elektronenmicroscopie leverde ruwe inzichten in hun structuur. Deze lijkt sterk op het rabiës nucleoplasmide en daarom konden ze gebruikt worden om de structuur van nucleoproteïne om RNA te bestuderen.
Aurélie begon te werken aan het maken van nucleoproteïne-RNA-kristallen, een project waarop ze later gezelschap kreeg van Amy Wernimont, een postdoc in het lab van Winfried.
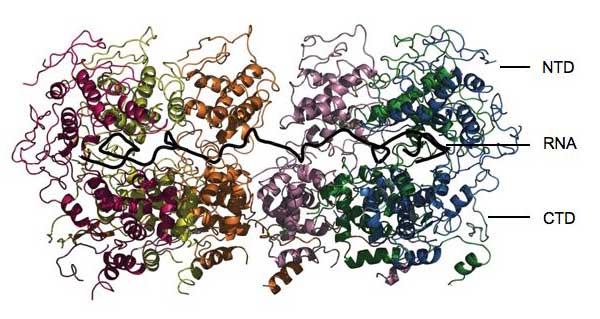
Figuur met dank aan Winfried Weissenhorn
Maar de moleculen wilden niet leuk meespelen en zowel Aurélie als Amy worstelde voor een hele poos om de kristallen in handen te krijgen die Amy in staat zouden stellen de structuur te bepalen met een resolutie van 4 Ångström, wat scherp genoeg is om de eiwitopvouwing te onderscheiden, maar nog niet genoeg om de volgorde van de aminozuren, de individuele bouwstenen van een eiwit, te bepalen. Een van de problemen dat de cel waarmee ze werkte slechts hele kleine hoeveelheden nucleoproteïne produceerde.
Gelukkig was de high-throughput-faciliteit voor kristallisatie van Josan Márquez in de buurt om het probleem te helpen oplossen, omdat die maar hele kleine monsters nodig had. “De opzet van de kristallisatierobots was echt geweldig”, herinnert Winfried zich. Als we grote monsters nodig zouden hebben gehad zouden we niet in staat zijn geweest de juiste kristallisatiecondities uit te zoeken”. Het team vond uiteindelijk de juiste condities, de precieze concentratie van het eiwit en een ingewikkelde combinatie van chemische stoffen die nodig zijn voor de kristallisatie, en slaagde erin ze zodanig af te stemmen dat ze 3.5 Ångström resolutie haalden – genoeg om een gedetailleerd model van de eiwitstructuur te construeren. Er kwam ook hulp van Raimond Ravelli, die hielp bij de gegevensverzameling, het fine-tunen van de van de belichtingstijd van de Röntgenstraling om de beste resultaten te krijgen en met allerlei advies bij verschillende stadia van het onderzoek naar de eiwitstructuur.
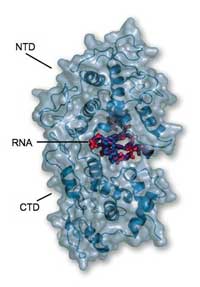
laat zien dat het RNA volledig
ingeklemd zit tegen het oppervlak
van het NTD (boven) en de CTD
(onder) en daardoor niet toegankelijk
is voor de afbrekende enzymen van
de gastheer of voor het polymerase
Figuur met dank aan Winfried
Weissenhorn
De resultaten lieten zien dat het nucleoproteïne zich volledig rond het RNA klemt, waardoor het RNA wordt weggesloten als familiejuwelen in een bankkluis. “Het is niet toegankelijk voor welk enzym ook om het aan te vallen”, zegt Winfried. Het eiwit bestaat uit twee belangrijke werkzame eenheden, of domeinen. Het ene, CTD genaamd, omvat één kant van het RNA en plakt ook aan de CTD’s van andere nucleoproteïne-moleculen, waarmee het helpt bij de vorming van helische cocon. Het andere domein, het NTD, bevindt zich aan de andere kant van het RNA en maakt geen uitgebreid contact met de andere nucleoproteïnes. De algehele structuur is als een klem die om het RNA klemt en alles buitensluit. “Het nucleoproteïne voorkomt dat het RNA herkend wordt door het aangeboren immuunsysteem”, zegt Winfried. “Maar hoe wordt het dan weer toegankelijk voor replicatie en translatie?”
Het antwoord ligt in twee uitwaaierende draadachtige structuren die uitsteken van beide domeinen. Deze zouden kunnen werken als scharnieren die de NTD-regio omhoog laten buigen en de nucleoproteïne-klem openklappen, waardoor virale enzymen toegang krijgen tot kleine stukken van het genoom tegelijkertijd. Een specifiek eiwit, fosfoproteïne P, zou hierbij betrokken kunnen zijn. Het koppelt RNA-polymerase, het eiwit dat nodig is om het genoom te kopiëren, aan het nucleoproteïne, en zou misschien kunnen binden aan een van de scharnieren om het NTD opzij te laten zwaaien.
Dit scharniermechanisme biedt een mogelijke manier om virussen als het hondsdolheidvirus aan te pakken door middel van medicijnen die het verstoren. “Als ons idee dat het opengaat klopt, zouden we het wellicht ook dicht kunnen slaan”, zegt Winfried. “Dit zou de virale replicatie blokkeren.” Opgesloten in zijn eiwitwieg, zou het virale genoom machteloos zijn en uiteindelijk door de cel worden opgeruimd. De volgende stap naar de ontwikkeling van zulke medicijnen zou een systematische zoektocht zijn naar kleine chemicaliën de in staat zijn aan de scharnierregio te binden, waarbij ze het opengaan van het nucleoproteïne blokkeren.
De ontdekkingen zouden ook enig inzicht kunnen geven in hoe zulke negatief-strengige RNA-virussen geëvolueerd zijn, zegt Winfried. Verwante virsussoorten kunnen heel verschillende genoomsequenties hebben, wat het moeilijk maakt allen op grond van vergelijking van sequenties conclusies te trekken over hun evolutionaire geschiedenis. Structuren daarentegen zijn een ander verhaal. Dezelfde fysieke structuur kan gebouwd worden uit allerlei verschillende gen- en aminozuursequenties. Dus zelfs als genen evolueren en dramatisch veranderen, kunnen de structuren waarvoor ze coderen diepe evolutionaire verbanden laten zien tussen virussen.
Elektronenmicroscopie-plaatjes van RNA-moleculen van andere negatief-strengige RNA-virussen, zoals het mazelenvirus, het Marburg-virus en de kristalstructuur van het Borna-virus, suggereren dat hun nucleoproteïnen vergelijkbare scharnierende klemstructuur. Dit suggereert dat deze virussen een vergelijkbare tactiek gebruiken als de hondsdolheidvirussen om hun RNA af te schermen en dus ook een doelwit kunnen zijn voor medicijnen die hun cocon dicht kunnen houden. Het suggereert ook dat ze een gezamenlijke voorouder delen, zegt Winfried. “Uit de sequentie-analyse zou je niet denken dat ze verwant waren”, voegt hij toe. “Ik denk dat er mogelijk een voorouderlijk nucleocapside was, maar dat ze uit elkaar groeiden toen de virussen evolueerden om verschillende soorten cellen te infecteren.
Resources
- Het werk dat in dit artikel wordt beschreven werd gepubliceerd als:Albertini AA, Wernimont AK, Muziol T, Ravelli RB, Clapier CR, Schoehn G, Weissenhorn W, Ruigrok RW (2006) Crystal structure of the rabies virus nucleoprotein-RNA complex. Science 313: 360-363.
- Om meer te weten te komen over het werk van Winfried Weissenhorn en Rob Ruigrok, zie www2.ujf-grenoble.fr/pharmacie/laboratoires/gdrviro/
Institutions
Review
Dit artikel illustreert de aard van wetenschappelijk onderzoek als een doorgaand, dynamisch proces. Dat het moleculaire geheim van de levenscyclus van zelfs de eenvoudigste organismen uitgepluisd wordt door middel van geraffineerde technologieën, heeft gevolgen voor de vorderingen in medische behandelingen en ziektebeheersing.
Marie Walsh, Republiek Ierland





