
Il regno dei dinosauri si è concluso in primavera
Lara Carpinelli

Quanto segue è stato adattato da un articolo di ESRF News.
Tu non puoi passare: scopri come il rivestimento proteico attorno a una cellula uovo si “chiude” dopo la fecondazione per impedire l’ingresso di altri spermatozoi.

Secondo l’Organizzazione Mondiale della Sanità (OMS), l’infertilità colpisce circa il 17.5% della popolazione adulta mondiale. Le cause possono essere molteplici ed entrambi i partner possono esserne colpiti. Alcuni casi di infertilità sono associati a mutazioni nei geni responsabili della formazione del rivestimento dell’ovulo. L’involucro dell’ovulo, noto anche come zona pellucida (ZP), è una matrice extracellulare essenziale per la sua crescita e per la fecondazione e la protezione dell’embrione fino al suo impianto nell’utero. La ZP è costituita da diverse proteine che polimerizzano in lunghi filamenti formando una “rete” intorno all’ovulo.
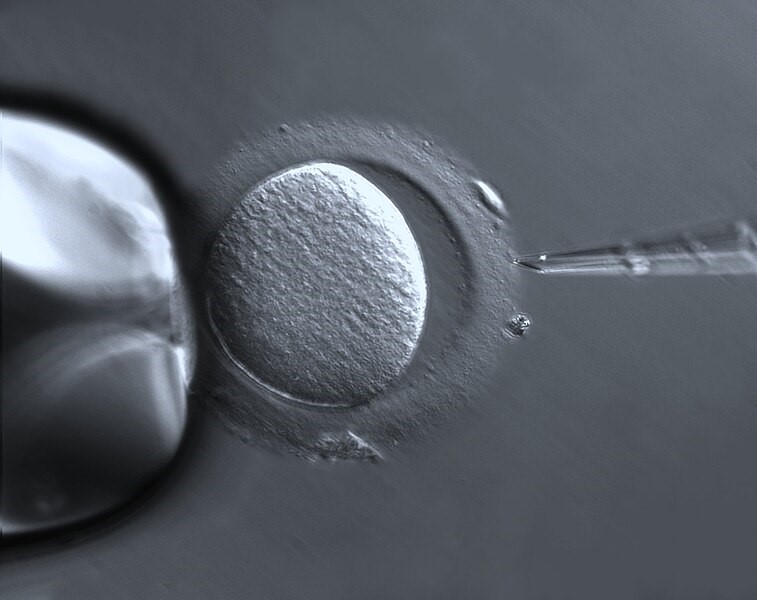
Mutazioni nelle proteine della ZP possono causare difetti o mancanza di questa rete. Attualmente non è chiaro quante donne infertili siano portatrici di mutazioni patogeniche dei geni della ZP, perché non tutte hanno il loro genoma sequenziato. Tuttavia, ad oggi sono stati segnalati diversi tipi di mutazioni della ZP.
Per capire come queste mutazioni influiscano sulla fertilità, dobbiamo comprendere i processi che avvengono durante la fecondazione a livello molecolare. Un gruppo di ricercatori ha scoperto come il riarrangiamento dei filamenti della ZP impedisca la fecondazione di un ovulo da parte di più di uno spermatozoo (polispermia), che è generalmente letale per l’embrione. Gli scienziati sapevano già che, dopo la fusione dello spermatozoo con l’ovulo, quest’ultimo rilascia un enzima che taglia in modo specifico la principale proteina della ZP, chiamata ZP2. Si sapeva anche che il rivestimento dell’ovulo diventa più “duro” dopo la fecondazione e che altri spermatozoi non riescono poi a penetrarlo. Tuttavia, la connessione tra questi processi e la base del blocco della polispermia rimanevano poco chiari. “Sapevamo che questi eventi erano associati, ma mancava un meccanismo molecolare che collegasse i diversi pezzi del puzzle”, spiega il Prof. Luca Jovine, leader dello studio.
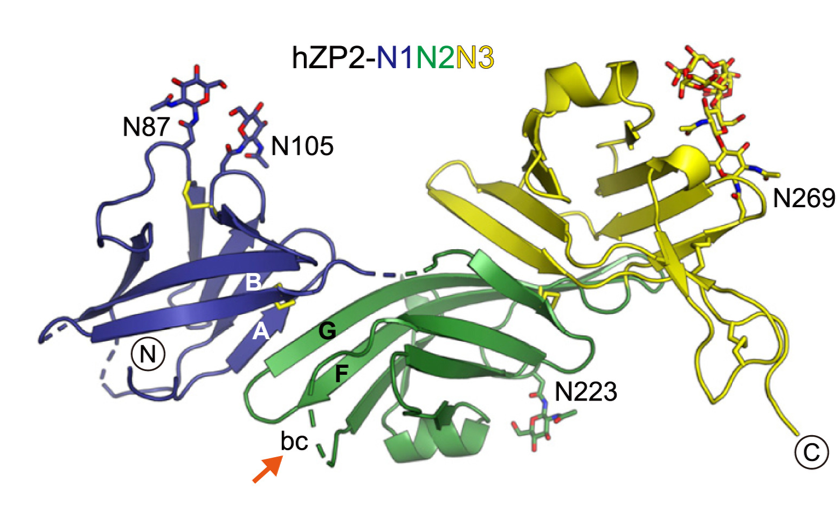
Il gruppo si è occupato di studiare la struttura di ZP2 prima e dopo il taglio innescato dalla fusione ovulo-sperma, e di come il clivaggio di ZP2 modifichi la struttura complessiva della rete della ZP. A tal fine, hanno esaminato diverse strutture di ZP2 e dei filamenti del rivestimento dell’ovulo utilizzando la cristallografia a raggi X all’ESRF, la Diamond Light Source, e BESSY II, nonché la microscopia crioelettronica presso lo SciLifeLab. Secondo Daniele de Sanctis, scienziato responsabile della beamline ID29, “vedere i dettagli atomici di un processo così fondamentale della vita è semplicemente sorprendente.”

Jovine e colleghi hanno scoperto che il clivaggio della parte di ZP2 che sporge dal filamento del rivestimento dell’ovulo (vedi figura 2) le consente di formare nuove interazioni con altre molecole di ZP2. Queste interazioni creano una vasta rete di cross-link che avvicinano i filamenti tra loro. Irrigidendo il rivestimento dell’ovulo e stringendo la sua rete, questo impedisce a ulteriori spermatozoi di penetrare la ZP. È come una cerniera che viene chiusa.
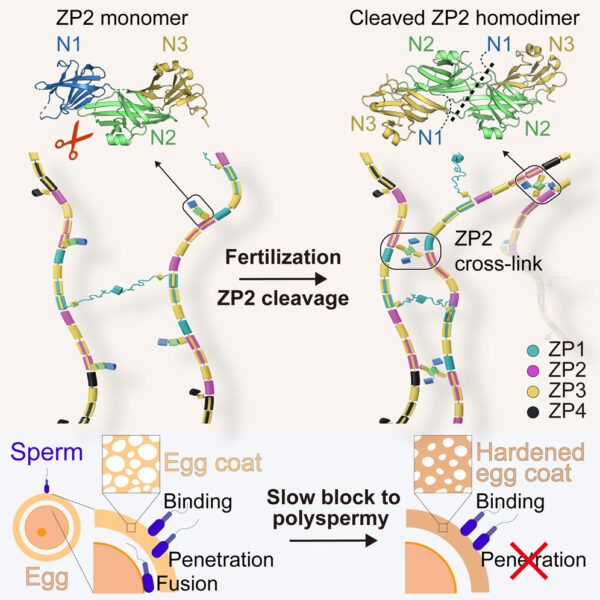
Il sistema non blocca la polispermia impedendo agli spermatozoi di legarsi alla ZP (come si credeva in precedenza), ma piuttosto ostacolando la penetrazione degli spermatozoi nell’involucro dell’ovulo. Il sistema meccanico che abbiamo scoperto è molto logico dal punto di vista evolutivo perché blocca in modo permanente gli spermatozoi in un modo che non dipende da come aderiscono al rivestimento dell’ovulo, che può variare in specie diverse.
Nonostante queste scoperte siano a un livello fondamentale, hanno importanti implicazioni per la futura medicina riproduttiva: per la prima volta abbiamo una visione molecolare di come l’involucro dell’ovulo cambi la sua architettura dopo la fecondazione e di come questo influisca sulla sua funzione. Questa conoscenza ci permette di interpretare un numero crescente di mutazioni del gene ZP umano legate all’infertilità femminile. Inoltre, poiché il rivestimento dell’ovulo è necessario per la fecondazione naturale (ma non per quella in vitro), informazioni dettagliate sulla sua struttura potrebbero avere applicazioni diagnostiche e, in linea di principio, essere sfruttate per sviluppare contraccettivi non ormonali.
Le beamline di biologia strutturale dell’ESRF hanno svolto un ruolo molto importante in questo studio. Nel 2017 hanno permesso a Jovine e de Sanctis di fornire un primo esempio di come il rivestimento dell’ovulo e gli spermatozoi si riconoscano all’inizio della fecondazione e, nel 2010, di risolvere la struttura 3D di ZP3, un’altra importante subunità del rivestimento dell’ovulo, anch’essa coinvolta nel legame con gli spermatozoi. Sono già in fase di pianificazione nuovi esperimenti che saranno resi possibili dalla nuova Extremely Brilliant Source dell’ESRF.

L’ESRF è la sorgente di luce di sincrotrone più luminosa del mondo. Ogni anno, 9000 scienziati provenienti da 21 Paesi partner e da tutto il mondo si recano a Grenoble per utilizzare i suoi raggi X estremamente brillanti per ricerche all’avanguardia. Questa ricerca fondamentale e applicata contribuisce ad affrontare le complesse sfide globali della nostra società, come la salute, l’energia e l’ambiente. Contribuisce inoltre allo sviluppo di nuove tecnologie per l’industria e alla conservazione del patrimonio culturale dell’umanità, illuminando la strada verso un futuro sostenibile e pacifico.
La forza dell’ESRF è la sua capacità di innovare, spingendo i limiti e cercando prestazioni sempre più elevate a beneficio della comunità scientifica mondiale. Nel 2020, l’ESRF ha lanciato una nuovissima generazione di sincrotrone ad alta energia, l’Extremely Brilliant Source (EBS) dell’ESRF. Con il sostegno dei 21 Paesi partner dell’ESRF, l’EBS offre agli scienziati nuove opportunità per svelare la struttura dei materiali e i meccanismi della vita, fino alla risoluzione atomica.
[1] Nishio S et al (2024) ZP2 cleavage blocks polyspermy by modulating the architecture of the egg coat. Cell 187: 1440–1459. doi: 10.1016/j.cell.2024.02.013

Lara Carpinelli