Supporting materials
Download
Download this article as a PDF

Il tè è una bevanda rinfrescante – e può anche aiutare gli studenti a scoprire reazioni chimiche importanti, come dimostrano questi semplici esperimenti con infusioni..
I tè, nero, a base di erbe o di frutti compresi, sono bevande popolari e ne esiste un’ampia gamma di varietà, accompagnate da una sorprendente gamma di colorazioni una volta ottenuta l’infusione. Come molti avranno notato, l’aggiunta di sostanze al tè può modificarne il colore – e una variazione di colore può indicare una trasformazione chimica.
In questo articolo, osserveremo più da vicino alcune reazioni chimiche – reazioni acido-base, ossidoriduzioni, e formazioni di complessi – che possono essere studiati utilizzando esperimenti semplici e sicuri con i tè.

Il tè viene ottenuto per infusione: un metodo fisico di estrazione nel quale composti chimici, come oli e composti organici volatili, si dissolvono nel liquido di infusione. Nel caso dei sacchetti di tè, il materiale vegetale che costituisce il materiale per l’infusione non può passare attraverso il sacchetto, ma le particelle più piccole e i composti che determinano il colore e l’aroma possono farlo. In questo modo, il sacchetto del tè agisce come una membrana semipermeabile.
Tradizionalmente, il termine ‘tè’ faceva riferimento ad un prodotto ottenuto dalla raccolta delle foglie della pianta del tè (Camellia sinensis) che in seguito venivano ulteriormente sottoposte a trattamenti. Questo prodotto ora è spesso denominato ‘tè nero’, a causa del suo aspetto prima dell’infusione. (Si tratta di una cosa diversa dal tè servito senza latte, che talvolta viene anche lui, in modo fuorviante, chiamato tè nero.) Oggigiorno, tuttavia, molti differenti materiali di origine vegetale sono denominati commercialmente tè, perciò in questo articolo utilizzeremo il termine ‘tè’ per indicare anche tutti questi prodotti, ed il termine ‘tè nero’ per riferirci specificatamente al tè tradizionale.
Abbiamo messo a punto le seguenti attività basate sui tè per studenti dai 14 ai 19 anni. Sono adatte anche dagli 11 ai 14 se ci si focalizza di meno sulla teoria che sta alla base delle reazioni chimiche. Le attività possono essere completate nel corso di una lezione (60 minuti circa), e raccomandiamo che gli studenti lavorino in gruppi di 3-4. Facoltativamente, gli studenti possono utilizzare i loro smartphones per registrare e rivedere i cambiamenti che osservano nel corso degli esperimenti.
Le infusioni dovrebbero essere preparate all’inizio della lezione e lasciate raffreddare fino a temperatura ambiente prima di condurre gli esperimenti. Le attività possono essere spiegate mentre le infusioni raffreddano. Occorre preparare le seguenti infusioni:
In questa attività, osserveremo le variazioni cromatiche che hanno luogo quando un acido o una base vengono aggiunti ad una infusione di tè di pisello dal sorprendente colore blu.
In caso di didattica a distanza, questa attività potrebbe essere effettuata a casa dagli studenti più grandi. In questo caso, si possono usare dei bicchieri piccoli o tazzine bianche al posto delle provette, e bicarbonato di sodio invece dell’idrossido di ammonio, in quanto è più sicuro da utilizzare, sebbene la variazione di colore risulti poi meno appariscente.
Per preparare questa attività, ad ogni gruppo occorrono:
Il gruppo di studenti dovrebbe lavorare secondo i seguenti passaggi:
Discuss the following questions with your students:
Nel corso dell’attività gli studenti dovrebbero osservare i seguenti cambiamenti di colore (vedere figura 1):
Questi cambiamenti di colore avvengono perché il tè di pisello blu contiene molecole chiamate antocianine (vedere il riquadro di testo). Queste molecole alterano la lunghezza d’onda della luce che assorbono, e quindi il loro colore, in funzione del pH della soluzione in cui si trovano. Il succo di limone contiene l’acido citrico e altri acidi, quindi la sua aggiunta al tè produce una soluzione più acida (con pH minore) e un visibile cambiamento di colore. L’aggiunta di una base debole come l’idrossido di ammonio o il bicarbonato di sodio fa diminuire il numero degli ioni idrogeno, portando ad una minore acidità (un valore di pH più elevato) e ad un altro cambiamento di colore.

Immagine gentilmente concessa da Marisa Prolongo
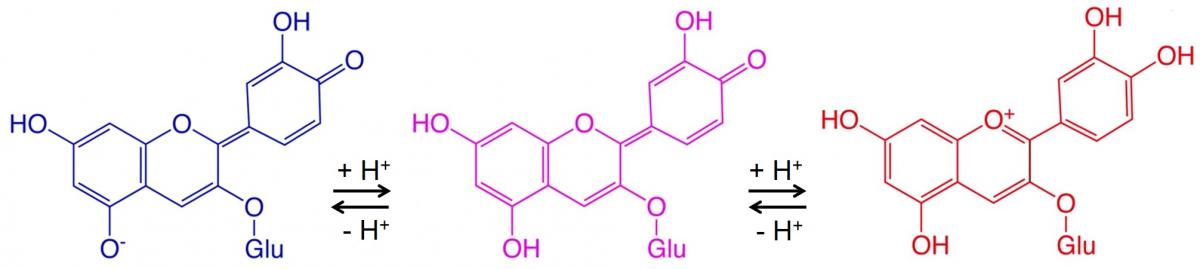
Le antocianine sono un gruppo di pigmenti idrosolubili responsabili della colorazione rossa, blu, o viola di molti fiori, frutti (compresi mirtilli e lamponi), e ortaggi (come il cavolo rosso). [1] Questi pigmenti sono anche in parte responsabili dei colori autunnali delle foglie.hese pigments are also partly responsible for autumn leaf colours.
La porzione delle molecole di questi pigmenti che produce il colore è chiamata cromoforo. Nella zona del cromoforo, la differenza di energia tra due orbitali molecolari cade nella regione spettrale della luce visibile. L’aggiunta di uno ione idrogeno ad un cromoforo può variare la sua lunghezza d’onda di assorbimento, e quindi il suo colore. Poiché l’acidità di una soluzione (o valore di pH) dipende dalla concentrazione degli ioni idrogeno, i cromofori – e il materiale vegetale che li contiene – agiscono potenzialmente come indicatori naturali acido-base.
Ci sono molti esempi di variazioni cromatiche che coinvolgono antocianine e altri coloranti vegetali sensibili al pH. La figura 2 mostra un esempio.
Qui, due reazioni reversibili, ciascuna che implica l’aggiunta di uno ione idrogeno alla molecola, causano una variazione di colore ad ogni passaggio. Condizioni acide (pH basso) spostano le reazioni reversibili verso destra (da blu a rosso), mentre condizioni basiche (pH elevato) spostano le reazioni reversibili verso sinistra (da rosso a blu).
Questo esperimento impiega una soluzione contenete ioni di ferro (III) per produrre una variazione di colore che indica la presenza di polifenoli quali i tannini contenuti nel tè. La soluzione dovrebbe essere preparata dall’insegnante prima della lezione sciogliendo un cucchiaio da tè di cloruro di ferro (III) esaidrato in 50 ml di acqua. In alternativa, si può usare una paglietta per pentole di acciaio o lana di acciaio, sebbene in questi casi il cambiamento di colore sarà più lento. Quando si usa la soluzione di ferro (III), è istantaneo.
Ciascun gruppo di studenti necessiterà dei seguenti materiali:
Gli studenti dovrebbero lavorare secondo i seguenti passaggi:
Discutete le seguenti questioni con i vostri studenti per esaminare i concetti-chiave:
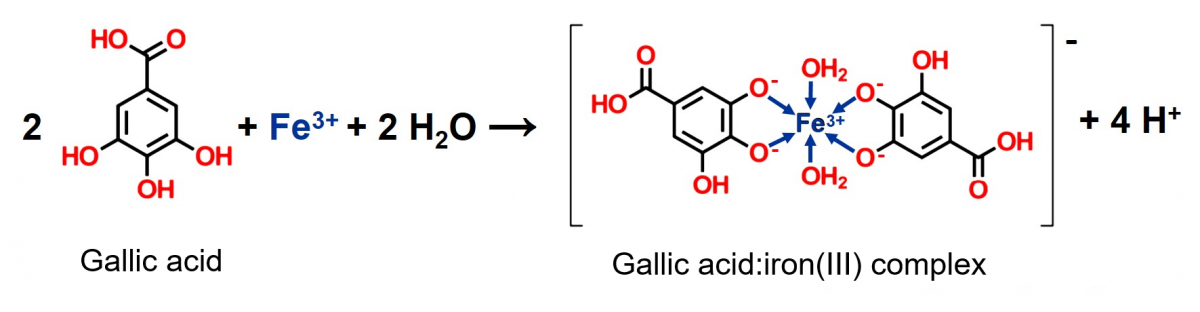
Nel corso dell’esperienza, il tè si scurisce quando sono presenti ioni ferro (III), passando dal marrone pallido al nero, assumendo l’aspetto di un inchiostro (vedere la figura 3). I composti responsabili di questo cambiamento sono i polifenoli, che reagiscono con gli ioni ferrici. Il tè contiene un certo numero di polifenoli, compresi i tannini che gli conferiscono il sapore amaro e l’astringenza, e un esempio di questi polifenoli è l’acido gallico con i suoi derivati, che sono parte della struttura di alcuni tannini. La chimica coinvolta è piuttosto complessa, ma in sintesi, l’acido gallico reagisce con gli ioni di ferro (III) per formare il pirogallato ferrico, uno ione complesso nero e insolubile.

Questa attività può essere usata come punto di partenza per discutere di come si formano i complessi dei metalli di transizione (il tipo di legame coinvolto, che cosa sono i ligandi, e come le variazioni di pH possono influenzarne la formazione).
La figura 4 mostra un esempio di un complesso di acido gallico e ferro (III), con due molecole di acqua che agiscono da co-ligandi per completare la sfera di coordinazione ottaedrica.[2]
Potete verificare la presenza di polifenoli anche in altre infusioni, per esempio in quelle a base di rooibos. Si possono ottenere colori diversi, dal marrone scuro al blu scuro, in funzione dei complessi di ferro (III) che si formano.
In un precedente articolo di Science in School,[3] avevamo introdotto l’idea dei cambiamenti di colore dovuti ad agenti ossidanti e riducenti (in quel caso provocati da reazioni chimiche tra lecca-lecca al glucosio e sali di permanganato.
In questa attività, guardiamo ai cambiamenti di colore dovuti all’azione di agenti ossidanti e riducenti sul tè di ibisco. Qui, il percarbonato di sodio agisce da ossidante e il sodio ditionito da riducente.
Ciascun gruppo di studenti necessiterà dei seguenti materiali:
Gli studenti dovrebbero lavorare secondo i seguenti passaggi:
Discutete con i vostri studenti le seguenti questioni:
Agli studenti si può anche chiedere di fare una loro ricerca per scoprire in che modo questa attività possa essere collegata ai prodotti sbiancanti. Per esempio:
Il tè di ibisco scolora (decolora) quasi completamente con il sodio ditionito, ma non con il sodio percarbonato (figura 5).

I decoloranti chimici sono prodotti usati per rimuovere il colore dai tessuti e per smacchiare. Essi reagiscono con molte sostanze organiche colorate, compresi i pigmenti naturali. Gli agenti ossidanti sono quelli più frequentemente usati, ma si usano anche alcuni riducenti.
Il sodio percarbonato è un tipico decolorante ossidante basato sui perossidi. Il gruppo perossido dà luogo a specie di ossigeno molto reattive, che sono gli agenti decoloranti (e ossidanti) attivi. Essi rompono i legami chimici nella regione del cromoforo delle molecole dei pigmenti (vedere il riquadro di testo), cambiando il loro colore.
Un decolorante riducente, come il sodio ditionito, agisce convertendo i doppi legami carbonio-carbonio del cromoforo in legami semplici, quindi riducendo lo stato di ossidazione del carbonio.
Sebbene la maggior parte dei reagenti siano comuni sostanze per uso domestico, alcuni, come la soluzione di idrossido d’ammonio, il sodio percarbonato, e il sodio ditionito, possono essere irritanti o corrosivi. Gli insegnanti dovrebbero osservare le norme sanitarie e di sicurezza locali, e le avvertenze riportate sulle etichette dei prodotti. Un camice, i guanti, e gli occhiali di protezione dovrebbero essere indossati da tutti gli studenti, in modo da evitare il contatto delle sostanze chimiche con la pelle e con gli occhi. Si dovrebbe fare particolare attenzione con il cloruro di ferro (III). Vedere anche le note generali di sicurezza sul sito di Science in School. Tutti i residui possono essere smaltiti in sicurezza versandoli nello scarico.
Questo articolo è basato su una presentazione fatta al festival Science on Stage Spagnolo (Ciencia en Acción) nel 2020 da Marisa Prolongo , aiutata dai nipoti Guillermo e Ana. Gli autori ringraziano l’Università Tecnica di Madrid (UPM) per il supporto fornito durante la realizzazione del progetto ‘Promoting inquiry-based STEM learning’ (Promuovere l’apprendimento sperimentale delle STEM) ; la Fondazione ‘la Caixa’ per il supporto con il progetto ‘Science and technology within everyone’s reach’ (Scienza e tecnologia alla portata di tutti); e le Società Reali Spagnole di Fisica (RSEF) e di Chimica (RSEQ).
[1] Rusishvili M et al. (2019) Unraveling the molecular mechanisms of color expression in anthocyanins, Physical Chemistry Chemical Physics 21: 8757-8766. doi: 10.1039/C9CP00747D
[2] Rattanakit P, Maungchang R (2019) Determining Iron(III) Concentration in a Green Chemistry Experiment Using Phyllanthus emblica (Indian Gooseberry) Extract and Spectrophotometry, Journal of Chemical Education 96:756-760. doi: 10.1021/acs.jchemed.8b00817
[3] Prolongo M, Pinto G (2018) Colourful chemistry: redox reactions with lollipops. Science in School 43: 41-45.
Al Wellington College abbiamo usato personalmente l’articolo sull’insegnamento ‘Colourful Chemistry: Redox Reactions with Lollipops’ che è stato scritto dagli stessi autori. Abbiamo osservato che gli studenti hanno veramente apprezzato l’aspetto visivo e anche il fatto di imparare di più sulla chimica che sta alla base della dimostrazione. Di conseguenza, sono entusiasta di provare gli esperimenti descritti in questo nuovo articolo per l’insegnamento che coinvolge diversi tipi di tè. Al momento nel Regno Unito i nostri studenti stanno seguendo le lezioni da remoto: l’Attività 1 può essere effettuata a casa dagli studenti prima della lezione, dando poi loro la possibilità di condividere i propri risultati.
Caroline Evans, Capo dipartimento di Chimica, Wellington College, UK
Download this article as a PDF