Supporting materials
Download
Download this article as a PDF

Tradotto da Roberta Frasson. Le attività industriali e i cambiamenti geologici possono influenzare la qualità dell’acqua, causando un inquinamento che costituisce un rischio per la salute umana e per l’ambiente.

Le attività industriali e i cambiamenti geologici possono diminuire la qualità dell’acqua, contaminandola con fertilizzanti, pesticidi, ioni metallici o composti organici, che possono mettere a rischio la salute umana e l’ambiente. E’ perciò cruciale monitorare costantemente la qualità delle sorgenti di acqua fresca come i fiumi.
Gli addetti al controllo delle acque sono una componente chiave di questo processo, per mantenerci sicuri da fonti di acqua inquinata. Essi controllano regolarmente la qualità dell’acqua, conducendo analisi quantitative (come determinare la concentrazione di uno ione in soluzione) su campioni raccolti in vari siti, prima e dopo il trattamento dell’acqua.
Nella seguente attività, gli studenti stessi si mettono nei panni di un tecnico addetto al controllo delle acque che lavora vicino a un impianto di produzione simile a quello della Tata Steel a Scunthorpe, UK. Essi dovranno affrontare un contesto specifico, condurre le analisi appropriate e determinare se l’industria sta o meno rimuovendo il tiocianato efficientemente dall’acqua di scarto.

Gli ioni tiocianato (SCN–) sono tossici per gli organismi acquatici, e si conosce che colpiscono le ghiandole tiroidee negli esseri umani, riducendo la capacità delle ghiandole di produrre gli ormoni necessari per la normale funzione del corpo.
I tiocianati possono avere molte origini diverse. Per esempio, la Coal gasification e la produzione di sostanze chimiche utili all’industria dal carbone producono grandi quantità di ioni tiocianato, insieme a un gran numero di altri composti tossici come fenoli e ammoniaca. Questi prodotti collaterali sono perciò componenti dell’acqua di scarto dell’industria.
I tiocianati possono anche essere trovati dove il cianuro è usato nella ricerca di metalli preziosi. Il cianuro è convertito a tiocianato tramite la reazione con lo zolfo, che si trova naturalmente nei minerali.
8CN– + S8 → 8SCN–
Anche alcuni pesticidi contengono ioni tiocianato in quanto parte dei loro composti attivi e velenosi. Tracce di tiocianato si trovano in natura nel corpo umano, come prodotti collaterali del metabolismo della cisteina, e la detossificazione del cianuro, che viene poi secreto nell’urina. Esso può essere introdotto nel corpo umano attraverso il fumo e come prodotto collaterale del metabolismo di alcuni farmaci utilizzati per curare l’ipertensione.
Il processo di rimozione degli ioni tiocianato dall’acqua di scarto ha luogo in enormi cisterne di cemento aperte all’aria che contengono una poltiglia attivata, un materiale biologicamente attivo formato da una varietà di microorganismi che possono demolire gli ioni tiocianato e altri contaminanti in composti meno pericolosi. La reazione chimica che avviene per neutralizzare il tiocianato è:
SCN– + 3H2O + 2O2 → HCO3– + NH4+ SO42- + H+
Questa reazione è un esempio di biorimediazionew1, un processo in cui i microorganismo vengono utilizzati per pulire suolo contaminato o acqua sotterranea. Anche le piante possono anche essere utilizzate per pulire terre contaminate in un processo chiamato fitorimediazionew2.
Prima e dopo il trattamento, l’acqua può essere facilmente testate per quanto riguarda la presenza di ioni tiocianato. Se la soluzione diventa color rosso sangue in seguito all’addizione di ferro cloruro (III), allora gli ioni tiocianato sono presenti secondo questa equazione:

Fe3+(aq) + SCN–(aq) → [FeSCN]2+(aq)
O, per intero,
[Fe(H2O)6]3+(aq) + SCN–(aq) → [Fe(H2O)5SCN]2+(aq) + H2O(l)
Questa reazione può essere utilizzata per l’analisi quantitative di basse concentrazioni di ioni tiocianato. Utilizzando un colorimetro si può misurare l’assorbanza a 480 nm del complesso [Fe(H2O)5SCN]2+e dedurre la concentrazione precisa degli ioni tiocianato, a patto che non sia troppo alta. E’ anche possibile utilizzare il metodo di confronto di colori, sebbene i risultati saranno meno precisi e solo qualitativi.
Come spiegato nel foglio di lavoro 1w3, gli studenti dovrebbero calarsi nel ruolo di un addetto al controllo delle acque di una piccola azienda di controllo qualità che controlla i risultati per assicurare che rispettino i criteri del Ministero dell’ambiente del Regno Unito.

L’effluente di un impianto industriale come quello della Tata Steel a Scunthorpe è risaputo contenere circa 250 mg/dm3 (250 ppm) di ioni tiocianato. Ciò nonostante, il livello di sicurezza stabilito dall’agenzia dell’ambiente del Regno Unito è di 10 mg/dm3, così l’effluente viene trattato e la concentrazione degli ioni tiocianato viene ridotta a 1 mg/dm3, ben al di sotto i limiti di sicurezza. Gli ioni tiocianato sono rimossi dallo scarico prima di riversarlo nel fiume Trent.
Recentemente c’è stato un periodo di freddo intenso, il quale può influenzare l’attività dei microrganismi. La compagnia è preoccupata che questo possa aver influenzato in suo impianto di trattamento dell’acqua e ridotto l’efficienza di rimozione degli ioni tiocianato dall’acqua di scarto.
L’acqua viene normalmente analizzata per quanto riguarda il parametro tiocianato nell’impianto tre volte al giorno, usando un semplice test: una soluzione acida di ferro cloruro (III) viene aggiunta al campione d’acqua e la concentrazione di tiocianato è misurata fotometricamente misurando l’assorbanza dovuta dal complesso ferro (III)-tiocianato. Ogni settimana vengono condotti un totale di 16 test indipendenti. Per una analisi più accurata vengono anche presi campioni dell’effluente iniziale e dell’acqua pronta per essere scaricata nel fiume.
Il tecnico della compagnia ha controllato, ma la compagnia sta cercando un esperto indipendente: te!
Devi indossare protezioni adatte per gli occhi e per le mani al fine di maneggiare acidi e tiocianati. Puoi consultare le guida di sicurezza sul sito di Science in School e alla fine di questo articolo.
La seguente attività è pensata per studenti di età compresa tra i 16 e i 18 anni, e dura circa 2 ore.

1. Preparare in anticipo le seguenti soluzioni per l’attività pratica:
a– Soluzione di tiocianato di potassio (KSCN) 250 mg/dm3 (250 ppm). Sciogliere 4.5 g di tiocianato di potassio in 500 cm3 di acqua distillata. Quindi diluire 50 cm3 di questa soluzione fino a 1dm3: ora è a una concentrazione di tiocianato pari a 250 mg/dm3.
b– Soluzione acida di ferro cloruro (III) (FeCl3(H2O)6) di concentrazione pari a 0.41 mol/dm3. Sciogliere 50 g di (FeCl3(H2O)6) in circa 250 cm3 di una soluzione di acido cloridrico (HCl) a una concentrazione pari a 1 mol/dm3
c– Dodici campioni marcati di differenti concentrazioni di ioni tiocianato
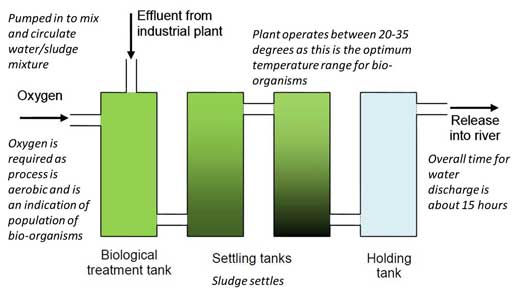
2. Fornire agli studenti una mappa dell’impianto (figure 1), un foglio di lavoro 1w3 che descrive l’ambientazione e il foglio di lavoro 2w4 che descrive tutti i dettagli del processo di analisi.
3. Gli studenti dovrebbero scrivere una lettera all’azienda che si occupa dell’impianto di trattamento dell’acqua di scarto richiedendo i campioni per l’analisi. Essi devono specificare a quale punto nel percorso dell’effluente attraverso l’impianto vorrebbero fossero prelevati dei campioni, quanti campioni richiedono e quando desiderano venga effettuato il prelievo. Gli studenti devono anche specificare la quantità di ciascun campione necessaria, come deve essere raccolto e che tipo di contenitore vorrebbero fosse utilizzato per la raccolta.
4. Gli studenti devono lavorare a coppie per analizzare i loro campioni secondo la procedura descritta nel foglio di lavoro 2w4.

Attenzione: indossare protezione per gli occhi. La soluzione di cloruro di ferro (III) è irritante.
1. Creare un grafico di calibrazione
a- Riempi tre burette, una con la soluzione di tiocianato di potassio contenente tiocianato 250 ppm, una con acqua distillata e una con la soluzione di cloruro di ferro (III)
b- A sei matracci da 100 cm3, aggiungere 0.0,2.0, 4.0, 6.0, 8.0 e 10.0 cm3 della soluzione di tiocianato di potassio 250 mg/dm3 e marcarli da A a F.
c- Aggiungere acqua distillata a ciascun matraccio per portare il volume fino a circa 80 cm3.
d- A ciascun matraccio aggiungere 10 cm3 di soluzione di cloruro di ferro (III) e poi aggiungere acqua distillata per portare il volume finale a100 cm3. Mescolare a lungo le soluzioni.
|
Matracci |
a |
b |
c |
d |
e |
f |
|---|---|---|---|---|---|---|
|
Volume di tiocianato di potassio Soluzione (cm3) |
0.0 | 2.0 | 4.0 | 6.0 | 8.0 | 10 |
|
Concentrazione di tiocianato (ppm) |
0 | 5 | 10 | 15 | 20 | 25 |
e- Misurare l’assorbanza di ciascuna soluzione usando un colorimetro.
f- Mettere in un grafico l’assorbanza (asse delle y) contro la concentrazione di tiocianato in ppm (asse delle x) per le sei soluzioni.
2. Analizzare i campioni
a- Aggiungere 10 cm3 di soluzione di concentrazione incognita di tiocianato ad un matraccio da 100 cm3 e aggiungere acqua distillata per portare il volume a circa 80 cm3.
b- Al matraccio aggiungere 10 cm3 di soluzione di cloruro di ferro (III) e poi aggiungere acqua distillata per portare il volume finale a100 cm3. Mescolare a lungo le soluzioni.
c- Misurare l’assorbanza della soluzione usando il colorimetro.
d- Utilizzare il grafico per trovare la concentrazione.
3. Scrivere una relazione alla compagnia del trattamento dell’acqua di scarto riassumendo i risultati ottenuti, includendo un consiglio riguardo a se l’effluente debba o no essere riversato nel fiume. Gli studenti devono descrivere l’evidenza sulla quale il loro consiglio si basa, e commentare la loro confidenza sui risultati, tenendo conto eventuali percentuali di errore che potrebbero esserci nelle loro procedure analitiche.
La ricerca nell’educazione ha mostrato quanto sia importante mettere idée teoriche in una ambientazione di progetto vissuto o calato nel mondo reale. Questa attività pratica è un buon esempio di mettere concetti della chimica analitica classica in un contesto di mondo reale. Offre inoltre l’opportunità di sviluppare capacità che siano trasferibili nell’elaborazione dei dati e nella loro comunicazione.
Marie Walsh, Istituto di Tecnologia di Limerick Irlanda
Download this article as a PDF