Supporting materials
Foglio di lavoro dello studente (Word)
Piatti autoriscaldanti: reazioni redox, elemento di passivazione e locali (Word)
Download
Download this article as a PDF

Tradotto da Massimo Presti. Avete mai desiderato una bevanda calda o un pasto, ma non avevate del fuoco o un fornello a portata di mano? Marlene Rau presenta due attività dal portale Lebensnaher Chemieunterricht che utilizzano reazioni chimiche per riscaldare i cibi - e illustra il tema delle…

Piatti auto-riscaldanti – originariamente sviluppati per usi militari – sono piatti già pronti dotati di auto-riscaldamento. Il riscaldamento del piatto può essere attivato in molti modi – premendo un pulsante sulla confezione, scartando e scuotendo il pacco, o versando il contenuto di un sacchetto in un altro, con un’attesa di qualche minuto – tutti metodi che usano reazioni chimiche esotermiche. I pasti possono essere usati per motivare gli studenti a studiare tali reazioni, in un modo relativamente sicuro e senza l’uso di un fornello. Inoltre, c’è il valore aggiunto di poter discutere degli aspetti ecologici negativi dei pasti usa e getta.
Per l’esperimento che segue, si usa il sistema per riscaldare il pasto “Crosse & Blackwell”, che si basa sulla reazione tra magnesio e acqua salata per produrre idrogeno:

Mg (s) + 2H2O (l) -> Mg2+ (aq) + H2 (g) ↑ + 2OH– (aq)
s: solido; l: liquido; g: gas; aq: in soluzione; the freccia verticale indica il rilascio di gas.
Questa reazione è molto lenta, a causa di “passivazione”, per cui, per accelerarla, si aggiungono ferro e sale. La passivazione è il processo mediante il quale un materiale è reso meno reattivo, di solito tramite la deposizione di uno strato di ossido sulla sua superficie: se si inserisce una striscia di magnesio in acqua fredda, la sua superficie si ossida a idrossido di magnesio (Mg(OH)2), e questo rivestimento prevenire ulteriori reazioni.
Perciò, nel pasto auto-riscaldante, del ferro viene aggiunto al magnesio, il che porta alla produzione di una cella locale – corrosione su piccola scala che accade quando due metalli di diversa reattività sono in contatto in presenza di acqua – la quale accelera la reazione esotermica. Poiché il potenziale degli elettroni di magnesio è inferiore a quello del ferro (il metallo meno reattivo), gli elettroni passeranno dal magnesio al ferro, e solo da lì poi in acqua. Anche se cationi di magnesio (Mg2+) e anioni idrossido (OH-) continuano ad essere formati, essi sono separati dal ferro e non si combinano per formare idrossido di magnesio. Come risultato, il magnesio non diventa “passivato” da un rivestimento di idrossido di magnesio, che abbasserebbe la reattività.
Poiché magnesio e ioni idrossido sono mobile a causa della diversa carica, in acqua pura formerebbero idrossido di magnesio, la carica sarebbe equilibrata e la reazione rallenterebbe di nuovo. Per evitare tutto questo, viene aggiunto all’acqua cloruro di sodio, in modo che ioni sodio (Na+) e cloruro (Cl–) del sale possano passare al posto degli ioni di magnesio e idrossido, equilibrando la carica.
L’esperimento può essere utilizzato per presentare e discutere i temi del trasferimento di elettroni, cella locale, passivazione, anodi sacrificabili, di corrosione e composizione dell’acqua (legami covalenti, polarità e numeri di ossidazione). Ci vogliono circa 45 minuti più il tempo per la discussione, e si è testato il tutto con successo per studiare le reazioni di trasferimento di elettroni e la corrosione, con alunni di 14 anni di età, studenti più grandi che lavorano sull’elettrochimica.
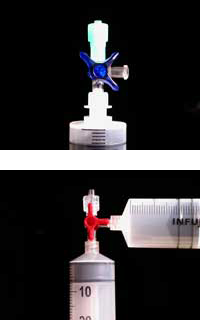
I materiali plastici necessari per l’esperimento possono essere ordinati come parte del kit ChemZw2 sviluppato in collaborazione con il progetto Chemieunterricht Lebensnaher (LNCU)w3 ma sono disponibili anche presso i fornitori di laboratori medici e chimici.
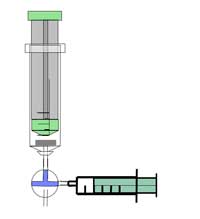
Nota di sicurezza: indossare occhiali di sicurezza. La reazione genera gas altamente infiammabile – prestare attenzione. Si veda anche la nota di sicurezza generale.
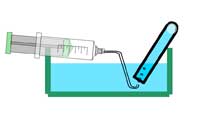
Facoltativo: aggiungete una goccia di soluzione di fenolftaleina all’acqua che avete raccolto nel bicchiere. Che cosa succede? Perché?
Nota di salute e sicurezza: i liquidi residui possono essere smaltiti nel lavandino. Pulire i materiali di plastica con acqua e lasciarli asciugare.
Altre reazioni comunemente utilizzate nei pasti autoriscaldanti includono l’ossidazione del ferro, la reazione del cloruro di calcio anidro con acqua (vedi sotto) o, per il raffreddamento, la reazione di fertilizzante (nitrato di ammonio) con l’acqua.
Ulteriori esperimenti, come la creazione del vostro pacco caldo o freddo, o la determinazione del contenuto di ossigeno nell’aria con la reazione di ossidazione del ferro utilizzata in confezioni autoriscaldanti, sono descritte nel sito web LNCUw3.
Questa attività può anche divenire parte di una lezione in cui sono gli studenti a sviluppare una sceneggiatura per un programma scientifico TV, per rispondere alla domanda di uno spettatore ipotetico sulla funzione dei pasti autoriscaldanti. La versione Italiana di questo foglio di lavoro è disponibile sul sito Science in Schoolw5, quella tedesca nel sito LNCUw3.
In questa attività, gli studenti scaldano il caffè con cloruro di calcio anidro e acqua. L’attività viene bene come parte di una unità didattica sulla dissoluzione dei sali in acqua, per introdurre gli aspetti energetici di questo processo. Gli studenti dovrebbero già avere familiarità con legami ionici e covalenti. L’attività funziona con gruppi di tre studenti di 14 anni o più.
Una possibilità è quella di discutere di energia reticolare, utilizzando come esempio dalla vita quotidiana “impacchi freddi” che si basano su una reazione endotermica innescata dal piegare una lastra di metallo. L’attività seguente può quindi essere utilizzata per introdurre la nozione di energia di idratazione e per dimostrare che la reazione con la quale alcuni sali si sciolgono è una reazione esotermica.
L’attività è relativamente sicura – l’aspetto più pericoloso è la possibilità di rompere il vetro, se non viene maneggiato con cura.
Nota di sicurezza: Indossa occhiali protettivi; non bere il caffè.
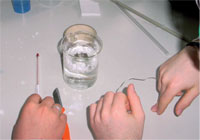
Gli studenti devono spesso affrontare due problemi: l’aggiunta di troppo poco cloruro di calcio all’acqua (più ne utilizzano, più calore verrà prodotto), e dimenticare di isolare i loro becker.
Una soluzione comune è quella di “improvvisare” una piccola vasca d’acqua mettendo acqua e cloruro di calcio in un grande becker, e fissare polistirolo intorno al becker con del nastro adesivo. Il caffè può essere poi riscaldato in un recipiente più piccolo, nella vasca d’acqua improvvisata.
Il miglior risultato nel contesto del progetto LNCU (vedi riquadro) è stato raggiunto riempiendo un piccolo becker con acqua e mettendolo in un bicchiere più grande, con uno strato di polistirolo nel mezzo come isolante. Gli studenti hanno poi messo il cloruro di calcio, a cui avevano aggiunto poca acqua, in un contenitore piccolo. Collegando ad esso un laccio e una pietra come peso, lo hanno fatto pendere in acqua. La temperatura di 50 ml di caffè è cambiata da 20 a 44 °C in meno di un minuto.
Discutete l’apparente contraddizione tra il comportamento di pacchi freddi nei precedenti esperimenti e l’esperimento che si è appena eseguito – in questo caso, il processo di soluzione non è endotermico. Nel pacchi freddi, più energia è necessaria per distruggere reticolo molecolare del sale (energia di legame) rispetto a quell ache viene rilasciata quando le molecole di acqua circondano gli ioni (energia di idratazione). L’energia occorrente viene prelevata dall’ambiente circostante, per cui la soluzione si raffredda. Nell’esperimento col caffè, al contrario, l’energia di idratazione è superiore all’energia reticolare, per cui il processo nel suo insieme è esotermico. Idratazione ed energia reticolare sono caratteristiche proprie di un sale.
Per continuare, gli studenti potrebbero tentare di raggiungere la temperatura più bassa possibile, usando il cloruro di calcio anidro, cloruro di sodio e il ghiaccio. Potrebbero restare sorpresi nello scoprire che l’aggiunta di cloruro di calcio anidro in ghiaccio (anziché acqua) non aumenta la temperatura. Questo perché i legami di idrogeno nei cristalli di ghiaccio prima devono essere rotti, il che richiede energia, per cui l’intero processo è endotermico.
Nel 2003, quattro insegnanti di chimica tedeschi hanno unito le forze per creare un portale web per condividere le loro migliori idee sull’insegnamento: Lebensnaher Chemieunterrichtw3 (LNCU, lezioni di chimica relative alla vita quotidiana). La loro collezione è cresciuta costantemente, e offre una vasta scelta di attività per tutte le fasce d’età dalla scuola primaria alla scuola secondaria superiore, che collega ai principali materie curriculari in chimica, come la tavola periodica, titolazione, aria e acqua, più biologia e fisica per i più piccoli.
I loro materiali in lingua tedesca sono disponibili liberamente scaricabili come documenti PDF e Word®, con le istruzioni per gli insegnanti e fogli di lavoro per gli studenti. Inoltre, il sito offre una serie di video sulle attività e un elenco (in tedesco e inglese) dei siti web, con idee e materiali didattici utili per l’aula di scienze.
Potete anche trovare una dimostrazione di questi pasti qui: www.mlaltd.co.uk/store
Kalogirou E, Nicas E (2010) Chimica su microscala: esperimenti per le scuole. Science in School 16: 27-32. www.scienceinschool.org/2010/issue16/microscale/italian
Questo articolo permette agli studenti di scoprire il legame tra la scienza in aula e il mondo reale. Con gli esperimenti che hanno un fattore “wow” – spesso mancante nelle lezioni pratiche – gli studenti possono competenze e costruire conoscenze.
Il principale tema affrontato è la chimica, ma l’insegnante può adattare la lezione per includere discussioni su energia da altri argomenti, ad esempio mantenere al caldo, sopravvivenza in climi freddi, il trattamento degli infortuni sportivi. Gli esperimenti potrebbero anche essere utilizzati per iniziare una discussione su come funziona la scienza.
Nick Parmar, UK