Zaključavanje omotača Understand article
Prevela Petra Korać. Grupa Winfrieda Weissenhorna iz European Molecular Biology Laboratory-a u Grenoblu, Francuska, otkrila je mogućnost obuzdavanja širokog spectra virusa – hvatanjem u njihove vlastite čahure. Istražila Claire Ainsworth.
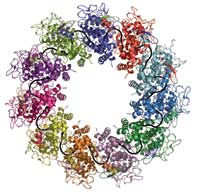
veže se za jednu molekulu RNA (crno)
kako bi stvoili kompleks
Fotografija ljubaznošću Winfried
Weissenhorn
Riječ je o bolesti koja možda izaziva najviše straha u svijetu. Jednom kada se pojave, uobičajeni simptomi – teturanje, slinjenje, strah od vode, paraliza – gotovo uvijek predkazuju smrt. Samo je pet ljudi od svih poznatih slučajeva preživjelo bjesnoću, a svi osim jednog imaju trajna neurološka oštećenja. Iako su cijepljenje i preventivne terapije nakon izlaganja bolesti drastično smanjili broj oboljelih u Europi i Sjevernoj Americi, još uvijek nema lijeka. Bijesnoća ostaje ozbiljna preijetnja u puno zemalja u razvoju, ubijajući do 70 000 ljudi svake godine.
Zabrinjavajuće, uzročnik bjesnoće i slični virusi sada se opet pojavljuju u razvijenim zemljama, šireći se među ljudima koji dolaze u kontakt sa šišmišima. Zato je otkriće Winfrieda Weissenhorna, Roba Ruigroka i njihovih kolega o načinu napada na viruse stiglo u pravi tren. Grupe, Europski laboratorij za molekularnu biologiju (European Molecular Biology Laboratory) u Grenoblu, Francuska, i susjedna Jedinica za interakciju virusa i domaćinskih stanica (Unit for Virus Host Cell Interactions) (UVHCI), su razjasnile strukturu proteina koji koji okružuje virusni genetički materijal i skriva ga od imunološkog sustava tijela dok ne dobije šansu da se umoži. Postoji mogućnost da se upotrijebe lijekovi kako bi se virusi genom ‘zaključao’ unutar ovog zaštitnog omotača i tako spriječi virusa replikacija.
Ali ovaj rad ima širu primjenu od područja same bolesti bjesnoće. Ispostavilo se da monogi drugi virusi, uključujući uzročnike ebole, Borna bolesti i boginja, imaju slične omotače za svoje genome, što znači da bi ovo otkriće moglo rasvijetliti porijeklo i razvoj takvih virusa. Virus bjesnoće, kao i nekoliko drugih virusa, stvara svoj genom iz jednog lanca RNA, molekule slične DNA koja nosi naše gene. Ali za razliku od DNA, informacija kodirana u virusnoj RNA ne može biti direktno iskorištena za stvaranje proteina potrebnih za formiranje virusa. Umjesto nje, potrebna je komplementarna kopija sekvence, nešto slično kemijskom negative fotografije. Tako virus prije nego što može stvarati proteine za svoj zaštitni omotač genoma, mora pretvoriti taj ‘negativni RNA lanac’ u ‘pozitivni’ koji se može prevesti u proteine. Isto tako, mora napraviti kopije svog genoma kako bi se umožio.

Fotografija ljubaznošću EMBL Photolab
Za virus, ovi su procesi ispunjeni opasnostima. Stanice sisavaca, uključujući ljudske stanice, sadržavaju sustave obrane koji napadaju i uništavaju stranu RNA. Zato virus skriva svoj ranjivi genom tako što ga čvrsto upakira unutra nukleokapside, ljuske koja se sastoji od proteina zvanog nukleoprotein, kako bi ga sakrio sve dok ne dođe u unutrašnjost stanice gdje otima domaćinsku staničnu mašineriju i koristi je za replikaciju i stvaranje viralnih proteina. Kako za omatanje genoma, nukleoprotein pomaže i kod kontrole ravnoteže između stvaranja proteina potrebnih za viralnu replikaciju i same replikacije jer se oboje ne može odigravati istovremeno. Na taj način nukleoprotein ima ključnu ulogu u životu virusa.
Do sada je jedini uvid koji su znanstvenici imali u način rada nukleoproteina, dolazio sa mutnih slika elektronskog mikroskopa koje su pokazivale kako molekule nukleoproteina polimeriziraju oko genoma i stvaraju nukleokapsidu, ali nisu otkrivale strukturu samog proteina. Kako bi otkrili više, Rob Ruigrok iz UVHCI i Winfried Weissenhorn su surađujući napravili kristale nukleoproteina i odredili mu strukturu koristeći X-zrake visoke gustoće dostupne na European Synchrotron Radiation Facility, također u Grenobleu. Kristali su simetrične strukture koje nakon izlaganja X-zrakama stvaraju preciznu paternu difrakcije iz koje znanstvenici mogu odgonetnuti precizan oblik molekule. Određivanjem stukture nukleoproteina istraživači će moći početi dizajnirati lijekove koji mogu ‘zaključati’ viralni genom u njegovom zaštitnom omotaču.
Projekt je započeo u Robovom labu, gdje njegova grupa od sredine 1990tih radi na nukleoproteinima većeg broja virusa s negativnim lancem RNA. Virus bjesnoće je slučajno ispao najlakši s kojim se može raditi. Aurélie Albertini, doktorant u labu, uspjela je postići da stanice kukaca u staničnoj kulturi proizode nukleoprotein virusa bjesnoće. Protein se omatao oko RNA molekula stanica domaćina, stvarajući prstenove koji se sastoje od 9-13 proteinskih molekula. Grupa Roba Ruigroka već je ranije uvidjela da se te strukture ponašaju kao mijaturne nukleokapside, a studije napravljene elektronskoom mikroskopijom pružile su grubu sliku njihove strukture koja je otkrila da oni nalikuju nukleoproteinu virusa bjesnoće i zato mogu biti korišteni za studije o strukturi nukleoproteina smotanog oko RNA.
Fotografija ljubaznošću Winfried Weissenhorn
T
Aurélie je započela istraživati stvaranje nukleoprotein-RNA kristala, projekt kojem se kasnije pridružila Amy Wernimont, postdoktorand u Winfriedovom labu. Ali molekule se nisu ponašale jednostavno pa su se i Aurélie i Amy dugo vremena mučile kako bi dobile kristale koji će omogućiti Amy određivanje strukture rezolucije 4 Ångströma, koja je dovoljno oštra da bi se razaznalo kako se protein smotava, ali ne i dovoljno oštra da se odredi sekvenca amino kiselina, individulanih jedinica od kojih je građen protein. Jedan od problema je bio to što su stanice s kojima je radila proizvodile vrlo malu količinu nukleoproteina.
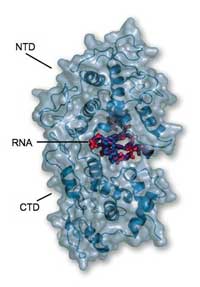
otkriva da je RNA potpuno
stegnuta u spoju NTDa (gore)i
CTDa (dolje ) i tako nedostupna
razgradnji od strane enzima ili
polimeraze domaćina
Image courtesy of Winfried
Weissenhorn
Srećom, uređaj Josan Márquez koji omogućava detaljnu sliku kristalizacije, bilo je pri ruci da pomogne riješiti problem koristeći samo malene uzorke proteina. “Kristalizacijska robotika je bila apsolutno predivna,” prisjeća se Winfried. “da su nam trebali veliki uzorci, ne bismo bili u mogućnosti potražiti točne uvjete kristalizacije.” Grupa je naposlijetku pronašla točne uvjete, precizno odredila koncentraciju proteina i kompleksnu smjesu kemikalija potrebnih za kristalizaciju te naposlijetku uspjela sve to podesiti kako bi dobila rezoluciju 3.5 Ångströma – dovoljno da konstruira detaljni model strukture proteina. Pomogao je i Raimond Ravelli koji je sudjelovao u sakupljanju podataka, prilagođavanju vremenskog intervala izlaganju X-zrakama kako bi se dobili najbolji rezultati i konstantnim savjetovanjem u različitim stadijima istraživanja strukture proteina.
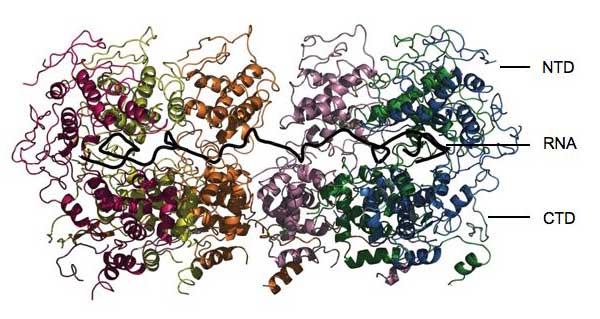
Rezultati su otkrili da se protein potpuno sklapa oko RNA, ‘zaključavajući’ je tako kao obiteljski nakit u sefu banke. “Nije dostupna niti za jedan drugi enzim koji bi je mogao napasti”, kaže Winfried. Protein se sastoji od dva glavna funkcionalna dijela ili domene. Jedna, koja se zove CTD, ugnježdava jednu stranu RNA i drži se CTDa ostalih molekula nukleoproteina, pomažući tako stvaranje kukuljice u obliku heliksa. Druga domena, NTD, sjeda na drugi dio RNA i ne stvara značajan kontakt s ostalim nukleoproteinima. Konačna struktura podsjeća na stezaljku koja je stisnuta oko RNA i zadržava sve ostalo vani. “Nukleoprotein će spriječiti da RNA bude prepoznata od urođenog imunološkog sustava”, kaže Winfried. “Ali kako onda postaje dostupna za replikaciju i translaciju?”
Odgovor leži u dvije strukture nalik ovojima koje vire iz svake domene. One mogu raditi kao zglobovi, zanjihati NTD regiju prema gore i savinuti nukleoproteinsku stezaljku tako da se otvori omogućavajući viralnim enzimima pristup do malih dijelova genoma. Moguće je da je uključen i jedan specifičan enzim, fosfoprotein P. On veže RNA polimerazu, enzim potreban za umnažanje genoma, za nucleoprotein i može se vezati za jedan od zglobova kako bi odmaknuo NTD.
Ovakav mehnizam zgloba ukazuje na mogućnost napadanja virusa kao što je uzročnik bjesnoće, lijekovima koji bi mu onemogućavali rad. “Ukoliko je naš koncept o otvaranju točan, mogli bismo ga blokirati da ostane zatvoren,” kaže Winfried. “To bi zaustavilo viralnu replikaciju.” Zaključan u unutrašnjosti svoje proteinske kolijevke, viralni genom bi bio nemoćan i na kraju bi ga stanica uklonila. Idući korak prema navedenim lijekovima bio bi sistematično traženje malih kemikalija koje se mogu vezati za regiju zgloba i tako sprečavati otvaranje nukleokapside.
Winfried objašnjava da bi ovakvo otkriće moglo pridonijeti i razjašnjenju evolucije virusa s negativnim lancem RNA. Vrste virusa iste skupine mogu imati jako različite sekvence genoma, što otežava zaključivanje o njihovoj povijesti evolucije na temelju samo usporedbe sekvenci. Strukture su, s druge strane, potpuno druga priča. Ista fizička strukura može biti izgrađena iz različitih gena i amino-kiselinskih slijedova. Pa tako, iako geni evolviraju i dramatično se izmijene, strukture za koje kodiraju mogu otkriti duboke evolucijske veze među virusima.
Slike elektronske mikroskopije koje prikazuju RNA molekule ostalih virusa s negativnim lancem RNA, Marburg virus i kristalna struktura Borna virusa, sugeriraju da njihovi nukleoproteini imaju slične strukture temeljene na principu zgloba i stezaljke. To ukazje da ovi virusi koriste taktiku sličnu onoj uzročnika bjesnoće, kako bi zaštitili svoju RNA, pa bi isto tako mogli biti napadnuti lijekovima koji zatvaraju njihove kukuljice. To također ukazuje da dijele istog pretka, objašnjava Winfried. “Iz analize sekvence ne biste pomislil da pripadaju istoj skupini, dodaje. “Mislim da je vjerojatno postojao neki predak nukleopkapside koji se kasnije mijenjao kako su virusi evoluirali da bi mogli napadati različite vrste stanica.”
Resources
- Istraživanje opisano u ovom članku objavljno je kao
- Albertini AA, Wernimont AK, Muziol T, Ravelli RB, Clapier CR, Schoehn G, Weissenhorn W, Ruigrok RW (2006) Kristalna struktura kompleksa nukleoprotein-RNA virusa bjesnoće. Science 313: 360-363.
- Da biste saznali više o radu Winfrieda Weissenhorna i Roba Ruigroka, pogledajte www2.ujf-grenoble.fr/pharmacie/laboratoires/gdrviro/
Institutions
Review
Ovaj člnak opisuje prirodu znanstvenog istraživanja kao kontinuiranog, dinamičkog entiteta. Kako je svaka molekularna tajna životnog ciklusa čak i najjednostavnijih organizama otkrivena sofisticiranim tehnologijama, pojavljuju se odjeci u napredku medicinskih postupaka i kontrole bolesti.
Marie Walsh, Irska





