Lentement mais sûrement : un nouveau matériau prometteur pour les médicaments à action prolongée. Understand article
Le texte ci-dessous est une adaptation d'un article ILL
Des scientifiques ont mis au point un système moléculaire pour l’administration continue d'un médicament anti-VIH.

Vous souvenez-vous de la dernière fois que vous avez pris un médicament ? Il était très probablement sous forme de pilule. Mais que devient ce médicament dans votre corps après que vous l’ayez avalé ?
Une fois que la pilule arrive dans votre estomac, elle est décomposée pour libérer les molécules médicalement actives qui soigneront votre maladie. Ces molécules traversent les parois de votre estomac et rejoignent votre système sanguin. Le sang les transporte ensuite dans votre corps afin que le médicament atteigne le ou les organes où il est nécessaire.
Au début, la concentration du médicament dans votre sang augmentera. Avec le temps, le médicament sera progressivement décomposé par votre corps, puis éliminé, ce qui signifie que ses niveaux diminueront de nouveau. Vous pouvez visualiser cette augmentation et cette diminution sur la figure 1.
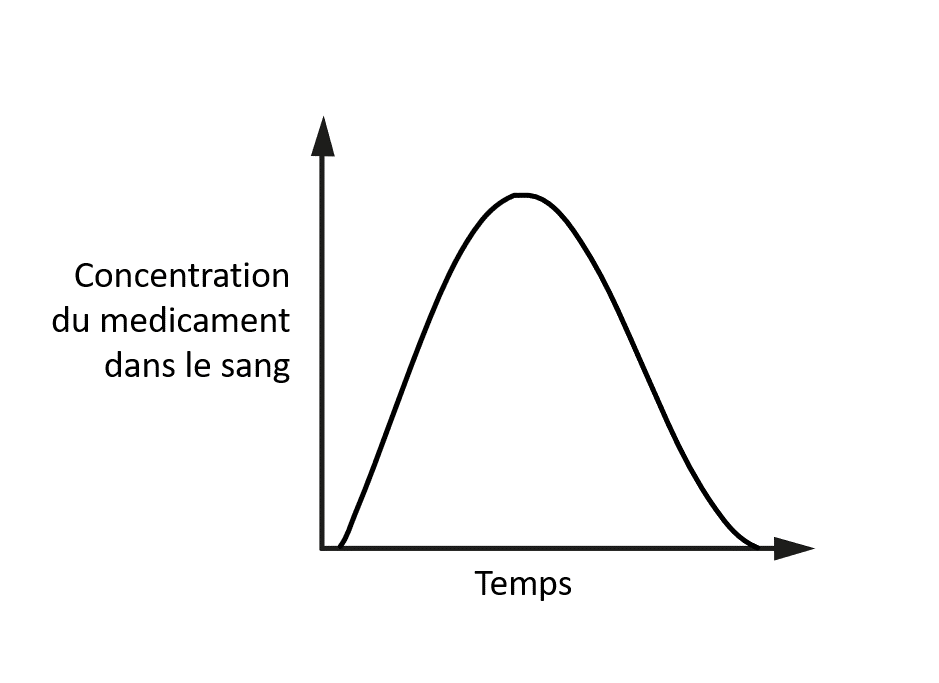
Image reproduite avec l’aimable autorisation de l’auteur.
Lorsque sa concentration dans le sang tombe en dessous d’un certain niveau, le médicament n’est plus efficace. Cependant, il faut aussi éviter des concentrations trop élevées, car les médicaments peuvent également avoir des effets secondaires nocifs. Par exemple, le paracétamol, utilisé pour traiter la douleur et la fièvre, peut endommager le foie à fortes doses. Il est donc crucial de bien contrôler la concentration du médicament dans le sang.
Il existe une plage de dosage spécifique correspondant à une quantité de médicament suffisamment élevée pour traiter votre maladie, mais pas assez pour nuire à votre corps. Cette plage est connue sous le nom de « fenêtre thérapeutique » (voir figure 2). Si l’on se souvient que les concentrations du médicament augmentent puis diminuent après la prise d’une pilule, comme décrit précédemment, on constate que les concentrations sanguines du médicament ne restent dans la fenêtre thérapeutique que pendant une durée assez courte.
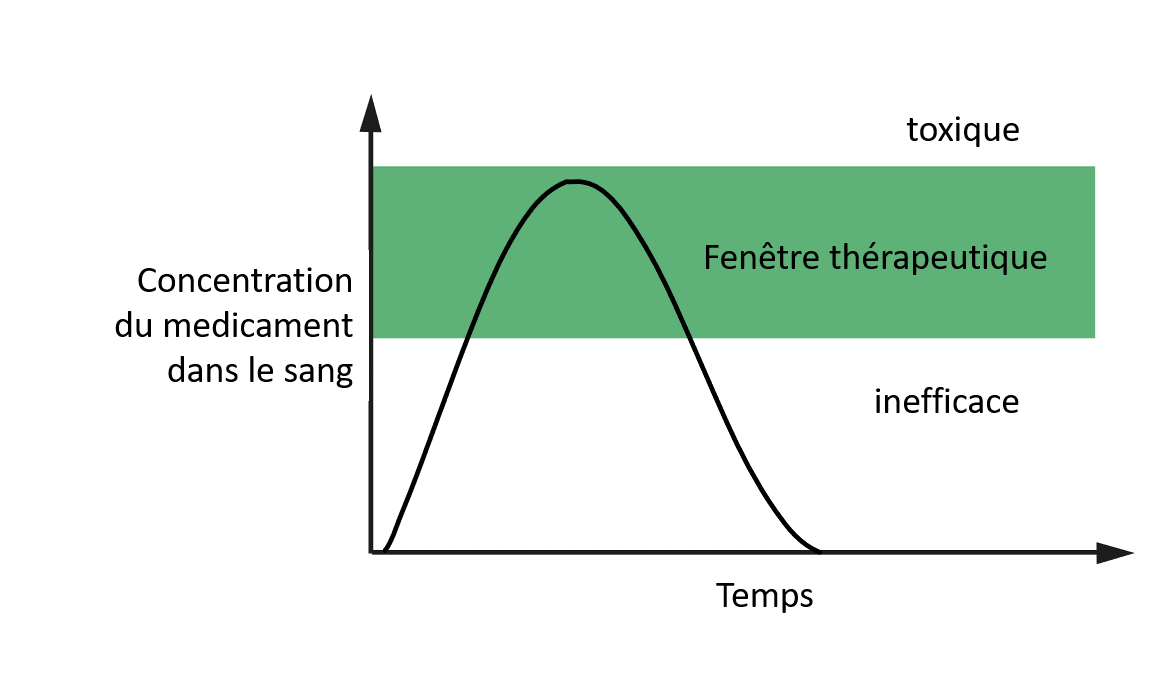
Image reproduite avec l’aimable autorisation de l’auteur.
Une question cruciale est : comment prolonger la période pendant laquelle le niveau du médicament reste dans la fenêtre thérapeutique afin de traiter la maladie plus longtemps ?
Il existe deux options : vous pouvez prendre une dose plus élevée du médicament, ou vous pouvez le prendre fréquemment. Cela donnera lieu à des concentrations du médicament dans le sang comme celles présentées à la figure 3. Cependant, une dose unique importante peut augmenter les concentrations sanguines du médicament jusqu’à son niveau toxique, et la nécessité de prendre des doses répétées peut facilement entraîner des oublis de prises du médicament.
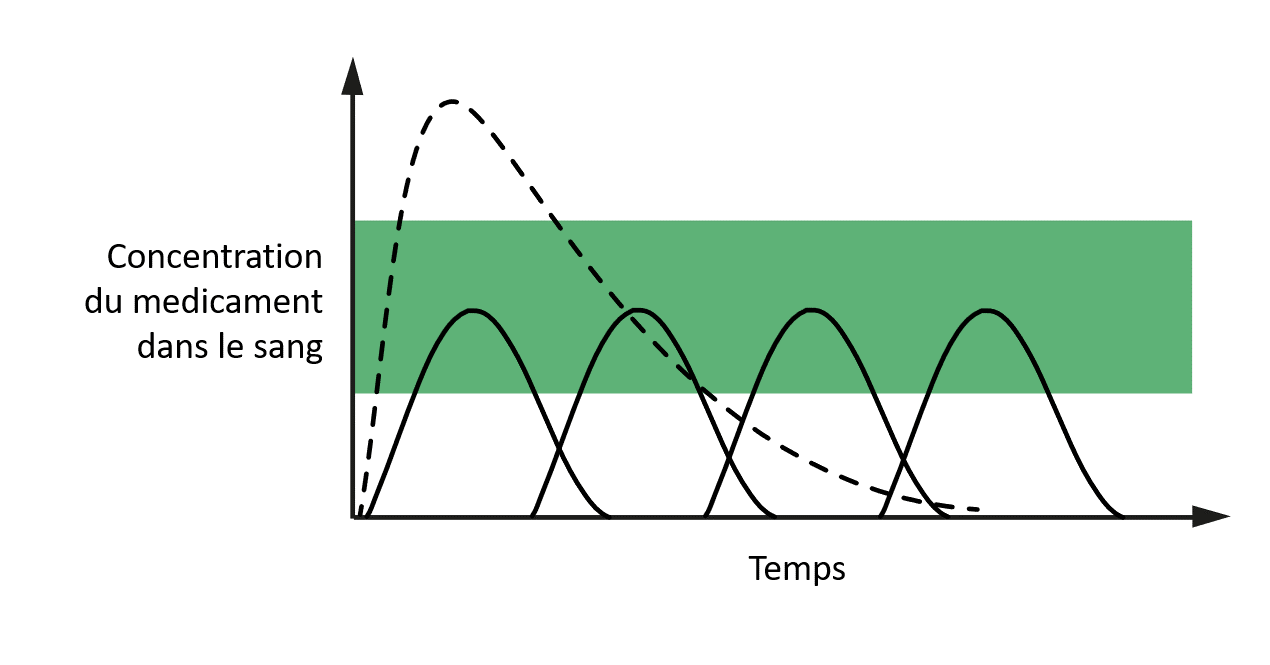
Image reproduite avec l’aimable autorisation de l’auteur.
Pour les personnes infectées par le virus de l’immunodéficience humaine (VIH), qui peut causer le syndrome d’immunodéficience acquise (SIDA), c’est un défi particulier : pour maintenir le virus sous contrôle, il est très important de conserver le niveau de médicament dans la fenêtre thérapeutique en permanence. Cela signifie que les patients atteints du VIH doivent prendre des comprimés chaque jour. Tout le monde n’est pas capable de suivre un planning de traitement aussi strict, ce qui peut affecter l’efficacité du traitement et avoir de graves conséquences sur leur santé.
Une solution idéale à ce problème serait un système d’administration capable de libérer un traitement anti-VIH dans le sang de manière lente et continue (figure 4).
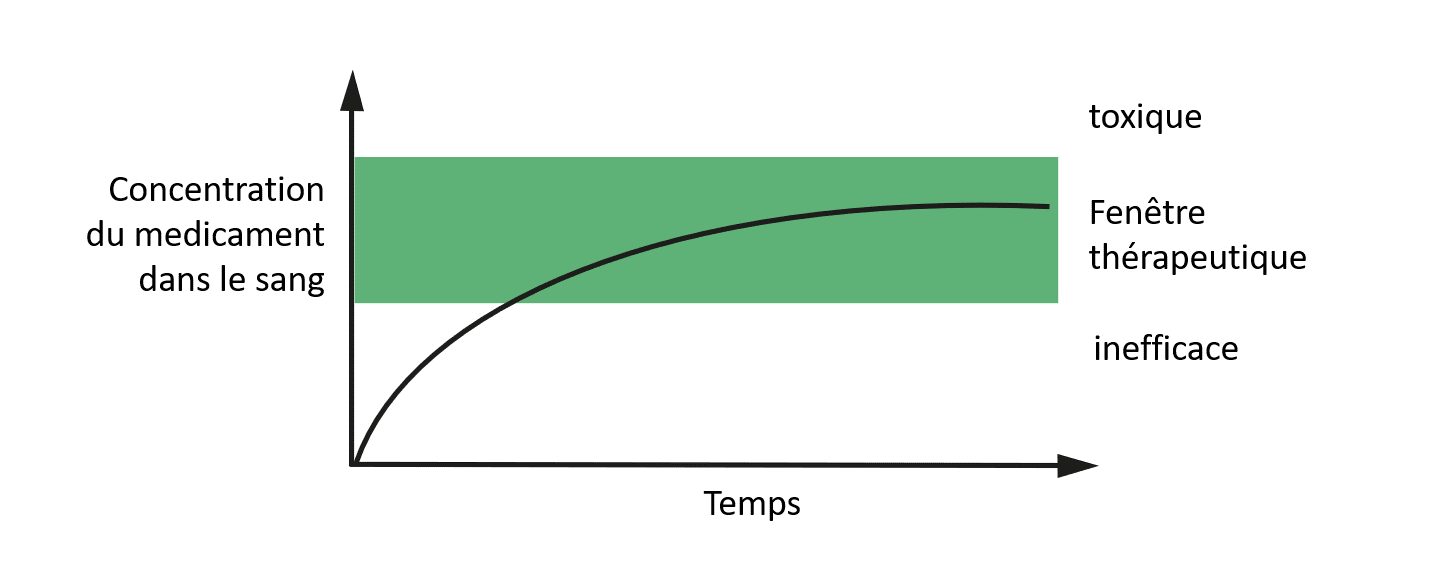
Image reproduite avec l’aimable autorisation de l’auteur.
Par le passé, des scientifiques ont développé des systèmes d’administration basés sur des peptides (de courtes chaînes composées d’acides aminés). Les peptides contenant le médicament sont injectés sous la peau, où des enzymes les agencent en une réserve moléculaire sous la forme d’un hydrogel, qui est un maillage de peptides contenant de l’eau. Le médicament est ensuite libéré lentement à partir de cet hydrogel. Malheureusement, ces peptides sont dégradés assez rapidement par les enzymes du corps humain (figure 5, formes jaunes). Pour améliorer ces systèmes d’administration, des scientifiques ont conçu un nouveau type d’hydrogel, fait d’un mélange de peptides et de peptoïdes (des molécules de synthèse qui ressemblent aux peptides, mais qui ont un groupe chimique différent à la place du proton sur l’atome d’azote dans la liaison peptidique). L’un des avantages des peptoïdes est qu’ils sont moins bien reconnus par les enzymes qui dégradent les peptides ; les peptoïdes sont ainsi plus stables dans le corps (figure 5, à droite).
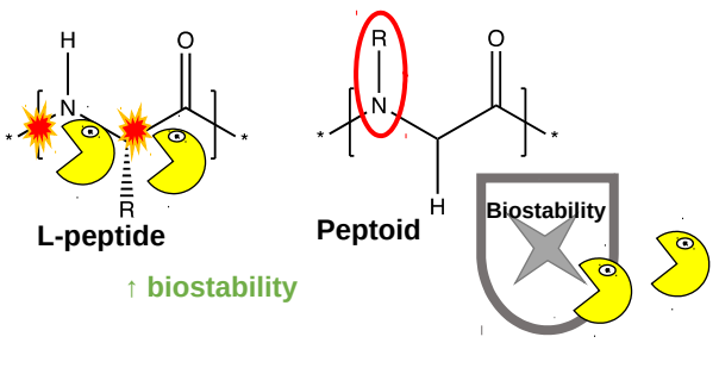
Image adaptée de la Réf. [1]
Les structures peptoïde-peptide nouvellement développées sont d’abord liées à un médicament anti-VIH (la zidovudine, ou AZT en abrégé) puis modifiées chimiquement pour contenir un groupe phosphate. Ce groupe empêche la formation d’un réseau de gel jusqu’à ce que le système peptoïde-peptide soit injecté sous la peau, où des enzymes phosphatases enlèvent le groupe diphosphate, provoquant une rapide formation du gel. Le réseau de gel est ensuite progressivement hydrolysé au fil du temps, libérant le médicament lentement et de manière continue dans la circulation sanguine (figure 6).
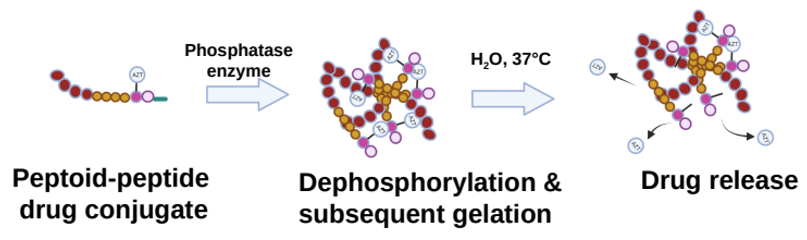
Image adaptée de la Réf. [1]
Pour une libération optimale et un bon dosage de l’AZT, il est essentiel de comprendre la structure microscopique des hydrogels. Pour cela, des images détaillées des hydrogels ont d’abord été obtenues à l’aide de techniques de microscopie à haute résolution (figure 7). Ces images montrent que les hydrogels sont constitués d’un réseau tridimensionnel de fibres peptoïdes, similaire à une éponge.

Image adaptée de la Réf. [1]
Alors que la microscopie ne donne qu’un aperçu d’une seule échelle de longueur des hydrogels, d’autres techniques peuvent fournir des informations détaillées sur plusieurs échelles de longueur simultanément. Une de ces techniques est la diffusion de neutrons aux petits angles (DNPA, SANS en anglais).
Les neutrons dans la recherche
Les neutrons sont des particules que l’on trouve généralement à l’intérieur des noyaux atomiques. Pour les expériences (comme celles de SANS), des neutrons libres doivent être produits dans des sources de spallation spécialisées ou dans des réacteurs nucléaires de recherche. L’un de ces réacteurs est situé à l’Institut Laue-Langevin (ILL) à Grenoble, en France.

© A. Chezière/ILL
Les neutrons produits par le réacteur nucléaire de l’ILL permettent de sonder la matière et d’étudier de petits échantillons de matériaux. Grâce à leurs propriétés spécifiques, ils permettent d’obtenir des informations qu’il est souvent impossible d’acquérir avec d’autres techniques. Les neutrons interagissent avec les noyaux de la matière. En observant comment ils sont déviés et comment leur vitesse change, il est possible d’obtenir des informations précises sur la position et le mouvement de ces noyaux. À l’aide d’instruments spécialisés, des faisceaux de neutrons sont dirigés vers des échantillons, ici : les hydrogels. Ces échantillons diffusent une partie des neutrons, qui sont ensuite enregistrés par un détecteur spécial. En analysant le nombre de neutrons diffusés sous différents angles, les chercheurs peuvent comprendre la structure moléculaire et les propriétés des échantillons. Un avantage clé de cette technique est la forte interaction des neutrons avec l’hydrogène, et leur faible interaction avec son isotope, le deutérium (« hydrogène lourd »). Remplacer une partie de l’hydrogène d’un échantillon par du deutérium permet de mettre en évidence certaines parties de l’échantillon pour des études encore plus détaillées.
La technique SANS a montré que la structure moléculaire des hydrogels de peptoïdes reste identique, qu’ils contiennent ou non de l’AZT. Cela signifie que les propriétés des fibres sont plus déterminantes pour la structure du réseau que la présence du médicament – et que la présence de ce dernier ne perturbe pas la structure du réseau.
Les nouveaux hydrogels de peptoïdes se sont révélés capables de libérer de l’AZT sur une période de 28 jours en laboratoire. Des expériences supplémentaires sur un modèle animal ont démontré que le médicament était absorbé en quantités cliniquement pertinentes sur 35 jours. Ces résultats confirment que les hydrogels constituent une excellente solution pour le développement de systèmes d’administration de médicaments à action prolongée. De plus, ce système pourrait être tout aussi efficace pour traiter d’autres maladies – comme le cancer, le paludisme ou la tuberculose – avec l’avantage majeur d’être en mesure de cibler des zones du corps souvent difficiles d’accès, telles que les yeux ou le système nerveux central.
Remerciements
Ce travail a été mené par des chercheurs de l’université Queen’s de Belfast, avec le soutien financier du Wellcome Trust et du Conseil de la recherche en ingénierie et en sciences physiques (EPSRC) du Royaume-Uni.
References
[1] Coutler SM et al. (2024) In Situ Forming, Enzyme-Responsive Peptoid-Peptide Hydrogels: An Advanced Long-Acting Injectable Drug Delivery System. Journal of the American Chemical Society 146: 401–21 416. doi: 10.1021/jacs.4c03751
Resources
- En savoir plus sur l’Institut Laue-Langevin
- vous pouvez trouver des ressources pédagogiques inspirantes pour la physique des particules sur le site Accelerate Your Teaching : Lewis J (2024) Accelerate your teaching with links to cutting-edge science. Science in School 67.
- Construisez un canon de Gauss pour modéliser l’accélération linéaire et la spallation : Lewis J, Michalak L (2024) Build a linear accelerator model. Science in School 67.
- Essayez quelques activités pour trouver et en apprendre davantage sur les accélérateurs de particules près de chez vous : Lewis J, Darve C (2024) Accelerators are everywhere, perhaps closer than you think…. Science in School 69.
- Essayez ce jeu de rôle pour enseigner la transmission synaptique à vos élèves : Andersen-Gassner M, Möller A (2023) Hold your nerve: acting out chemical synaptic transmission. Science in School 63.
- Découvrez comment les physiciens étudient les objets très petits et très grands : Akhobadze K (2021) Exploring the universe: from very small to very large. Science in School 55.
- Essayez ce jeu de rôle pour comprendre comment les projets de recherche sont financés et l’importance de la recherche fondamentale : McHugh M et al. (2022) What is it good for? Basic versus applied research. Science in School 55.
- La connaissance des bactéries magnétique pourrait guider la recherche sur les nanorobots médicaux : ILL (2020) Insights into magnetic bacteria may guide research into medical nanorobots. Science in School 51.
- Renseignez-vous sur l’importance de l’utilisation des animaux dans la recherche et sur les approches de pointe pour la minimiser : Schmerbeck S et al. (2021) Organ-on-chip systems and the 3Rs. Science in School 54.
- Découvrez l’utilisation des faisceaux de protons pour la thérapie du cancer : Welsch CP (2021) Death Star or cancer tumour: proton torpedoes reach the target. Science in School 55.
- Découvrez comment les anticorps de chameaux pourraient révolutionner la science médicale : Hammarén M (2024) Inspired by camelids: nanobodies are a magnificent molecular velcro. Science in School 70.
- Découvrez comment les rayons cosmiques provenant de l’espace peuvent affecter les appareils électroniques sur Terre : ILL (2023) What does particle physics have to do with aviation safety? Science in School 62.





