Expériences de chimie avec des champignons Teach article
Combien de produits chimiques y a-t-il dans un champignon frais ? Il est facile de la savoir en étudiant la chimie des aliments naturels.
Notre corps et tout ce qui nous entoure est fait de substances chimiques, qui interagissent pour nous maintenir en vie. Et pourtant, bien des gens ne le croient pas, et considèrent la chimie comme opposée à la nature, et même comme une source de dangers à éviter. Il arrive qu’on trouve des aliments dont l’étiquette précise qu’ils sont “sans produits chimiques”, comme s’ils n’étaient pas constitués d’atomes et de molécules.
Cette affirmation résulte d’une incompréhension de la réalité, et elle peut conduire à des décisions erronées. Dans les articles que nous consacrons aux “expériences naturelles”(voir Höfer, 2017), nous analysons des aliments en utilisant des méthodes chimiques. Ceci démontre que ces aliments contiennent des substances qui appartiennent au monde de la chimie.

Skeeze/pixabay.com
La chimie des champignons
Comme l’alimentation fait partie de notre vie, elle permet de relier la chimie et la vie quotidienne. Les champignons en sont un bon exemple, car ils contiennent des substances faciles à identifier. Ceci peut surprendre les élèves, dont la connaissance en matière de champignons est assez fragmentaire. Ces substances sont principalement des hydrates de carbone, des graisses et des protéines. Mais on y trouve aussi des constituants mineurs, comme les vitamines et les substances minérales, que les étudiants découvriront par eux-mêmes.
Les expériences qui suivent portent sur des tests de chimie habituels qui sont pour une fois appliqués aux champignons comestibles. Elles sont adaptées aux classes secondaires, et peuvent être exécutées par les élèves en moins d’une heure. Les maîtres auront besoin de plus de temps pour préparer le matériel utilisé dans les expériences 2 et 3.

reproducteur d’un
champignon cultié
U.S. Department of
Agriculture/Flickr
La nature des champignons.
Les champignons ne sont ni des plantes ni des animaux. Ils forment un royaume taxonomique à part. Ce sont des organismes eucaryotes, ce qui les distingue des bactéries. Comme les plantes, ils absorbent leur nourriture à partir de l’environnement par osmose. Mais leur structure et leur mode de reproduction leur sont propres. Comme les animaux, les champignons sont des organismes hétérotrophiques : ils ont besoin de se procurer de la nourriture et ne peuvent pas la fabriquer eux-mêmes. Leurs cellules constituantes forment un réseau de fibres cachées dans le sol, le mycélium, qui captent la nourriture. La partie extérieure et visible du champignon est parfois comestible. Voir la figure 1.
Au niveau nutritionnel, les champignons ont une grande valeur. Mais en plus, ils nous apportent du sodium et du potassium responsables de l’équilibre aqueux de l’organsime, et des ions phosphate nécessaires aux os et aux dents ; et de la vitamnine C, qui est un agent protecteur des cellules et une aide pour l’incorporation du fer.
Dans les expériences qui suivent, nous utilisons la variété Agaricus bisporus, vendue fraiche ou séchée sous le nom de “champignon de Paris”. En terme culinaire, ces champignons sont parfois appelés champignons boutons ou portobello s’ils sont mûrs et brunis.
Note de sécurité
Les étudiants doivent porter des lunettes de protection, et observer les précautions de sécurité habituelles quand ils effectuent les expériences qui suivent, car certains réactifs sont corrosifs voire nocifs. Voir aussi general safety note sur le site de Science in School.
Expérience 1. Recherche des protéines
Compter environ 5 minutes pour le test du biuret et 10 pour celui à la ninhydrine.
Matériel
- Solution d’hydroxyde de sodium (1 mol/l)
- Solution de sulfate de cuivre (1 mol/l)
- Solution de ninhydrine (2% masse)
- Champignons de Paris frais, à raison d’un champignon par étudiant ou groupe d’étudiants
- Un verre de montre
- Couteau (pas trop aiguisé)
- De petites pipettes
- Des pincettes
Mode opératoire
Les protéines peuvent être détectées par les tests du biuret et celui à la ninhydrine. Ces deux tests vont être décrits séparément.
Réactions du biuret
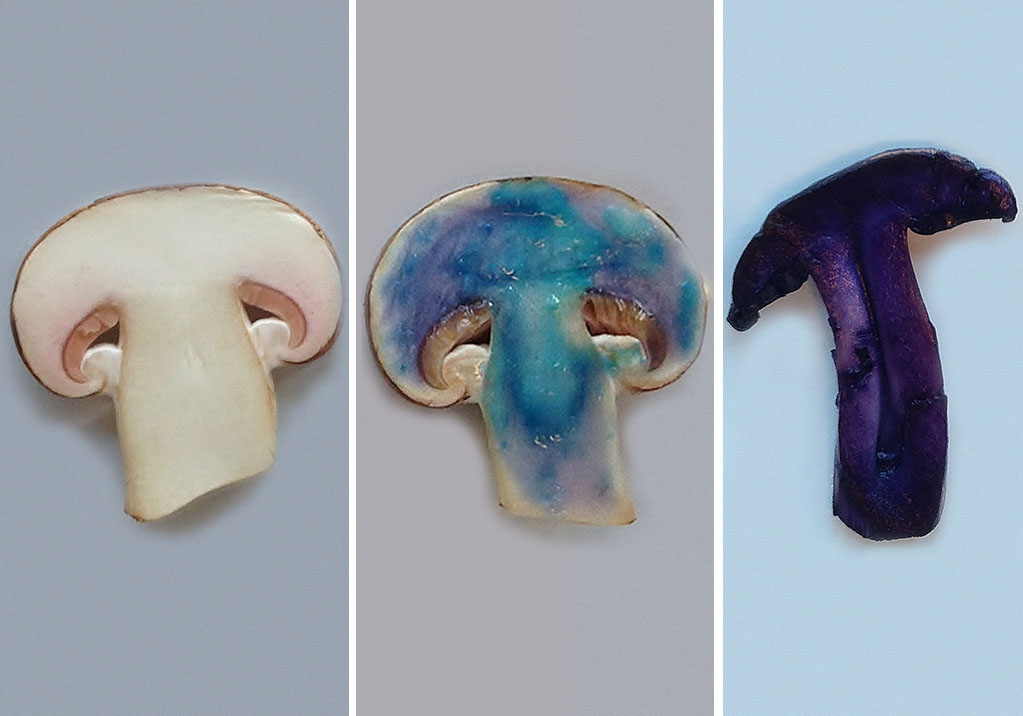
- Couper un champignon en deux (voir Fig.2, à gauche)
- Recouvrir la tranche du champignon d’une fine couche d’hydroxyde de sodium, à l’aide de la pipette
- Déposer une goutte de solution de sulfate de cuivre sur le champignon.
En présence de protéines, la couleur change du bleu clair (couleur du sulfate de cuivre) au bleu foncé ou au violet, Voir Fig. 2, au milieu. Ce changement de couleur est dû à la formation d’un complexe entre le cuivre et la protéine.
Réaction de la ninhydrine
- Déposer une fine tranche de champignon sur un verre de montre
- Déposer une goutte de solution de ninhydrine sur le champignon
- Saisir la tranche de champignon avec une pince et la porter un instant dans la flamme calme d’un bec Bunsen.
- Retirer le champignon de la flamme. Observer sa couleur
En présence de protéines, il se forme un composé violet, dit pourpre de Ruhemann (Voir Fig.2, à droite). Ce colorant se forme par la réaction de la ninhydrine et d’un acide aminé.
Expérience 2 : Recherche de la vitamine C.
Durée : environ 15 minutes. Mais il faut 45 minutes au maître pour préparer les papiers filtre au chlorure de fer(III). Pour cela, tremper le papier filtre dans une solution de chlorure de fer(III) à 1%. Laisser sécher (env. 30 minutes)
Matériel
Chaque élève ou groupe d’élèves a besoin de :
- Une solution d’hexacyanoferrate(III) de potassium (1% masse) dans un pulvérisateur
- Un papier filtre imbibé de chlorure de fer(III) et séché
- Un champignon frais
- Un couteau (pas trop aiguisé)
- Une hotte ventilée
Mode opératoire
- Couper un champignon en deux, et presser la face ainsi coupée contre un papier filtre (voir Fig.3, à gauche)
- Enlever le champignon. En travaillant sous ventilation, pulvériser le papier filtre avec une solution d’hexacyanoferrate(III) de potassium. Ne pas respirer les vapeurs
La solution d’hexacyanoferrate(III) de potassium forme du bleu de Turnbull sur le papier, ce qui bleuit un peu le papier. Mais en présence de vitamine C, le fer(III) est réduit en fer(II) ce qui forme du Bleu de Prusse, qui est beaucoup plus foncé. Voir Figure 3, à droite.

Farina Bunies
Expérience 3. Recherche du potassium et du sodium
Durée : environ 10 minutes. Les champignons doivent avoir été coupés en tranches et séchés une nuit dans une étuve à 105°C
Le potassium et le sodium peuvent être détectés par leur couleur de flamme. L’emploi d’un verre de cobalt élimine la couleur jaune du sodium et rend visible la flamme rose pâle du potassium
Matériel
- Des champignons séchès
- Un bec Bunsen
- Une pince métallique
- Un verre au cobalt, ou un autre filtre bleu
Mode opératoire
- Tenir une tranche de champignon sec avec une pince métallique et l’introduire dans la flamme non lumineuse d’un bec Bunsen
- Observer la flamme. Sa couleur jaune orange indique la présence de sodium. Mais elle cache la couleur rose du potassium.
- Pour voir mieux cette couleur rose, observer la flamme à travers le verre de cobalt, ce qui arrête la flamme jaune du sodium

Farina Bunjes
Expérience 4. Recherche des ions phosphate
Durée : 45 minutes, dont 30 minutes pour la préparation des cendres. Le maître aura aussi besoin de 15 minutes pour préparer la solution de heptamolybdate d’ammonium.
Matériel
Pour faire la solution de heptamolybdate d’ammonium ((NH4)6Mo7O24), il faut disposer de :
- 10 g molybdate d’ammonium tetrahydraté
- 20 g nitrate d’ammonium
- 7 mL d’ammoniaque concentrée, 25% en masse
- De l’eau distillée
- Un jaugé de 100 mL
- Une pipette
Pour faire l’expérience, chaque élève (ou groupe d’élèves) a besoin de :
- Eau distillée
- Quelques tranches de champignons séchés
- De l’acide nitrique 2 mol/L
- Un creuset en procelaine
- Un mortier pour broyer les poudres
- Un bec Bunsen
- Du papier filter et un entonnoir
- Des tubes à essais sur un ratelier
- Une pipette
- Du papier indicateur de pH

obtenues en brûlant des
champignons secs
Farina Bunjes
Mode opératoire.
Avant la leçon, le maître doit préparer la solution de heptamolybdate : Mettre 10 g de heptamolybdate d’ammonium tétrahydraté (NH4)2MoO4 et 20 g de nitrate d’ammonium dans le jaugé de 100 mL. Ajouter 7 mL d’ammoniaque concentrée avec une pipette, et remplir le jaugé d’eau distillée jusqu’au trait de jauge de 100 mL, en agitant pour tout dissoudre.
La suite est à exécuter par les élèves.
- Placer une tranche de champignon sec dans un creuset de porcelaine. L’écraser au maximum, puis brûler le tout avec la flamme non lumineuse du bec Bunsen jusqu’à obtenir des cendres
- Dissoudre les cendres dans 10 mL d’eau distillée. Filtrer la solution pour éliminer le résidu insoluble. Récolter le filtrat.
- Y ajouter goutte à goutte de l’acide nitrique pour que le pH soit < 6. Noter que cette solution acidifiée sera utile pour cette expérience et pour la suivante.
- Transférer à la pipette 5 mL de la solution acidifiée dans un tube à essais. Ajouter environ 10 gouttes de la solution de heptamolybdate d’ammonium en utilisant une autre pipette.
- Chauffer la solution deux minutes avec un bec Bunsen, et laisser refroidir le tube dans le ratelier
Si la solution contenait un phosphate, un précipité jaune de phosphomolybdate ((NH4)3PMo12O40) se formera. Voir Fig. 5

Farina Bunjes
Expérience 5. Recherche des ions chlorure.
Durée : environ 5 minutes
Matériel.
laiteux de chlorure d’argent
dans la solution des cendres
de champignon, indiquant la
présence d’ions chlorure
Farina Bunjes
- Solution acidifiée de cendres de champignon, issue de l’Expérience 4.
- Solution de nitrate d’argent (5% masse)
- Un tube à essais
- Une pipette
Mode opératoire
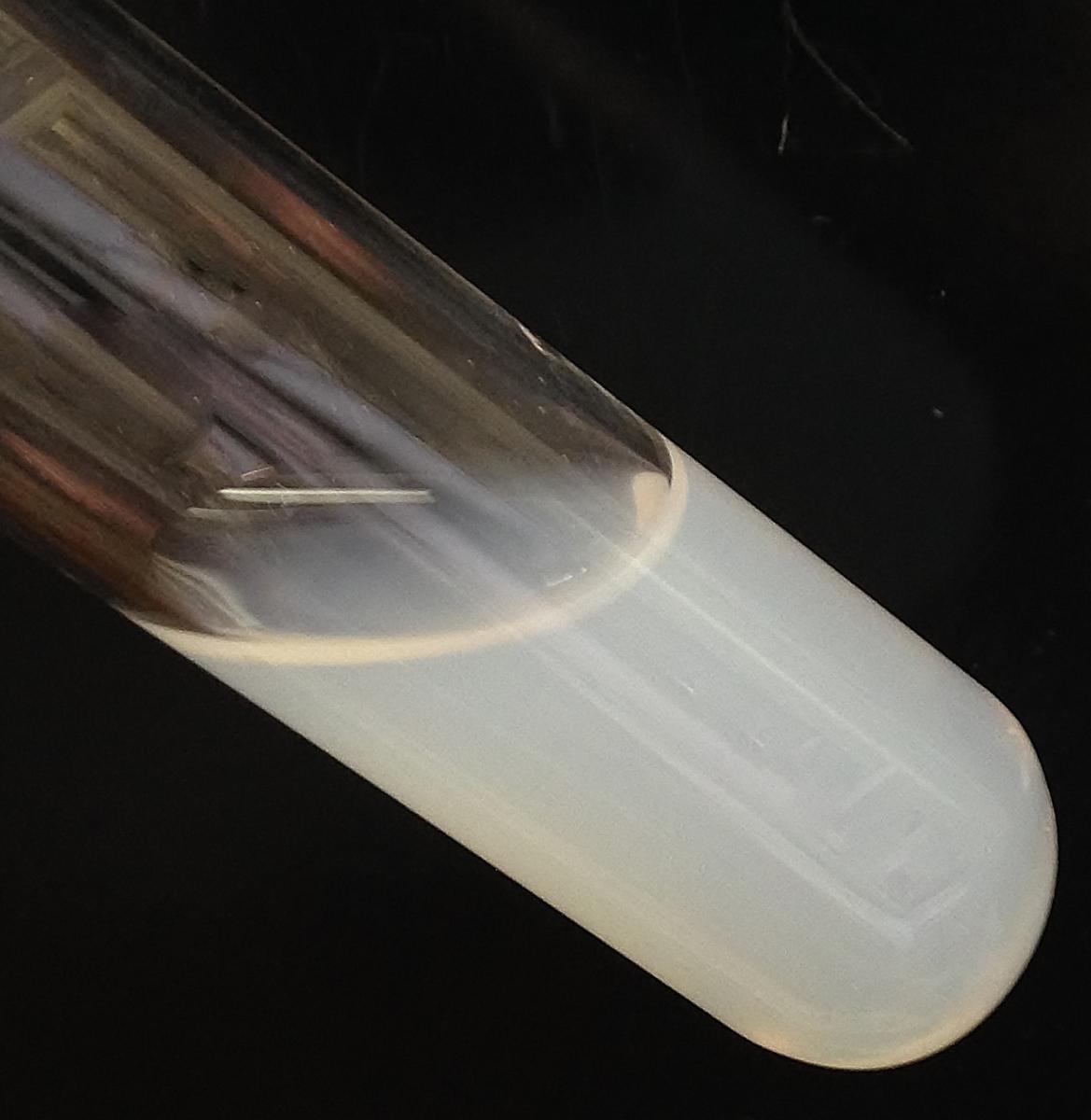
- Mettre 3 – 5 mL de la solution acidifiée dans un tube à essais
- Ajouter quelques gouttes de solution de nitrate d’argent à la pipette.
Un précipité blanc indique la présence des ions chlorure. Voir figure 6. Comme le précipité de chlorure d’argent AgCl est très dispersé, le liquide prend une apparence laiteuse.
Discussion
Ces expériences permettent aux élèves d’identifier certains constituants nutritifs des champignons. Ceci leur fournit une base pour discuter certains aspects de la chimie en rapport avec la vie quotidienne. Par exemple :
- Comment répondriez-vous à quelqu’un qui vous dirait qu’il préfère de la nourriture sans produits chimiques ?
- Est-ce que les champignons fournissent un régime équilibré ?
- Quelle expérience permettrait de montrer la différence entre les plantes et les champignons ? On rappellera que les plantes peuvent effectuer la photosynthèse, mais pas les champignons.
- Nous n’avons pas testé la présence de glucose et d’amidon. Pensez-vous que nous en aurions trouvé, si on avait fait le test.
Constitution des champignons de culture
L’information qui suit peut être utile aux maâitres qui voudraient developer une discussion à la fin des experiences.
Hydrates de carbone.
L’amidon est absent des champignons de culture, et le glucose y est très rare. La membrane des champignons est constituée de chitine et de cellulose. Leurs cellules contiennent aussi les sucres trehalose et mannitol
Graisses
100 g de champignons contiennent 0.3 g de graisse, ce qui est très peu. Ces lipides se trouvent sous forme de fines gouttelettes dans le cytoplasme, et de bicouches dans la paroi des cellules.
Minéraux
Les champignons sont riches en minéraux, comme le potassium et le phosphore, puisque 100 g de champignons frais contiennent 390 mg de potassium et 60 mg de phosphore, contre seulement 5 mg de sodium. La teneur en calcium et en fer est très basse. Les champignons frais contiennent 93% d’eau. Mais cette teneur change avec l’âge. Elle commence par augmenter pendant la croissance.
Vitamines
Les champignons contiennent des quantités importantes de vitamine C (2.1 mg par 100 g de champignons frais), plus un peu des vitamines B1, B2, B6 et B3. Ils contiennent aussi 5.2 mg de nicotinamide par 100 g de champignon
References
- Höfer J (2017) Natural experiments: taking the lab outdoors. Science in School 42: 42-48.
Resources
- L’attitude des élèves vis-à-vis de la science et de la nature est décrite dans : Krischer D, Spitzer P & Gröger M (2016) ‘Chemistry is toxic, nature is idyllic’ – investigation of pupils’ attitudes. The Journal of Health, Environment, & Education 8: 7-13. doi: 10.18455/08002
- On peut approfondir la chimie relative aux expériences faites, à l’aide des ressources suivantes :
- Test du biuret
- Test de la ninhydrine
- Vitamin C: Teepoo S (2012) A new simple and rapid colorimetric screening test for semi-qualitative analysis of vitamin C in fruit juices based on Prussian blue. Journal of Applied Sciences 12: 568-574. doi: 10.3923/ jas.2012.568.574
- Test des phosphates
- Chlorure d’argent
Review
Les auteurs ont identifié un défi majeur lancé à la science : les élèves, ainsi qu’une bonne partie du grand public, refusent d’ademttre que notre environnement et même notre nourriture, est constituée de produits chimiques
Les expériences décrites dans cet article peuvent être faites sans difficulté par des lycéens au laboratoire. Elles montrent que la nourriture est de nature chimique, en utilisant pour cela l’exemple des champignons. Elles établissent aussi un pont entre la chimie et la biologie, grâce à une activité qui ne fait en général pas partie du programme habituel de sciences.
Tim Harrison, School Teacher Fellow, University of Bristol, UK





