Supporting materials
Hoja de ejercicios de la actividad nº 1
Hoja de ejercicios de la actividad nº 2
Download
Download this article as a PDF

Esta actividad se presentó en el festival Science on Stage 2022. ![]()
Tirando del hilo: vamos a explorar la química de la lana y utilizarla como materia prima en sencillas actividades prácticas para obtener productos bioderivados.

La lana ha sido tradicionalmente un producto de la cría de animales, especialmente ovejas y cabras, que ha servido para fines tan diversos como fabricar ropa, rellenar colchones o proporcionar aislamiento térmico.
Desde 2002 y en virtud del Reglamento Europeo CE 1774/2002, posteriormente revisado en 2009 (CE 1069/2009), la lana ha pasado de estar clasificada como un producto agrícola a estarlo como un residuo de procesamiento, que solo puede eliminarse mediante procedimientos muy caros.[1]
Según las estadísticas presentadas por la Federación Lanera Internacional (IWTO),[2] el número de granjas de ovejas está creciendo como resultado del interés por su carne y eso hace aumentar también la producción de lana, puesto que a los animales hay que esquilarlos por su propio bienestar.
Para ahorrarse enviar la lana a centros de eliminación, tanto la industria como los científicos llevan años devanándose los sesos en busca de usos alternativos. Así, los materiales derivados de la lana pueden servir como adsorbentes o elementos aislantes y también como materiales de partida para filtros u otros biomateriales. [3,4]
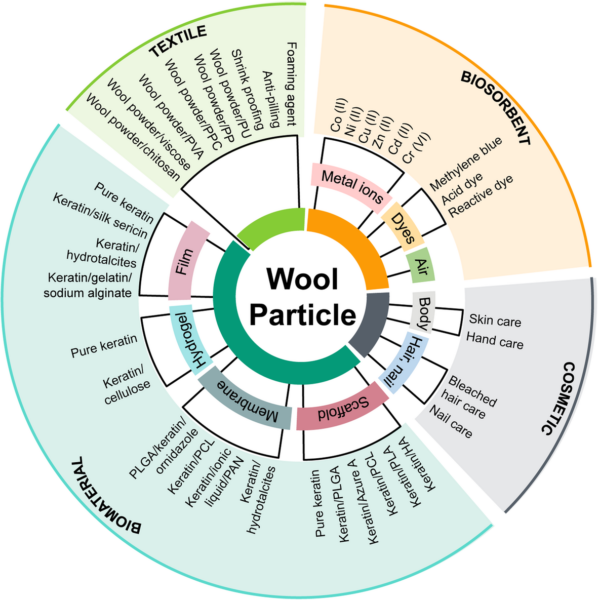
La lana es una fibra natural compuesta por proteínas (en torno al 95-98 %, de las que aproximadamente un 85 % es queratina), lípidos (en torno a un 2 %) y sales minerales (1 %). La queratina es una proteína muy abundante en la naturaleza, que además de en la lana se encuentra también en el cabello, las uñas, los cuernos o las plumas. [5,6]
Hay quien sitúa el primer uso de la queratina con fines médicos en la China de 1650, si bien el término apareció por primera vez en la literatura científica en 1850 para explicar la composición de los cuernos de algunos animales.[7]
Las actividades se pueden incorporar a distintas rutas curriculares:
Estas actividades de laboratorio, pormenorizadas e interdisciplinares, son aptas para edades de 14-16 y 16-19 años.
Su objetivo es implicar a los alumnos en un aprendizaje activo y estimular su pensamiento crítico.
Esta actividad consiste en la extracción de queratina a partir de la lana utilizando una solución de extracción adecuada. Puede completarse en una o dos sesiones: la extracción puede llevarse a cabo durante una hora con NaOH 1 M o durante la noche con NaOH 0,1 M.
La queratina es una proteína fibrosa que, en cuanto a su estructura secundaria, puede organizarse bien como hélice alfa o como lámina beta. Su alto contenido en residuos de cisteína favorece la formación de puentes disulfuro además de los puentes de hidrógeno, mientras que las interacciones iónicas e hidrófobicas contribuyen a la organización tridimensional (3D) de la proteína. Dependiendo del origen de la queratina, la estructura 3D y el contenido en aminoácidos concretos cambian, pero los principales enlaces inter e intramoleculares son siempre los puentes disulfuro entre cisteínas.
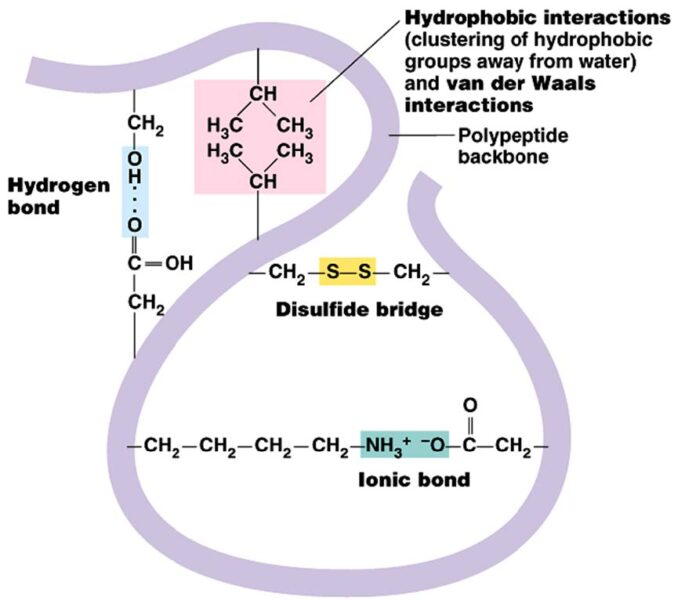
La extracción de la queratina depende precisamente de la ruptura de las interacciones antes mencionadas. Dependiendo del agente de extracción, la queratina extraída tendrá distintas composiciones en aminoácidos y distintas características fisicoquímicas. Por esa razón, y ante la posibilidad de utilizar la queratina para producir nuevos biomateriales, se han abierto varios campos de investigación. En los últimos años el objetivo ha sido desarrollar técnicas de extracción y métodos de producción de queratina hidrolizada cada vez más eficaces, algo que varía en función de las características del producto buscado y su uso. Entre los nuevos productos basados en queratina desarrollados hay películas, esponjas adsorbentes o fibras poliméricas con aplicaciones particulares en el campo de los biomateriales.[7,9–12]
Las soluciones de hidróxido de sodio diluidas 0,1 M no están clasificadas como peligrosas, pero el hidróxido de sodio 1 M es corrosivo. Es necesario usar guantes y protección ocular para evitar su contacto con los ojos y la piel; lo ideal sería trabajar bajo una campana extractora de humos.
Las soluciones deben prepararlas los profesores, para que los alumnos no utilicen las formas más concentradas.

Los alumnos deben ir anotando en la hoja de ejercicios sus observaciones durante el transcurso de los experimentos para después comentar las respuestas con toda la clase.
Por lo general, la lana suele adquirir un color más oscuro y un aspecto gelatinoso durante la extracción, mientras que la solución inicialmente transparente se enturbia y se oscurece. Esos cambios se deben a reacciones químicas.
Tal como se describió anteriormente, la forma 3D de las proteínas depende de los muchos enlaces formados entre distintas cadenas de péptidos y también dentro de una misma cadena proteica. Suelen ser enlaces débiles (puentes de hidrógeno, interacciones hidrofóbicas, enlaces dipolares) que se ven fuertemente influidos por factores externos como el pH, la temperatura, la presencia de sales iónicas, emulsionadores, la actividad de determinadas enzimas y la acción de ciertos microorganismos.
La hidrólisis alcalina de la lana produce en un 75-80 % materiales hidrosolubles como aminoácidos y péptidos.[11] El tratamiento con soluciones básicas da lugar a distintas reacciones químicas que desnaturalizan las proteínas, alterando su estructura 3D mediante la ruptura de los puentes de hidrógeno y disulfuro, la ionización de los grupos carboxílicos de los aminoácidos y cambios en la solubilidad. Al usar soluciones básicas se puede producir también un olor a azufre.[9]
En esta actividad se investigan los efectos de distintas sustancias químicas en la floculación de la queratina. Lleva unos 30 minutos.
Una vez obtenida la solución que contiene la proteína extraída, esta puede precipitarse por distintos métodos: adición de sales para cambiar la fuerza iónica o cambio de la polaridad del disolvente, la temperatura o el pH.
En el momento en que la proteína se desnaturaliza, se «abre» y las interacciones previamente intramoleculares pasan a ser ahora intermoleculares, agregándose la proteína y aumentando su carácter hidrofóbico. Esa menor afinidad por el agua puede evolucionar hacia fenómenos de agregación y polimerización, que pueden ser bien
La precipitación se caracteriza por la pérdida de solubilidad únicamente, debida a fenómenos de asociación y la consiguiente separación de las proteínas de la solución.
La floculación tiene lugar cuando se forman flóculos, es decir, grandes agregados micelares, sin desnaturalización de las estructuras proteicas. Se produce cuando las micelas proteicas de tamaño coloidal ya no presentan repulsiones electrostáticas y por tanto se agregan.
La floculación de las proteínas puede conseguirse: 1) modificando el pH mediante la adición de soluciones ácidas débiles y 2) mediante tratamiento con disolventes orgánicos miscibles con la fase acuosa en la que están disueltas las proteínas (como etanol o acetona).
Las soluciones de hidróxido de sodio diluidas 0,1 M no están clasificadas como peligrosas, pero el hidróxido de sodio 1 M es corrosivo. Es necesario usar guantes y protección ocular para evitar su contacto con los ojos y la piel; lo ideal sería trabajar bajo una campana extractora de humos.
Las soluciones deben prepararlas los profesores, para que los alumnos no utilicen las formas más concentradas.

Preguntar a los alumnos qué diferencias apreciaron cuando se indujo la floculación mediante cambios de pH o disolvente. ¿Se les ocurre alguna explicación de por qué los cambios de pH o disolvente pueden causar floculación?
La queratina hidrolizada obtenida a partir de la lana se utiliza principalmente en la industria cosmética como ingrediente de productos específicos para el cabello.
La última actividad propuesta consiste en elaborar un acondicionador del cabello utilizando queratina. Para maximizar las probabilidades de éxito en el aula, lo mejor es adquirir la queratina como solución al 25 % (m/V) en glicerina. Utilizar la queratina extraída resultaría difícil, ya que no es suficientemente soluble en agua y hay que purificarla.
Esta actividad lleva 30 minutos.
Las soluciones empleadas no son particularmente peligrosas pero lo ideal sería usar guantes y protección ocular.
Para 50 ml de producto:

Los alumnos deben llegar a entender que es posible utilizar materiales obtenidos a partir de residuos para elaborar cosméticos, lo cual es mejor y más sostenible que utilizar los materiales vírgenes. Como extensión de la actividad, se podrían investigar en más detalle los distintos aspectos de la economía circular de la lana.
Las actividades propuestas ofrecen varios aspectos útiles para la docencia:
Se trata de experimentos sencillos, que apenas entran a explorar la extensa bibliografía relacionada con el uso de biomasa procedente de material residual, pero que utilizan un material de partida bien conocido por todos y fácil de encontrar. Los reactivos y el resto de los materiales no deberían ser tampoco difíciles de encontrar, por muy mal equipado que pueda estar el laboratorio de química.
En la página web de Science on Stage se ofrecen otras actividades en torno a la queratina interesantes.
El proyecto presentado en este artículo surgió de una colaboración con la investigadora Annalisa Aluigi y el instituto del CNR de Biella. Posteriormente, algunas de las actividades se desarrollaron con la coordinación de Science on Stage y forman parte de la unidad «The 3 Rs and the Products of the Future» creada dentro del proyecto https://www.science-on-stage.eu/act-now-sdg
[1] Petek B, Logar RM (2020) Management of waste sheep wool as valuable organic substrate in European Union countries. Journal of Material Cycles and Waste Management 23: 44–54. doi: 10.1007/s10163-020-01121-3
[2] Un resumen del número de ovejas y la producción de lana a nivel mundial: https://iwto.org/wp-content/uploads/2022/04/IWTO-Market-Information-Sample-Edition-17.pdf
[3] Sun Y et al. (2022) The progress and prospect for sustainable development of waste wool resources. Textile Research Journal 98: 468–495. doi: 10.1177/00405175221098572
[4] Zhang C et al. (2020) Utilization of waste wool fibers for fabrication of wool powders and keratin: a review. Journal of Leather Science and Engineering 2. doi: 10.1186/s42825-020-00030-3
[5] Vineis C et al. (2019) Extraction and characterization of keratin from different biomasses: extraction from waste biomass and applications. In Sharma S, Kumar A (eds) Keratin as a Protein Biopolymer pp 35–76. Springer. ISBN: 978-3-030-02900-5
[6] Stephen G et al (2022) Wool keratin as a novel alternative protein: a comprehensive review of extraction, purification, nutrition, safety, and food applications. Comprehensive Reviews in Food Science and Food Safety 22: 643–687 doi: 10.1111/1541-4337.13087
[7] Koleva M, Zheleva D (2022) Methods for obtaining of keratin hydrolysates from sheep wool. Journal of Chemical Technology and Metallurgy 57: 76–83.
[8] Gaidau C et al. (2021) Wool keratin hydrolysates for bioactive additives preparation. Materials 14: 4696. doi: 10.3390/ma14164696
[9] Shavandi A (2017) Keratin: dissolution, extraction and biomedical application. Biomaterials Science 5: 1699–1735. doi: 10.1039/C7BM00411G
[10] Burnett CL et al. (2021) Safety assessment of keratin and keratin-derived ingredients as used in cosmetics. International Journal of Toxicology 40: 36S–51S. doi: 10.1177/10915818211013019
[11] Cardamone JM et al. (2009) Characterizing wool keratin. Advances in Materials Science and Engineering 147175. doi: 10.1155/2009/147175
[12] Banasaz S, Ferraro V (2024) Keratin from animal by-products: structure, characterization, extraction and application—a review. Polymers 16: 1999. doi: 10.3390/polym16141999
La lana es un biomaterial fascinante que se ha venido usando desde el principio de la humanidad hasta nuestros días. La autora ofrece a los profesores y especialmente a sus alumnos la oportunidad de examinar la química de la lana mediante experimentos interesantes y motivadores. La novedad aquí radica en la madeja de interrelaciones que se teje entre química y economía circular.
Ernst Hollweck, profesor de química y biología, Staatliches Gymnasium Holzkirchen (Alemania).
Hoja de ejercicios de la actividad nº 1
Hoja de ejercicios de la actividad nº 2
Download this article as a PDF

Act now for the Sustainable Development Goals: explore resources developed by European teachers bring the science of sustainability into the classroom.

Cuando la vida te da limones: usa el limoneno para explorar propiedades moleculares con tus alumnos y demostrar el método científico en…