Supporting materials
Download
Download this article as a PDF

¿Cómo afectan al metabolismo las drogas sociales? ¿Cómo se mide su toxicidad? ¿Cómo afecta el cambio climático a los ecosistemas acuáticos? Fomenta el aprendizaje activo al responder estas preguntas con Daphnia
Daphnia, una especie de micro crustáceo de agua dulce, es un organismo modelo que tiene muchas ventajas practicas: es fácil de cultivar bajo condiciones de laboratorio, el tamaño de su cuerpo es pequeño (2-5 mm), su ciclo de vida es corto, es de fácil manejo, tiene alta fecundidad, presenta reproducción partenogenética, y sus costos de mantenimiento son bajos.[1,2] Debido a su exoesqueleto translucido y quitinoso, es posible observar los órganos internos de las Daphnia bajo un microscopio o bajo lentes binoculares de aumento.[3] Son animales muy sensibles y debido a que sus respuestas biológicas fundamentales son similares a las de los humanos, se utilizan como modelos para estudiar los efectos de varias drogas sociales, como el café, el tabaco y el alcohol, y también se usan para evaluar la calidad del agua.[2] Los ecosistemas de agua dulce se encuentran entre los más amenazados en el mundo, nos abastecen de agua potable y de irrigación, de alimentos, regulan el clima, evitan la erosión y son lugares de recreo para las sociedad. El cambio climático ha incrementado la concentración de sales en las aguas dulces, con efectos drásticos en la salud y la supervivencia de los organismos de agua dulce.
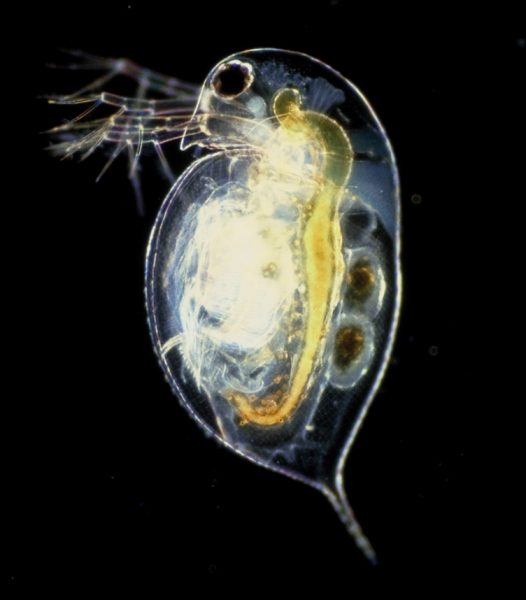
Las actividades prácticas que se describen en este artículo son adecuadas para estudiantes de 14-19 años y son una herramienta valiosa para evaluar los efectos de las drogas sociales en el sistema cardiovascular, y la influencia de la salinización en la supervivencia de las Daphnia. Al investigar estos efectos, los estudiantes aprenderán a recabar y a manejar datos experimentales para sacar sus propias conclusiones. A partir de sus conclusiones, los estudiantes podrán considerar repercusiones en la salud humana, y comprender los efectos del cambio climático en los ecosistemas de agua dulce.
Los cultivos se pueden guardar en recipientes con un máximo de 30 Daphnia por litro en agua libre de cloruro con un pH de 7-8, a una temperatura de 18–25°C, durante un fotoperiodo controlado de 16 h y se alimentan 2-3 veces por semana con microalgas o levadura (5 gotas/litro). Niveles bajos de oxígeno disuelto son letales.
Para preparar una suspensión de levadura (un hongo unicelular), agrega agua sin cloruro a un recipiente de 1 litro e incorpora 2 g de levadura para hornear. Almacena la suspensión en un frigorífico (4°C) y siempre agítala antes de usarla para que la levadura se vuelva a suspender. Agrega 5 gotas/litro de este alimento a los cultivos de Daphnia 2-3 veces por semana.
Las microalgas son organismos fotosintéticos microscópicos. Tienen un papel central en la vida sobre la tierra, ya que forman la base de la red alimenticia en muchos ecosistemas acuáticos. Scenedesmus es una microalga verde no móvil, típica en el fitoplancton de agua dulce, que es fácil de cultivar y mantener en el laboratorio y se usa de forma rutinaria para alimentar a las Daphnia.
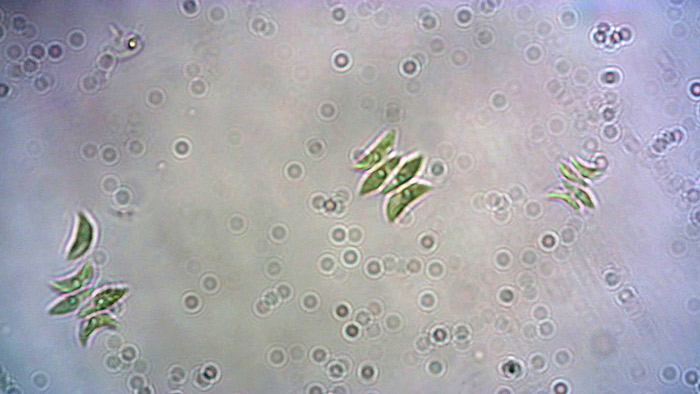
Los cultivos de Scenedesmus requieren el uso de agua libre de cloruro con un pH de 7-8, a una temperatura mínima de 16°C (18 a 25°C), y con un fotoperiodo mínimo de 12 h que provenga de una fuente de luz para acuario LED (o fluorescente). El cultivo de microalgas se debe mantener en un recipiente donde circule el aire (un biorreactor) para crear el CO2 necesario para la fotosíntesis y evitar la sedimentación de las microalgas en el fondo del recipiente. Cada 15 días, se debe suplementar el cultivo con una solución de sales minerales preparada con 3-5 gotas/litro de líquido fertilizante de plantas comercial.

El consumo de drogas sociales causa cambios en el sistema nervioso central, lo cual resulta en cambios fisiológicos y/o del comportamiento. Las drogas estimulantes (cafeína, nicotina) se caracterizan por aumentar el metabolismo del cuerpo, mientras que drogas depresivas (alcohol) lo disminuyen. El ritmo cardiaco se puede monitorear como un indicador óptimo de estos cambios.
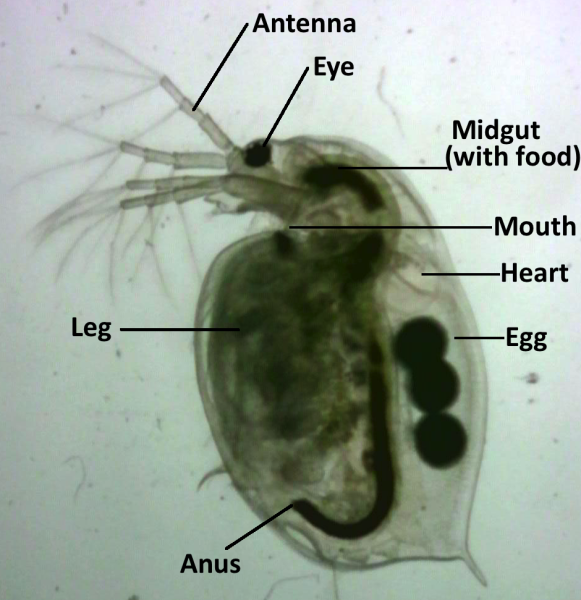
Observar cómo estas drogas afectan a un organismo vivo en tiempo real, permite a los estudiantes establecer una relación de los posibles efectos de las drogas en sus cuerpos. El cuerpo transparente de Daphnia permite que se midan diferentes parámetros fisiológicos por medio de métodos ópticos no invasivos. Un bioensayo es un procedimiento que utiliza organismos vivos para determinar los efectos de una sustancia química. La duración completa de esta actividad será alrededor de 2 h, pero se puede hacer en 1 h si las soluciones se preparan con anticipación.

En la hoja de trabajo que se proporciona (ver la tabla de muestra), los estudiantes pueden predecir los efectos de las drogas sociales en el ritmo cardiaco de las Daphnia. Antes de empezar el trabajo experimental, vean este video para aprender cómo localizar el corazón de las Daphnia y cómo contar sus latidos.
Precaución: si se usa demasiado algodón, podría ser difícil observar el corazón de las Daphnia.
| Predicción (según la tabla abajo) | Ritmo cardiaco control (lpm) | Ritmo cardiaco experimental (lpm) | |
| Tabaco | |||
| Alcohol (6%) | |||
| Alcohol (12%) | |||
| Alcohol (20%) | |||
| Café |
KeyClave:
| +++ | Incremento significativo en el ritmo cardiaco |
| ++ | Incremento en el ritmo cardiaco |
| + | Incremento no significativo en el ritmo cardiaco |
| 0 | Ningún cambio en el ritmo cardiaco |
| – | Disminución no significativa en el ritmo cardiaco |
| — | Disminución en el ritmo cardiaco |
| — | Disminución significativa en el ritmo cardiaco |
| x | heart stops |
Si el ritmo cardiaco control resulta ser menor que 200 latidos por minuto (lpm) o mayor que 300 lpm, la lectura se debe repetir.
Se deben tomar precauciones para evitar que las soluciones experimentales entren en contacto con la piel, ojos o boca de los estudiantes.
Al final de la actividad, los estudiantes deberán lavarse las manos
Los cuerpos transparentes de las Daphnia permiten observar visualmente sus órganos internos y medir sus características fisiológicas, como el ritmo cardiaco. Se pueden usar como un sistema modelo para experimentos de toxicología porque son muy sensibles a las perturbaciones ambientales y exhiben respuestas fisiológicas rápidas cuando se les expone a aguas contaminadas.[5]
Se ha demostrado que el uso de animales vivos en experimentos de investigación auténticos, aumenta nuestro entendimiento de conceptos científicos. Después del experimento, haz las siguientes preguntas a los estudiantes para ayudarles a comprender la influencia que las drogas sociales tienen en el sistema nervioso, cuando las Daphnia se usan como organismo modelo:
¿Cuál es el propósito de mantener algunas Daphnia en agua pura?
¿Por qué se usa un promedio de tres series de latidos del corazón?
¿Por qué se usa una Daphnia nueva con cada una de las soluciones experimentales (drogas sociales)?
¿Cuál es la ventaja/importancia de usar clones?
Compara las predicciones con los datos experimentales. Debate si Daphnia es un modelo biológico adecuado para estudiar diversos tipos de estresores.
La salinización en los ecosistemas de agua dulce es un problema en aumento causado por actividades humanas como la irrigación, la extracción de recursos, la erosión acelerada de las rocas debido a la lluvia ácida, el uso de fertilizantes en la agricultura, las sales en las carreteras, la minería y las construcciones urbanas. Este problema se exacerba aún más a causa del cambio climático, debido a la disminución de las lluvias, al aumento de la evaporación, y por la necesidad más frecuente de irrigar cultivos.[6,7] Las investigaciones de bioensayo pueden aumentar el entendimiento de los estudiantes acerca de los efectos de la salinización en la supervivencia de las Daphnia; por lo tanto, fomenta una conexión conceptual entre la supervivencia de organismos simples y los efectos que tiene en los ecosistemas de agua dulce. Estos organismos necesitan mantener un equilibrio osmótico entre la concentración iónica dentro de sus células y sus fluidos corporales. La salinidad del agua que les rodea tiene una gran influencia en este proceso.
En esta actividad, los estudiantes determinarán la toxicidad del NaCl en las Daphnia al calcular el valor de LC50 (concentración letal, 50%), el cual se define como el nivel de concentración de la toxina que mata al 50% de los organismos expuestos. Este experimento debe durar alrededor de 20 min.[1]

En la muestra control, la mortalidad no debe superar el 10%.
| NaCl (%) | Número de Daphnia que murió después de | % de mortalidad (después de 20 min) | Observaciones en el comportamiento de las Daphnia | ||
| 5 min | 10 min | 20 min | |||
| 0 | |||||
| 0.5 | |||||
| 1 | |||||
| 1.5 | |||||
| 2 | |||||
No usar detergente para limpiar el material de vidrio. Los residuos de detergente pueden ser tóxicos para las Daphnia.
Después de hacer el experimento, discutan los resultados para entender mejor la influencia del cambio climático en el comportamiento y supervivencia de las Daphnia y de otros organismos acuáticos.[8,9] Las preguntas pueden ser las siguientes:
¿Se te ocurre alguna repercusión que esta investigación pueda tener en la población humana?
Esta actividad podría ser también la base de una discusión acerca de las cuestiones éticas del uso de animales vivos para la investigación. El uso de organismos simples como las Daphnia es poco controversial, relativamente. Pero ¿dónde pondrían un límite los estudiantes? En este artículo se puede encontrar más información acerca del por qué puede ser importante el uso de animales en la investigación y cómo podemos minimizar su uso.
[1] Cahill K (2006) Bioassay investigations with Daphnia. My Environment, My Health, My Choices. University of Rochester.
[2] OECD (2004) Test No. 202: Daphnia sp. Acute Immobilisation Test, OECD Guidelines for the Testing of Chemicals, Section 2. OECD Publishing, Paris. doi: doi.org/10.1787/9789264069947-en
[3] Tkaczyk A et al. (2021) Daphnia magna model in the toxicity assessment of pharmaceuticals: a review. Science of the Total Environment 763: 143038. doi: 10.1016/j.scitotenv.2020.143038
[4] Gewin V (2005) Functional Genomics Thickens the Biological Plot. PLOS Biology 3: e219. doi:10.1371/journal.pbio.0030219
[5] Gleichsner AM, Butler SR, Searle CL (2019) Dynamic Daphnia: an inquiry-based research experience in ecology that teaches the scientific process to first-year biologists. CourseSource. doi: 10.24918/cs.2019.2
[6] Kaushal SS et al. (2021) Freshwater salinization syndrome: from emerging global problem to managing risks. Biogeochemistry 154: 255–292. doi: 10.1007/s10533-021-00784-w
[7] Jeppesen E et al. (2020) Salinization increase due to climate change will have substantial negative effects on inland waters: a call for multifaceted research at the local and global scale. The Innovation 1: 100030. doi: 10.1016/j.xinn.2020.100030
[8] Martinez D et al. (2022) Daphnia magna and mixture toxicity with nanomaterials – current status and perspectives in data-driven risk prediction. nanotoday 43: 101430. doi: 10.1016/j.nantod.2022.101430
[9] Müller M et al. (2018) Temperature-driven response reversibility and short-term quasi-acclimation of Daphnia magna. PLOS ONE 13: e0209705. doi: 10.1371/journal.pone.0209705
Download this article as a PDF