Micromaravilla: la química a microescala en el aula Inspire article
Las cosas buenas vienen en frascos pequeños: descubre cómo los experimentos a microescala pueden causar un gran impacto en la enseñanza de CTIM.
Los experimentos en las aulas son necesarios para captar la atención de los estudiantes e ilustrar los principios químicos clave. Sin embargo, los métodos tradicionales requieren grandes cantidades de reactivos peligrosos, equipos complejos y bastante trabajo para el profesor o los alumnos en cuanto a preparación y limpieza. Muchos de estos experimentos se pueden modificar, de forma sencilla, para realizarlos a microescala, sin que perjudiquen el efecto demostrado. De hecho, los experimentos a microescala (también llamados a pequeña escala) pueden incluso resaltar efectos que no son perceptibles cuando se realizan a gran escala. Este artículo da a conocer el método de los experimentos a microescala en el aula y las razones por las que se deberían realizar en clase.
¿Qué es la química a microescala?
Desarrollé los procedimientos a microescala en CLEAPSS[1] en el Reino Unido, para tratar la preocupación que hay en los colegios por la exposición de los estudiantes y profesores a reactivos peligrosos.
La química a microescala se refiere, a menudo, a realizar reacciones químicas con microgotas. Esto se hace dispensando micro gotas (de 0,2 a 0,5 ml) de soluciones en una plantilla de trabajo, que está dentro de una funda de plástico transparente (preferida) o laminada (las correcciones y mejoras requieren más laminación).
La figura 1 muestra un ejemplo con indicadores pH y sustancias de diferentes valores de pH. CLEAPSS utiliza esto en sus cursos de Salud y Seguridad para profesores y técnicos del Reino Unido. Los colores atractivos y la rapidez con la que se hace motiva a los participantes a que compartan las ideas en sus colegios.

Imagen por cortesía de Bob Worley
Otras reacciones, como la precipitación (figura 2) y el desplazamiento se llevan a cabo de forma similar. Los reactivos se aplican simplemente con un pequeño cuentagotas o una pipeta, que permite establecer varios diseños para ilustrar diferentes patrones o tendencias. Las hojas se limpian luego sin problemas. Otro método consiste en colocar microgotas de reactivos en placas de Petri (ver figura 5).
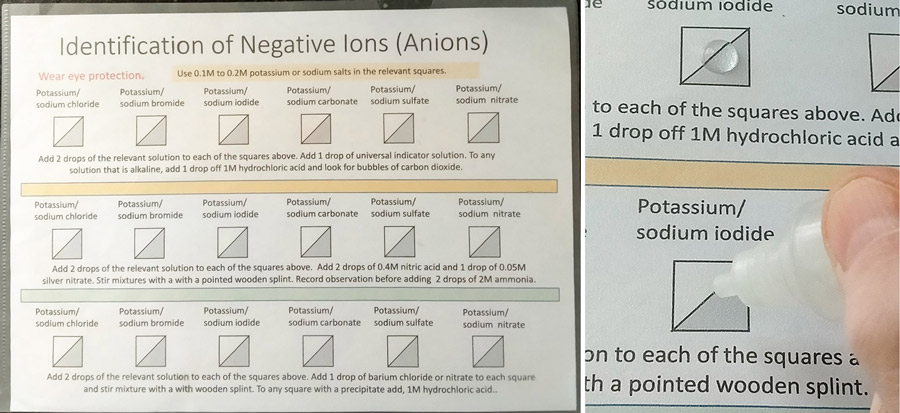
Imagen por cortesía de Bob Worley
Además de añadir las gotas de sustancias o de líquidos reactivos, los alumnos pueden preparar la sustancia allí mismo, añadiendo granos de sal a un solvente con un palillo o una tablilla de madera. Disolver y mezclar es muy rápido debido al pequeño volumen, y esto, de por sí, puede ser una excelente demostración de disolución, solvatación y difusión.
La figura 3 muestra lo que ocurre cuando se añaden pequeños granos de sulfato de cobre (II) y carbonato de sodio a los lados de una gota de agua destilada. Los dos sólidos iónicos se disuelven y dispersan por el agua, y se forma una línea de precipitado de carbonato de cobre básico en el centro de la gota donde ambos iones se encuentran.

Imagen por cortesía de Bob Worley
También se utiliza un indicador de conductividad en las gotas para detectar la presencia de iones y mostrar la electrólisis (Figura 4).

Imagen por cortesía de Bob Worley
¿Cómo adaptar el experimento al enfoque de la microescala?
Lo ideal sería que la versión a microescala diera más información con fines didácticos que la forma tradicional de la actividad.
El proceso de usar gotas de líquido en una superficie de plástico depende de la tensión de la superficie, que funciona bien con soluciones acuosas, pero no con líquidos orgánicos. Por ejemplo, muchos plásticos se ablandan con solventes orgánicos como las cetonas y los ésteres. Por tanto, para los solventes orgánicos, se necesitan pequeños viales de vidrio, placas de porcelana o tubos de ensayo.
La alta temperatura puede dar problemas, pero los líquidos se ponen en un frasco de vidrio, y este, en agua hirviendo, en una placa caliente o en un calentador diseñado especialmente para ello.[2]
¿Por qué debería utilizar la química a microescala en mi clase?
Este enfoque tiene muchas ventajas. Las principales se resumen a continuación.
Beneficios del enfoque a microescala
- Mejora la seguridad
- Reduce los desperdicios (bueno para el medio ambiente)
- Reduce los costes del equipo/material
- Adecuado para usar en entornos con recursos limitados, como se demuestra en el proyecto RADMASTE[3]
- Más fácil de organizar y limpiar
- Experimentos más rápidos y fáciles de ejecutar:
- Los profesores tienen más tiempo para enseñar.
- Los estudiantes pueden enfocarse en los objetivos clave.
- Mejora la comprensión de los conceptos complejos de química cuestionando los conceptos erróneos de los estudiantes
- Promueve nuevos experimentos, por ejemplo, la hidrogenación de alquenos y la licuefacción de gases
Impulsa las iniciativas CTIM con materiales y métodos modernos, por ejemplo, electrodos de fibra de carbono, imanes Nd, LED, microelectrónica Arduino, impresión 3D y corte por láser
En términos de seguridad, los beneficios de usar pequeñas cantidades de reactivos son evidentes. Esto es relevante, sobre todo, con los químicos volátiles, donde los niveles de gases tóxicos en el aire son mucho más bajos solo si se utilizan microgotas. Una perfecta demostración de ello es la electrólisis del cloruro de sodio o cloruro de cobre (II), que produce un gas cloro tóxico que puede provocar problemas respiratorios. Algunos directores de colegios quisieron eliminar esta actividad a pesar de estar en los programas de exámenes. Sin embargo, CLEAPSS pudo organizar equipos para llevar a cabo este experimento a menor escala (Figura 5) y, en este caso, solo se producen de 5 a 6 cm3 de gas cloro.

Imagen por cortesía de Bob Worley

Imagen por cortesía de Bob Worley
A algunos profesores les preocupa que los alumnos se vean en desventaja si el montaje experimental utilizado no coincide con el de los exámenes. Sin embargo, esto se puede resolver, por lo general, proporcionando un diagrama que deje clara la equivalencia con los experimentos clásicos a gran escala. Por ejemplo, en el experimento de electrólisis, antes descrito, un profesor estaba de acuerdo con que la microelectrólisis era buena, pero le preocupaba que el diseño no refleje el instrumental tal y como se muestra en los libros de texto y en las preguntas de los exámenes. El técnico, muy ágil, dibujó un “vaso horizontal” en un papel y recolocó los electrodos, y el profesor quedó conforme.
Las ventajas de los experimentos rápidos y fáciles de realizar son quizá menos evidentes que las ventajas prácticas en términos de conveniencia y seguridad. Esto reduce la carga de trabajo mental a corto plazo de los alumnos, y les permite implicarse mejor tanto en la motivación del experimento como en la ciencia que lo sustenta. La naturaleza del experimento a microescala también puede facilitar la comprensión de los principios científicos. Por ejemplo, en el experimento de precipitación de carbonato de cobre, que se muestra arriba, los alumnos ven cómo se añaden los sólidos y comprenden cómo se disuelven y se unen en el centro. Mientras que al mezclar dos sustancias, preparadas por el profesor, la súbita formación de un precipitado sólido puede parecer magia.
Resumen
Hay mucho más por aprender. Si este artículo ha despertado tu interés, te animo a ver la reciente clase que hicimos Adrian Allan y yo en Science on Stage,[4] junto con otro vídeo en la sección de recursos. En los siguientes números de Science in School, se publicarán más artículos de enseñanza con instrucciones paso a paso sobre cómo realizar algunos de estos experimentos a microescala, junto con recursos para imprimir.
References
[1] Introducción a CLEAPPS: http://science.cleapss.org.uk/Policies/What-Is-Cleapss.aspx
[2] Allan A, Worley B, Owen M (2018) Perfumes with a pop: aroma chemistry with essential oils. Science in School 44:40–46.
[3] Más información sobre el proyecto RADMASTE de Microciencia: https://www.radmaste.org.za/
[4] Science on Stage reúne a los profesores de CTIM con ideas de enseñanza excelentes: https://www.science-on-stage.eu/
Resources
- Mira la reciente clase en Science on Stage que muestra algunos experimentos fantásticos de química a microescala.
- Mira la gran introducción a las técnicas de química a microescala.
- Visiona un experimento con gases licuados.
- Aprende a extraer aceites esenciales de plantas aromáticas: Allan A, Worley B, Owen M (2018) Perfumes with a pop: aroma chemistry with essential oils. Science in School 44:40-46.
- Intenta hacer experimentos con esferas de hidrogel: Tarai ED (2017) Small is beautiful: microscale chemistry in the classroom. Science in School 39:31-35.





