Un océano en el laboratorio escolar: dióxido de carbono en el mar Teach article
¿Sabías que el dióxido de carbono se disuelve en masas de agua e impacta al océano? Explora los efectos del dióxido de carbono en la química oceánica con estas actividades prácticas.
La química del dióxido de carbono en el océano
El océano cumple un papel importante en el clima de la Tierra. A pesar de que es un sistema complejo, que interconecta todas las partes del planeta, el océano obedece a leyes elementales de física y química que pueden usarse para crear conciencia sobre la dinámica del océano y su impacto en nuestras vidas.
El aumento de la concentración de dióxido de carbono en la atmósfera terrestre debido a la actividad humana, como la combustión de combustibles fósiles (fuente principal de dióxido de carbono antropogénico), modifica la atmósfera y acidifica el océano. El tema de la acidificación del océano está vinculado de forma inherente en el plan de estudios con los temas de los ácidos y bases, pH e incluso reacciones de precipitación.
La lluvia es ácida por naturaleza (tiene un pH de aproximadamente 5,6), porque disuelve el dióxido de carbono de la atmósfera para formar ácido carbónico:
A diferencia de la lluvia, el océano es alcalino (tiene un pH algo superior a 8), porque contiene carbonatos e iones de hidrogenocarbonato. El océano es, por lo tanto, un importante depósito de dióxido de carbono antropogénico, que lo extrae de la atmósfera. Esto podría ser algo bueno, sin embargo causa un descenso del pH y cambios en la química del océano. La acidificación del océano afecta a las reservas de iones de carbonato, un componente importante de las conchas. El dióxido de carbono se disuelve en el océano para formar el ácido carbónico, que reacciona a los iones de carbonato. De este modo, las cantidades de iones de carbonato disminuyen y las de iones de hidrógeno carbonato aumentan:
Actividad 1: Dióxido de carbono y pH del agua – Parte I
Este experimento evidencia cómo el dióxido de carbono modifica el pH del agua y por qué la lluvia es ácida por naturaleza. Los cambios de color de los indicadores universales hacen que el experimento sea más interesante para los alumnos más jóvenes.
Materiales
- 2 matraz de Erlenmeyer de 100 cm3
- 40 cm3 de agua dulce
- Pajitas
- De 5 a 7 gotas de indicador universal o azul de bromotimol
Los colores de los indicadores se muestran en la figura 1. En todas las figuras que se muestran aquí, se utilizó el azul de bromotimol.

Gregor Trefalt/Wikimedia, CC BY-SA 4.0
Procedimiento
- Llena el matraz con 40 cm3 de agua dulce. También puedes usar agua de mar o preparar una mezcla de 3,5 g de sal marina en 100 cm3 de agua.
- Añade gotas del indicador de pH a cada matraz y mide el pH.
- En un matraz, sopla aire lentamente en el agua con una pajita.
- Debes observar cambios en el color (figura 2) y apuntar los nuevos valores del pH.

Imagen por cortesía de Ole Ahlgren
Actividad 2: Dióxido de carbono y pH del agua – Parte II
El dióxido de carbono no borbotea en el océano. El contacto entre el océano y la atmósfera es suficiente para que el gas se disuelva. Este experimento es una muy buena representación de lo que pasa en el océano de forma natural, aunque los resultados no son tan inmediatos.
Materiales
- Vaso de precipitado de 250 cm3 con tapón de goma
- Matraz de Erlenmeyer de 250 cm3
- 50 cm3 de agua de grifo con cerca de 10 gotas de indicador universal o azul de bromotimol
- 10 cm3 de vinagre (ácido acético)
- 2 Cucharillas de bicarbonato de sodio
- Cerillas (opcional)
Procedimiento
- Añade poco a poco el vinagre a unas 2 cucharillas de bicarbonato de sodio en el matraz de Erlenmeyer (figura 3). Cuando deje de burbujear, verifica si el vaso de precipitado está lleno de dióxido de carbono colocando una cerilla encendida en él. La cerilla se apagará ante la existencia de CO2.
- A continuación, «vierte» el gas en un vaso de precipitado que contiene 50 cm3 de agua con indicador, para luego cerrarlo con el tapón de goma.
- El dióxido de carbono se disolverá lentamente en el agua, pero puede tardar hasta un día para observar algún cambio en el pH (figura 3).

Imagen por cortesía de Ole Ahlgren
Actividad 3: Dióxido de carbono por la combustión de madera
Una alternativa a la actividad 2 consiste en quemar un palo de madera; por ejemplo, una cerilla, para producir dióxido de carbono sobre la superficie del agua. Este escenario es el más parecido a la quema de combustibles fósiles en la vida real y dará resultados similares.
Materiales
- 100 cm3 de matraz de Erlenmeyer con tapón de goma
- 20 cm3 de agua de grifo con unas 5 gotas de indicador universal
- Un palo de madera
Procedimiento
- Pon 20 cm3 de agua con indicador en el matraz y mide el pH.
- Es necesario usar gafas protectoras. Enciende un pequeño palo de madera y colócalo en el matraz (figura 4) hasta que la llama se extinga por la falta de oxígeno suficiente que mantenga la combustión.
- Cierra el matraz con un tapón y agita por unos segundos.
- El indicador cambia de color y se vuelve a medir el pH del agua (figura 4).
- Cuando se agita el matraz, el agua absorbe rápidamente el CO2. En la vida real, este es un proceso lento. Para evidenciar esto, repítelo sin agitar y deja el matraz cerrado y quieto por varias horas para ver el cambio de color cuando el CO2 se absorba.

Imagen por cortesía de Ole Ahlgren
Advertencia
Los alumnos deberán usar gafas protectoras durante esta actividad.
Actividad 4: Dióxido de carbono e iones de carbonato
Este experimento exhibirá la cantidad de carbonato disponible en la solución, de forma cualitativa.
El carbonato de calcio es insoluble en agua, a diferencia del hidrógenocarbonato de calcio, que es muy soluble. Cuando añadimos iones de calcio (de una solución de nitrato cálcico) a una solución con iones de carbono (de una solución de carbonato de sodio), deberemos observar la formación de un precipitado blanco de carbonato de calcio, uno de los componentes de las conchas. Si disminuimos el pH, podremos observar cómo afecta a la cantidad de carbonato disponible en la solución, gracias a la cantidad de carbonato cálcico que precipita.
Materials and reagents
- Solución de Na2CO3 de 0.05 mol/dm3 (0.52 g de Na2CO3 en 100 cm3 H2O)
- Solución de HNO3 de 1 mol/dm3
- Solución de Ca(NO3)2 de 0.03 mol/dm3 (0.33 g de Ca(NO3)2 en 100 cm3 H2O))
- 3 tubos de ensayo
- Medidor de pH o tiras de ensayo de pH
Procedimiento
- Añade una solución de Na2CO3 de 5 cm3 a cada uno de los tres tubos de ensayo (A, B y C; figura 5).
- Añade 10 gotas de solución de HNO3 al tubo A, 5 gotas al tubo B y ninguna al tubo C (control).
- Con el medidor de pH o tira de ensayo, mide el pH en cada tubo y luego añade una solución de Ca(NO3)2 de 1 cm3 (o aproximadamente 25 gotas a cada tubo).
- A continuación, observa los resultados y deduce qué solución tiene más carbonato disponible para precipitar como carbonato de calcio.

Imagen por cortesía de Ole Ahlgren
Discusión
A los alumnos más jóvenes se les puede explicar el resultado de una manera más fácil, indicando que el agua tiene iones de carbonato disueltos (CO32-), iones de hidrogenocarbonato (HCO3-), y ácido carbónico (H2CO3). El último se puede convertir en agua y dióxido de carbono. La cantidad relativa de cada especie depende del pH de la solución. En la solución con menor pH, hay muy pocos carbonatos y más ácido carbónico que se descompone, por lo que podemos ver la formación de dióxido de carbono. A los alumnos más avanzados se les puede explicar los resultados de una forma más compleja, usando las siguientes ecuaciones químicas, los conceptos del equilibrio químico y el principio de Le Chatelier.
Tras disolver CaCO3 en agua (solución con pH alto):
Tras añadir HNO3
Una solución más ácida desplaza el equilibrio hacia la derecha, por lo que se dispone de menos, según el principio de Le Chatelier. En el tubo A, el equilibrio se desplaza tanto hacia la derecha que se observa la formación de burbujas de CO2.
Tras añadir Ca(NO3)2:
La solución con el precipitado más blanco será la única con más iones de carbonato; en este caso, es el tubo C el que contiene carbonato de sodio (pH=11) y no ácido nítrico (HNO3).
Consecuencias en la vida del océano
El aumento del dióxido de carbono en la atmósfera, por la actividad humana, impacta en el océano. El océano absorbe alrededor del 30 % de este gas y una fracción reacciona en el agua para formar ácido carbónico. Este ácido débil causa acidificación en el océano al reducir el pH. El término acidificación del océano, a pesar de ser correcto, podría ser confuso, ya que el océano es alcalino con un pH de alrededor de 8,1 (figura 6).[1]
Pero aún si el océano se mantiene alcalino, un descenso en el pH afectaría a las reacciones bioquímicas dentro de un organismo y a la formación de estructuras en los organismos marinos calcáreos.[2,3]
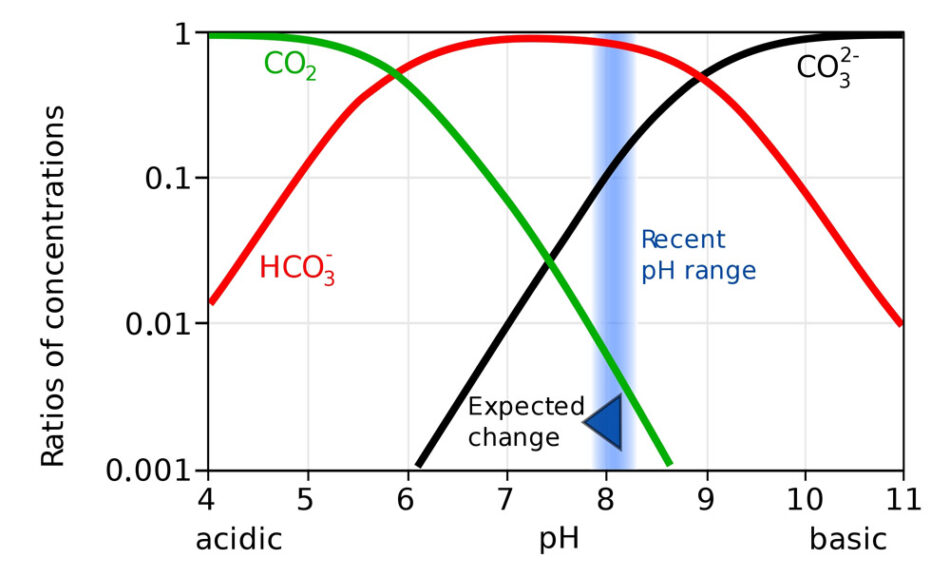
Dominio público
De acuerdo con la figura 6, a medida que el pH desciende, la cantidad de iones de carbonato también, lo que los hace menos disponibles. Los iones de carbonato se transforman en iones de hidrogenocarbonato y en dióxido de carbono. Por eso, en la actividad 4, se observa la formación de un gas en el pH 7.
Preguntas para los alumnos
- ¿Por qué, en la actividad 1, el agua cambia de color al soplar en ella?
- ¿Cómo se ilustra una consecuencia de la quema de combustibles fósiles en la actividad 3?
- Explica la diferencia de las precipitaciones en los tres tubos de ensayo de la actividad 4, basándote en la figura 5 y 6.
- A veces, la gente ilustra una consecuencia de la acidificación del océano colocando conchas en ácido. ¿Por qué este experimento es engañoso?
- Si el pH del océano desciende de 8,1 a 8,0, ¿a cuánto descenderá aproximadamente el índice de iones de carbonato, según la figura 6?
References
[1] Un artículo sobre la acidificación del océano por la Oficina Nacional de Administración Oceánica y Atmosférica (NOAA, por sus siglas en inglés): https://www.noaa.gov/education/resource-collections/ocean-coasts/ocean-acidification
[2] Un informe sobre las consecuencias de la acidificación del océano: https://worldoceanreview.com/en/wor-1/ocean-chemistry/acidification/
[3] Un informe sobre cómo el cambio climático altera la química oceánica: https://worldoceanreview.com/en/wor-1/ocean-chemistry/
Resources
- Experimenta más actividades relacionadas con el océano: Ribeiro C I, Ahlgren O (2021) An ocean in the school lab: rising sea levels. Science in School 53.
- Conoce más acerca de cómo la acidificación del océano afecta a la vida de las focas: Korn A (2016) Opening seashells to reveal climate secrets. Science in School 35:12–14.
- Lee acerca del rol de nuestros océanos en el cambio climático: Harrison T, Khan A, Shallcross D (2017) Climate change: why the oceans matter. Science in School 39: 12–15.
- Find out about the physics at work beneath the waves with these classroom experiments: Watt S (2012) Movers and shakers: physics in the oceans. Science in School 25: 28–33.
- Explora otros experimentos químicos relevantes al cambio climático: Shallcross D, Harrison T (2008) Practical demonstrations to augment climate change lessons. Science in School 10:46–50.
- Lee acerca del impacto de la actividad humana en el cambio climático y sus consecuencias para la Tierra: Follows M (2019) Ten things that affect our climate. Science in School 47:19–25.
- Descubre cómo las consecuencias del cambio climático ya están impactando en las comunidades: Unwin H (2020) The social science of climate change. Science in School 49:18–22.
- Encuentra actividades prácticas relacionadas en Earth Learning Idea.
Review
El impacto del dióxido de carbono aparece pocas veces en las noticias. En este artículo, Ribeiro y Ahlgren reúnen tres prácticas fáciles para respaldar la enseñanza de la química implicada en la disolución del dióxido de carbono en los océanos del mundo.
A través de una dificultad ascendente, los autores exploran una serie de ideas importantes que incluyen: las diferencias en acidez entre el agua de mar y el agua potable, el impacto de la disolución del dióxido de carbono en el pH y, por último, el equilibrio entre los iones de carbonato e hidrogenocarbonato. Su experimento final ofrece extensiones útiles para alumnos con más talento, que provee una vía de acceso a las discusiones sobre Le Chatelier. Estos experimentos deberían ofrecer a los profesores una ampliación útil a la explicación de lo que a menudo se considera como parte más teórica del plan de estudios.
Dr. Chris Millington, Profesor de Química, en Oldham Hulme Grammar, Reino Unido





