Supporting materials
Download
Download this article as a PDF

Traducido por I. Carrero, Univ. de Valladolid. Angelika Börsch-Haubold nos muestra las delicias para el olfato de la química orgánica.

“En Química, lo que no explota, apesta”. No a todos los estudiantes de Química les atraen los malos olores y las explosiones en el laboratorio. Afortunadamente, hay muchas moléculas orgánicas que huelen realmente bien. Nos encontramos con estas sustancias diariamente –usando un gel de ducha perfumado, sazonando nuestras comidas con especias o metiendo nuestra nariz hasta el fondo de una rosa–. Conocer la química orgánica de los aromas naturales debiera motivar incluso a aquellos que detestan el lado tóxico y peligroso de la Química a acercarse a las fórmulas estructurales y a las funciones de las moléculas.
Para ser perceptibles a nuestro olfato, los compuestos químicos deben ser lipófilos, pequeños (masa molecular < 300 Da) y volátiles. Las moléculas odoríferas escapan de su estado fluido o incluso sólido y pasan al aire. El tejido sensorial, denominado epitelio olfativo, es una membrana mucosa que tapiza la parte superior de la cavidad nasal. Los olores llegan a esta zona (aproximadamente a 7 cm de los orificios nasales) con el aire que respiramos; si algo huele muy poco, aspiramos dos o tres veces más, llevando más aire y fragancia hacia la membrana sensorial. Allí, las moléculas se disuelven en la mucosa y se unen a receptores olfativos situados en la membrana plasmática de las células sensoriales. Las células envían impulsos nerviosos a nuestro cerebro el cual aprende a asociar los olores con su origen (como una rosa), permitiéndonos reconocerlos incluso cuando el origen está escondido (como cuando entramos en una casa y adivinamos que hay un pastel en el horno) o clasificarlos como desconocidos (como cuando vamos a un restaurante exótico por primera vez).
Clasificar los olores en un número limitado de tipos no es tan fácil como definir los sabores básicos (dulce, ácido, salado y amargo). Los atributos típicos de los olores son: floral (jazmín), picante (jengibre, pimienta), afrutado (acetato de etilo), resinoso (humo de resina), fétido (huevo podrido) y quemado, o humo, (alquitrán). Almizclado (muscona), alcanforado, rancio (ácidos isovalérico y butírico) y pungente o acre (ácidos fórmico y acético) se añaden a menudo a esta lista. Concentrándonos más en los detalles químicos, los grupos funcionales de las moléculas fragantes se pueden asociar a olores característicos (Tabla 1). El aroma de los alcoholes n-alifáticos, por ejemplo, tiene una gama que va desde el olor a hierba, rosa o madera hasta el olor a naranja. Por el contrario, los ácidos n-alifáticos huelen a grasa, ácido, rancio o sudor. Los aromas de las frutas son ésteres formados entre ácidos orgánicos alifáticos de cadena corta y alcoholes. Diferencias sutiles en la composición química producen olores distintos, tales como el olor a piña del butirato de etilo frente al olor a albaricoque del butirato de pentilo. Los olores vegetales a menudo dependen de la presencia de compuestos organosulfurados. Una estructura cíclica con nitrógeno puede oler a comida asada o fermentada, mientras que los alcoholes aromáticos (fenoles) forman parte de los alimentos ahumados.
La mayoría de los ejemplos de la Tabla 1 procede de diferentes tipos de alimentos para que así se pueda comprobar más fácilmente su olor. Puedes distribuir al azar sobre una superficie las plantas adecuadas y muestras de alimentos y pedir a los estudiantes que agrupen los materiales expuestos según su aroma (les podrías ayudar dándoles los atributos ‘floral’, ‘rancio’, ‘afrutado’, ‘vegetal’, ‘picante’ y ‘humo’). Cuando lo hayan hecho, déjales que comparen sus resultados con la clasificación química de la Tabla 1.
Teniendo en mente las características estructurales, la siguiente cuestión es cómo hace el olfato para distinguir entre grupos funcionales, tamaño y forma general de las moléculas. En muchos procesos fisiológicos que tienen lugar en la membrana celular, los receptores se activan cuando un ligando se une a su dominio extracelular. Este proceso se describe a menudo como una llave que encaja en su cerradura –solo una llave concreta abre la correspondiente cerradura– puesto que el acoplamiento del ligando se debe a su alta especificidad con el sitio aceptor del receptor.
|
Grupo funcional |
Fuente |
Ejemplo |
Aroma |
|---|---|---|---|
|
Alcohol |
Plantas |
Geraniol, linalo |
Fresco, floral |
|
Aldehído; cetona |
Grasa Productos lácteos |
Diacetilo |
Parecido a la mantequilla |
|
Ácido (C1-C12) |
Queso |
Ácido fórmico |
Pungente |
|
Éster, lactona |
Disolvente (estos productos son usados como disolventes |
Acetato de etilo |
Pegamento |
|
Pirazina aromática =N- |
Alimentos asados, cocinados, fermentados |
2-isobutil-3-metoxipirazina |
Tierra, especias, pimienta verde |
|
Compuestos azufrados: alifáticos, aromáticos |
Hortalizas |
Dialildisulfuro |
Ajo |
|
Fenoles (mono-, poli-) |
Alimentos ahumados |
Dialildisulfuro |
Humo de madera |

Algunas de las características más fascinantes de la fisiología del olfato fueron descubiertas por los ganadores del Premio Nobel de 2004 Linda Buck y Richard Axel. A diferencia del modelo simple, pero específico, llave-cerradura que funciona para el gusto, el olfato dispone de toda una batería de células sensoriales. Un solo tipo de molécula fragante puede interaccionar con más de un tipo de receptor, así que la sensación global se debe a la acción de varios receptores activados. Cuando Buck y colaboradores probaron una serie de n-alcoholes alifáticos sobre neuronas individuales de ratón, encontraron que se activaban grupos de neuronas olfativas. Por ejemplo, el pentanol estimulaba débilmente receptores de tipo S3; el hexanol activaba claramente los tipos S3 y S25; el heptanol, los S3, S19 y S25; el octanol, los S18, S19, S41 y S51 y el nonanol, los S18, S19, S41, S51 y S83. De esta manera, un único compuesto odorante es reconocido de forma específica por múltiples receptores olfativos que trabajan de forma conjunta.
Tal modelo de activación del receptor determina que se pueda percibir un amplio repertorio de olores. De hecho, se estima que podemos recordar cerca de mil olores y distinguir hasta diez veces más dependiendo de nuestra edad, experiencia y sensibilidad natural. Sin embargo, nuestra capacidad lingüística para nombrar los aromas se queda muy por debajo de la capacidad de nuestro olfato para diferenciarlos. La industria alimentaria entrena expertos para que reconozcan sutiles matices de los aromas. Como ejemplo de cómo se hace, aplica aceites esenciales diluidos o compuestos aislados que representen un determinado aroma sobre tiras de papel de filtro inodoro y coloca estas en tubos de ensayo con tapón de rosca (ver más abajo).

En este test les puedes ofrecer a los estudiantes olores a: orégano (carvacrol al 1% en propilenglicol), rosa (aceite esencial al 1% en etanol), limón (aceite esencial al 10% en etanol), canela (cinamaldehído al 5% en propilenglicol), frutas (aroma al 5% en propilenglicol) o almendras amargas (benzaldehído al 1% en propilenglicol). Cada estudiante deberá escoger de una lista de cerca de 20 olores y se le pedirá que describa y nombre los aromas sin que se le den los atributos (ver Experimento 1 en la actividad de clasew1).
Una persona no entrenada puede relacionar correctamente un olor con su fuente o con algo que lo produzca, pero aun así puede que no identifique la sustancia original. En un curso que he dado recientemente sobre la evaluación sensorial de alimentos, solo la mitad de los estudiantes reconoció el olor a orégano; la cuarta parte lo confundió con el de tomillo o mejorana, que son aromas parecidos; otros lo identificaron con los olores de romero, albahaca o perejil, que son plantas con aromas bastante diferentes. Sin embargo, algunos estudiantes asociaron correctamente el olor con el de la sopa de tomate, que suele estar aderezada con orégano. Dos tercios de la clase reconocieron el olor de las rosas, y algunos estudiantes lo asociaron correctamente con el de flores cercanas como lilas o melisa o con perfume, pero otros sugirieron erróneamente que correspondía a menta, medicinas o pimienta.
Casi todos los estudiantes reconocieron los olores a almendras amargas, menta y canela, pero fallaron en la identificación de salvia y cilantro. Cuando se dieron las soluciones, todo el mundo reconoció enseguida los olores que previamente había fallado, lo que demuestra que la memoria olfatoria es mucho mejor que nuestra capacidad para nombrar olores concretos.
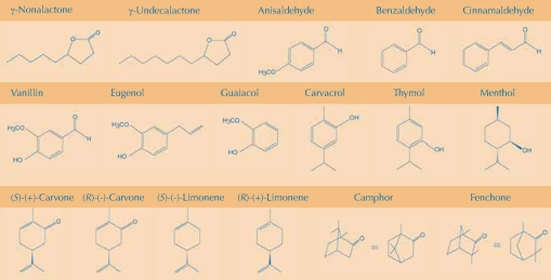
El fino ajuste de la maquinaria de nuestros receptores nos permite diferenciar entre moléculas químicamente muy similares. Muchas fragancias proceden de plantas, y los productos vegetales se pueden utilizar para demostrar cómo pequeños cambios en la estructura química de una molécula odorante dan lugar o a olores completamente diferentes o, al menos, a aromas distinguibles (ver la figura con las estructuras). Los ejemplos están elegidos en función de los siguientes principios químicos:
Alargamiento de una cadena de carbonos: añadir dos grupos metileno (‑CH2‑CH2‑) a la molécula que produce el olor del coco, γ-nonalactona, produce olor a melocotón; insertar un grupo vinilo (-CH=CH-) en el benzaldehído (almendras amargas) produce cinamaldehído (canela).
Intercambio de un grupo funcional: reemplazar el grupo aldehído de la molécula de vainillina por un grupo alilo (‑CH2‑CH=CH2) produce eugenol, el aroma del clavo. El olor del 1-butanol es pungente mientras que el correspondiente ácido carboxílico (ácido butírico) huele como mantequilla rancia o como vómito.
Adición de un grupo funcional: añadir un grupo metoxilo al benzaldehído cambia su olor de almendras amargas a anís.
Posición del grupo funcional: el carvacrol, que tiene un grupo -OH cercano a un ‑CH3 huele como el orégano, mientras que el timol, que tiene un grupo -OH cercano a un ‑CH(CH3)2 huele como el tomillo; el 1-propanol huele como el etanol, mientras que el 2-propanol huele dulce (el número refleja la posición del grupo -OH).
Intercambio entre anillos alifáticos y aromáticos: reemplazar en el timol el anillo bencénico por ciclohexano produce mentol que huele totalmente diferente.
Diferencias estereoquímicas: en general, en las moléculas odorantes quirales, uno de los enantiómeros produce un olor fuerte mientras que el otro casi no huele. Excepciones destacadas son la (S)-(+)-carvona (componente aromático de las semillas de alcaravea) y la (R)-(–)-carvona (hierbabuena). Por su parte, el (S)-(–)-limoneno huele como la turpentina, o trementina, (pino) y el (R)-(+)-limoneno tiene olor a naranja.
Sin embargo, hay compuestos estructuralmente no relacionados que huelen parecido. El ciclooctano, el alcanfor y el 1,8-cineol tienen todos olor alcanforado pese a que el ciclooctano tiene una estructura formada por un único anillo con solo carbono e hidrógeno (C8H16) y el alcanfor y el 1,8-cineol son moléculas bicíclicas con un grupo funcional que tiene oxígeno. La denominada ‘nota verde’ de frutas y verduras sin madurar que se añade a los cosméticos para darles un tono de ‘frescura’, procede de un grupo de aldehídos de 6 carbonos estrechamente relacionados (cis-3-hexenal: tomates recién cogidos; cis-2-hexenal: manzanas verdes; trans-2-hexenal: té verde y negro, tomates recién cogidos). De igual manera, el alcohol cis-3-hexenol (hierba recién cortada), el aldehído de 9 carbonos 2-trans-6-cis-nonadienal (piel de pepino), el ligustral (que tiene un grupo aldehído unido a una estructura cíclica y olor a hierba) e incluso algunas pirazinas (2-propil-3-metoxipirazina: pimientos) tienen esta ‘nota verde’.

Utilizando la amplia gama de compuestos odorantes que contienen las plantas, puedes combinar la química orgánica con la fisiología del olfato para demostrar lo bien que comprendemos nuestro entorno sin ser totalmente conscientes de ello. Si quieres centrarte en entrenar el sentido del olfato, puedes pedir a tus estudiantes que ordenen diferentes diluciones de un aroma según aumenta su intensidad (ver Experimento 2 en las actividades de clasew2). Las dos actividadesw1, w2 deberían estimular a los estudiantes a asociar situaciones cotidianas con la química y hacerles sentir curiosidad por la descripción de nuestro mundo en términos químicos.
Querría agradecer a los estudiantes del curso de entrenamiento sensorial (Escuela Técnica Superior Weihenstephan, semestre de invierno 2006/07) la preparación de las muestras de compuestos odorantes y sus estimulantes aportaciones.
Los estudiantes se pueden ver gratamente sorprendidos al descubrir que los compuestos químicos no solo son responsables de efectos potencialmente peligrosos y/o no deseados sino que también dan lugar a deliciosos olores y sabores. Las actividades que Angelika Börsch-Haubold propone aquí se pueden utilizar para demostrar que la base de los olores está en la química y que nuestra nariz es un sensor químico extremadamente sensible, capaz de detectar sutiles variaciones en las estructuras moleculares.
El artículo es aplicable a la química orgánica en general, con especial relevancia para la tecnología de alimentos. Se podría relacionar con la discusión acerca del uso de aditivos alimentarios (artificiales) o de la modificación genética de cultivos. También podría ser útil como lectura de base para las lecciones sobre los sentidos.
Matthew Fletcher, Reino Unido
Download this article as a PDF